¶ Folha de rosto
©2025 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária - MAPA
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Coordenação-Geral de Laboratórios Agropecuários - CGAL
Esplanada dos Ministérios, Bloco D, Anexo A, 3º andar, sala 315
CEP: 70.043-900, Brasília - DF
Tel.: (61) 3218-3269
Sítio eletrônico: https://wikisda.agricultura.gov.br
e-mail (dúvidas e sugestões): ras@agro.gov.br
Central de Relacionamento: 0800-704-1995
Coordenação dos trabalhos técnicos: Júlio César Garcia - (LASO/LFDA-MG)
Equipe Técnica:
| Alessandra de Oliveira Pulcineli - (LASO/LFDA-GO) | Maria Izabel Furst Gonçalves - (LASO/LFDA-MG) |
| Érica Cardoso Vilela Barbara - (LASO/LFDA-GO) | Maria Paula Domene - (LASO/CATI) |
| Ernesto do Nascimento Viegas - (CGAL/DTEC) | Matheus Emanuel de Queiroz - (LASO/LFDA-MG) |
| Fábio Lopes da Cruz - (LASO/LFDA-MG) | Melissa Yurie Toguchi - (LASO/LFDA-GO) |
| Fabrício Pedrotti - (CGAL/DTEC) | Nilson C. Castanheira Guimarães - (CGAL/DTEC) |
| Henrique Martins Sant’Anna - (LASO/LFDA-RS) | Patrícia Branco Piano - (LASO/LFDA-RS) |
| Henrique Sérgio Lima - (LASO/LFDA-PE) | Patrícia Ribeiro Cursi - (LASO/CATI) |
| Hiromi S. Y. Sassagawa Sant’Anna - (LASO/LFDA-RS) | Sylvia T. B. de Oliveira Sabino - (LASO/LFDA-PE) |
| Luiz Artur Costa do Valle - (LASO/LFDA-MG) | Vitor Breda Bezerra Rego - (LASO/LFDA-RS) |
| Magda Birck Garcia - (LASO/LFDA-RS) |
AGRADECIMENTOS:
A Coordenação-Geral de Laboratórios Agropecuários (CGAL/DTEC/SDA/MAPA) e a Equipe Técnica responsável pela elaboração deste documento gostariam de manifestar sua gratidão e seu reconhecimento às seguintes Comissões de Sementes e Mudas (CSMs) cujas contribuições foram de grande relevância para a revisão destas Regras para Análise de Sementes (RAS):
CSM-PA: SFA-PA, LFDA-PA, ADEPARA, EMATER-PA, AEAPA, SEDAP-PA, IBGE-PA, BANPARA, CEPLAC, UFRA, IDEFLOR, IFIBRAM, ELETRONORTE e EMBRAPA.
CSM-MT: SFA-MT, INDEA, APROSMAT, UNEMAT, UFMT, Potato Semente, Petrovina Sementes, Fundação Pró-Sementes, Amaggi, Sementes Bom Futuro, Agrossol Sementes e Solum Laboratório.
CSM-MS: SFA-MS, AGRAER-MS, IAGRO, CREA-MS, Embrapa Gado de Corte, Embrapa CPAO, FAMASUL, Banco do Brasil, UEMS e UFGD.
CSM-MG: SFA-MG, LASO/LFDA-MG, APSEMG, CONAB, CREA-MG, EMATER-MG, EMBRAPA Milho e Sorgo, EPAMIG, FAEMG, FETAEMG, IMA, OCEMG, SIF, UFLA, UFU, UFVJM e UFV.
CSM-SP: SFA-SP, SISV-SP, CATI, ABCSEM, APPS, ANPROSEM, APTA/SAA-SP, ANGL, CDRS/SAA-SP, CDA/SAA-SP, CONAB, Embrapa Sudeste, ESALQ, FAESP, FETAESP, IAC, IB/APTA/SAA-SP, IZ/APTA/SAA-SP, UFSCAR, UNESP, VIVECITRUS, Câmara Setorial do Amendoim, Instituição Nativas Brasil e CREA-SP.
CSM-PR: SFA-PR, ADAPAR, CREA-PR, Embrapa Floresta, Embrapa Soja, FAEP, FEAPR, Fundação Meridional, Fundação Pró Sementes, IDR-PR, OCEPAR e UFPR.
CSM-SC: SFA-SC, EMBRAPA, CCA/UFSC, CAV/UDESC, SAR, CIDASC, OSESC, ABPM, FPS, ACR, APROSESC, EPAGRI, ACAPSA e ACAFRUTA.
CSM-RS: SFA-RS, LASO/LFDA-RS, APASSUL, AGEFLOR, EMATER-RS, SULPASTO, CREA-RS, CGCL, Embrapa Trigo, FARSUL, FEARROZ, FECOAGRO-RS, FETAG-RS, FPS, SEAPDR-RS, SARGS, UPF, UFPEL, UFSM, UNIPAMPA e UFRGS.
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Definir os métodos oficiais a serem utilizados nas análises para identificação e verificação da qualidade de lotes de sementes a serem comercializados. |
|||
|
Processo: Análise de sementes |
||||
|
Entrega: Garantia da identidade e qualidade de lotes de sementes |
Público alvo e demais interessados: Laboratórios de Análise de Sementes credenciados no Renasem |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação-Geral de Laboratórios Agropecuários – CGAL, vinculada ao Departamento de Serviços Técnicos - DTEC da Secretaria de Defesa Agropecuária – SDA, do Ministério da Agricultura e Pecuária – MAPA é o órgão responsável pela Rede Nacional de Laboratórios Agropecuários do Sistema Unificado de Atenção à Sanidade Agropecuária e possui dentre suas atribuições estabelecer, uniformizar e oficializar métodos para a realização de análises. |
||||
¶ 1.0 ESCOPO
Este capítulo trata da metodologia para a amostragem de lotes de semente de todas as espécies, não florestais e florestais, sendo aplicável inclusive para sementes revestidas e misturas de sementes.
Quando há pesos estabelecidos para a amostra média de sementes de determinada espécie, estes constam no Quadro 1.6 (espécies florestais) e no Quadro 1.5 (espécies não florestais). Estes pesos não devem ser utilizados para sementes revestidas, para as quais as instruções para obter a amostra média constam no subitem 1.4.4.4.
Quando as sementes não forem revestidas e não houver pesos de amostras prescritos nos Quadros 1.5 ou 1.6, ver o subitem 1.4.4.2, que descreve como o peso da amostra média pode ser obtido. A forma de obtenção do peso da amostra média de “Mistura de Semente” está prescrita no subitem 1.4.4.3.
A metodologia para a amostragem que é realizada no laboratório, destinada à obtenção de amostras de trabalho, também integra o escopo deste capítulo. Os princípios gerais desta atividade também se estendem a sementes revestidas e misturas de sementes, porém há recomendações especificas nos capítulos destinados exclusivamente a estes tipos de amostras (Capítulo 8 e Capítulo 10, respectivamente).
¶ 1.1 OBJETIVO
Obter uma amostra representativa do lote ou de parte dele, que quando subdividido, seja de tamanho adequado para os testes e na qual estejam presentes os mesmos componentes do lote de sementes e em proporções semelhantes à sua ocorrência.
¶ 1.2 DEFINIÇÕES
¶ 1.2.1 LOTE
É uma quantidade definida de sementes, identificada por letras, por números ou pela combinação dos dois, da qual cada porção é, dentro de tolerâncias permitidas, homogênea e uniforme para as informações contidas na identificação.
Todas as embalagens de um lote devem estar identificadas com a mesma designação, a qual deve constar nos Boletins de Análise de Sementes. As amostras também devem ser identificadas de forma a manter um vínculo inequívoco com o lote de sementes de onde foram coletadas.
¶ 1.2.2 AMOSTRAS
a) Amostra simples:
Pequena porção de sementes retirada de um ponto do lote de sementes.
b) Amostra Composta:
Aquela formada pela combinação e mistura de todas as amostras simples retiradas do lote de sementes.
c) Amostra Média:
A própria amostra composta ou subamostra desta, submetida ao laboratório para análise, com tamanho mínimo especificado nestas Regras para Análise de Sementes - RAS ou em normas específicas (ex.: Padrões de Identidade e Qualidade de cada espécie).
d) Amostra em Duplicata:
É outra amostra obtida da amostra composta por ocasião da obtenção da amostra média. É coletada e devidamente lacrada nas ações de fiscalização da produção e do comércio de sementes, para ser utilizada em caso de reanálise, se houver discordância do resultado da análise fiscal.
e) Amostra de Trabalho:
É a amostra obtida no laboratório por homogeneização e redução da amostra média até os pesos prescritos e nunca inferiores aos do Quadro 1.5 (espécies não florestais) ou do Quadro 1.6 (espécies florestais) ou aos pesos estabelecidos em normas específicas, considerando-se as análises que serão realizadas.
Para sementes revestidas os pesos devem estar de acordo com o número de pelotas/sementes estabelecido no Quadro 1.3 (sementes pelotizadas, incrustadas ou em grânulos) ou no Quadro 1.4 (sementes em fitas ou em lâminas).
Para misturas de sementes, ver Capítulo 10 “Análise de Mistura de Sementes” destas RAS.
f) Subamostra:
É a porção de uma amostra obtida pela redução da amostra de trabalho, usando-se um dos equipamentos e métodos de divisão prescritos no subitem 1.5.2.
¶ 1.2.3 AMOSTRA LACRADA
É a amostra em que as embalagens individuais estão fechadas de tal modo que não possam ser abertas e novamente fechadas, sem que fique evidente que foram violadas.
¶ 1.2.4 SEMENTES TRATADAS
Sementes nas quais agrotóxicos e afins, corantes ou outros aditivos foram aplicados sem causar mudança significativa de tamanho, formato ou peso da semente original. São exemplos de aditivos: nutrientes, hormônios, inoculantes e polímeros.
As sementes tratadas devem ser amostradas e analisadas da mesma forma que as sementes não tratadas e sem a retirada dos tratamentos.
¶ 1.2.5 SEMENTES REVESTIDAS
São aquelas que apresentam alterações no seu formato, tamanho ou peso pela adição de materiais aglomerantes. Normalmente, as sementes não podem ser identificadas sem a remoção do material aglomerante. São divididas nos tipos: sementes pelotizadas, incrustadas, em grânulos, em lâminas ou em forma de fitas, com ou sem tratamento como os indicados no subitem 1.2.4 “Sementes Tratadas”.
¶ 1.2.5.1 SEMENTES PELOTIZADAS
São unidades aproximadamente esféricas desenvolvidas para semeadura de precisão, normalmente contendo uma única semente, cujo tamanho e formato original nem sempre ficam evidentes.
¶ 1.2.5.2 SEMENTES INCRUSTADAS
São unidades que mantêm aproximadamente o mesmo formato das sementes originais, com tamanho e peso modificados em maior ou menor extensão.
¶ 1.2.5.3 SEMENTES EM GRÂNULOS
São unidades com formato aproximadamente cilíndrico que podem conter mais de uma semente por grânulo.
¶ 1.2.5.4 SEMENTES EM FITAS
São fitas estreitas de papel ou de outro material degradável com sementes espaçadas em grupos, linhas ou aleatoriamente.
¶ 1.2.5.5 SEMENTES EM LÂMINAS
São sementes aderidas a lâminas largas de papel ou de outros materiais degradáveis, com sementes distribuídas sobre elas em linhas, grupos ou ao acaso.
¶ 1.2.6 LOTES PEQUENOS
Para fins de amostragem, são considerados lotes pequenos aqueles nos quais a coleta de amostras médias no tamanho prescrito teria um efeito significativo no peso das sementes restantes no lote.
Também são considerados lotes pequenos aqueles com tamanho igual ou menor do que 1% do peso máximo do lote indicado no Quadro 1.5 ou em normas específicas.
¶ 1.2.7 LOTES DE ALTO VALOR
Na amostragem, lotes de alto valor incluem, mas não se limitam, a lotes de sementes híbridas que são vendidas por unidade, ou sementes que não são comercialmente disponíveis ou que são usadas para fins de pesquisa, melhoramento ou preservação de uma espécie ou de uma cultivar pelo seu mantenedor.
¶ 1.2.8 MISTURA DE SEMENTES
É a mistura de sementes, em um mesmo lote, de espécies, de cultivares ou de ambas, que devem estar individualmente inscritas no Registro Nacional de Cultivares - RNC. A mistura de sementes deve ser composta por sementes oriundas de lotes produzidos e aprovados individualmente.
¶ 1.2.9 REPRESENTATIVIDADE
Refere-se ao tamanho do lote e deve ser expressa conforme informação do requerente, desde que essa informação seja coerente, podendo ser:
a) peso total expresso em gramas (g), quilogramas (kg) ou toneladas (t);
b) número de embalagens indicando o peso ou número de sementes em cada embalagem, por exemplo, 40 sacos de 20 kg (40 sc/20 kg) ou 100 envelopes de 1.000 sementes (100 envelopes/1.000 sem)
Na formação do lote, todas as embalagens devem ter o mesmo peso ou número de sementes.
¶ 1.3 CONDIÇÕES PARA AMOSTRAGEM
Um lote deve ser o mais homogêneo possível. Entretanto, lotes de sementes dificilmente são perfeitamente homogêneos. Por esse motivo, considera-se lote homogêneo uma quantidade definida de sementes cujos componentes estejam razoável e uniformemente distribuídos por toda a sua massa.
A amostragem deve ser recusada se o lote for claramente heterogêneo de tal modo que diferenças entre embalagens ou amostras simples sejam facilmente visíveis ao amostrador. As amostras simples devem ser comparadas visualmente umas com as outras durante a amostragem e somente podem ser combinadas para formar a amostra composta se aparentarem ser uniformes. Caso contrário, o procedimento de amostragem deve ser interrompido. Quando se tratar de amostragem para fins de fiscalização, a critério do agente fiscal, a amostragem pode ser concluída.
Todas as informações relativas ao lote devem ser disponibilizadas ao amostrador. O detentor do lote deve oferecer as condições indispensáveis para a execução das operações relacionadas à amostragem.
O ideal é que o amostrador tenha acesso a todas as faces do lote. No entanto, quando isso não for possível, o lote deve possuir no mínimo duas faces expostas, com espaçamentos suficientes entre as pilhas, e entre as pilhas e as paredes, que permitam a amostragem representativa. A exigência de exposição de no mínimo duas faces dos lotes poderá ser dispensada caso as pilhas possam ser movimentadas com a agilidade necessária, de modo a não comprometer o procedimento de amostragem.
¶ 1.3.1 PESO MÁXIMO DE SEMENTES POR LOTE
O peso máximo do lote não deve exceder ao indicado no Quadro 1.5 (espécies não florestais) ou no Quadro 1.6 (espécies florestais) ou norma específica. Estes pesos máximos também são válidos para sementes revestidas.
Para as espécies não relacionadas no Quadro 1.5 ou no Quadro 1.6 ou em normas específicas, o peso máximo do lote pode ser determinado por comparação com outra espécie de semente que tenha tamanho e peso semelhantes ao da espécie em análise.
O peso máximo de um lote de MISTURA DE SEMENTES de espécies diferentes deve ser o maior peso máximo prescrito entre os componentes da amostra. Por exemplo, para uma mistura de sementes contendo Raphanus sativus (peso máximo de lote = 10.000 kg), Fagopyrum esculentum (peso máximo de lote = 10.000 kg), Vicia sativa (peso máximo de lote = 30.000 kg) e Avena sativa (peso máximo de lote = 30.000 kg), o lote desta mistura deverá ter no máximo 30.000 kg.
¶ 1.3.2 EMBALAGENS E IDENTIFICAÇÃO DO LOTE
O lote deve estar embalado e identificado de acordo com a legislação vigente. A identificação do lote deve estabelecer correspondência com o Boletim de Análise de Sementes.
¶ 1.4 OBTENÇÃO DE AMOSTRAS REPRESENTATIVAS
¶ 1.4.1 INSTRUÇÕES GERAIS
Todos os equipamentos de amostragem devem ser limpos antes do uso para evitar a contaminação cruzada entre lotes.
A representatividade da amostra é um pré-requisito para a estimativa confiável da qualidade do lote de sementes. As amostras devem representar inequivocamente as características do lote e conter todos os seus componentes em proporções semelhantes às que ocorrem no lote.
No caso de sementes acondicionadas em embalagens, as amostras simples devem ser tomadas ao acaso em quantidades aproximadamente iguais, fazendo-se coletas na parte superior, na mediana ou na inferior, porém não necessariamente em mais de um local da mesma embalagem, a menos que seja especificado nas tabelas de intensidade de amostragem.
Quando a semente estiver armazenada ou sendo transportada a granel, as amostras simples devem ser retiradas ao acaso de diferentes pontos e em diferentes profundidades.
Para os lotes que serão acondicionados em pequenas embalagens não perfuráveis e/ou à prova de umidade, a amostragem deverá ser preferencialmente realizada antes do acondicionamento. Quando não for possível realizar a amostragem antes do acondicionamento, devem ser observados os cuidados previstos na nota do subitem 1.4.3.b.
A amostragem de lotes de sementes em fitas e em lâminas deverá ser executada obtendo-se pacotes ou pedaços de fita ou lâminas.
Os instrumentos a serem usados na amostragem não devem danificar as sementes nem as selecionar de acordo com tamanho, formato, densidade, se é palhenta ou não, ou qualquer outra característica de qualidade.
¶ 1.4.1.1 Obtenção de amostras simples
Na definição do número e do tamanho das amostras simples, o amostrador necessita assegurar a intensidade mínima de amostragem conforme descrito no subitem 1.4.3 e a quantidade de sementes suficiente para compor a amostra média prescrita para a espécie e para a amostra duplicata, quando essa for requisitada. Amostras simples devem ser retiradas, com tamanhos aproximadamente iguais, independentemente do número e da posição de coleta no lote.
Amostras simples devem ser retiradas do lote por meio de caladores, que são instrumentos apropriados para esse fim (ver subitens 1.4.2.a e 1.4.2.b) ou no fluxo, imediatamente antes do envase (ver subitem 1.4.2.c). No caso de sementes que não deslizam facilmente, a amostragem deve ser realizada manualmente (ver subitem 1.4.2.d).
¶ 1.4.1.2 Obtenção de amostra composta e média
A amostra composta é aquela obtida pela combinação de todas as amostras simples, as quais devem ser homogeneizadas para formar uma amostra representativa do lote.
Quando a amostra composta apresentar peso muito maior do que o mínimo prescrito para a amostra média, ela pode ser reduzida antes do envio ao laboratório. A redução da amostra composta deve ser feita de acordo com o subitem 1.5 ou, quando a amostra composta for muito grande, podem ser utilizados os métodos de amostragem descritos nos subitens 1.4.2 e 1.4.3. Se a amostra composta já tiver o peso prescrito, pode ser considerada como amostra média, sem a necessidade de redução.
Deve-se dar preferência ao uso de um divisor de amostras adequado (subitem 1.5.2.a) sempre que possível, mas na falta deste, e no caso de sementes frágeis ou que não deslizem facilmente, a redução deve ser feita pelo método manual (subitem 1.5.2.b).
Caso seja difícil homogeneizar e reduzir a amostra no próprio local da amostragem, a amostra composta por inteiro deve ser enviada ao laboratório de análise de sementes.
¶ 1.4.2 INSTRUMENTOS DE AMOSTRAGEM
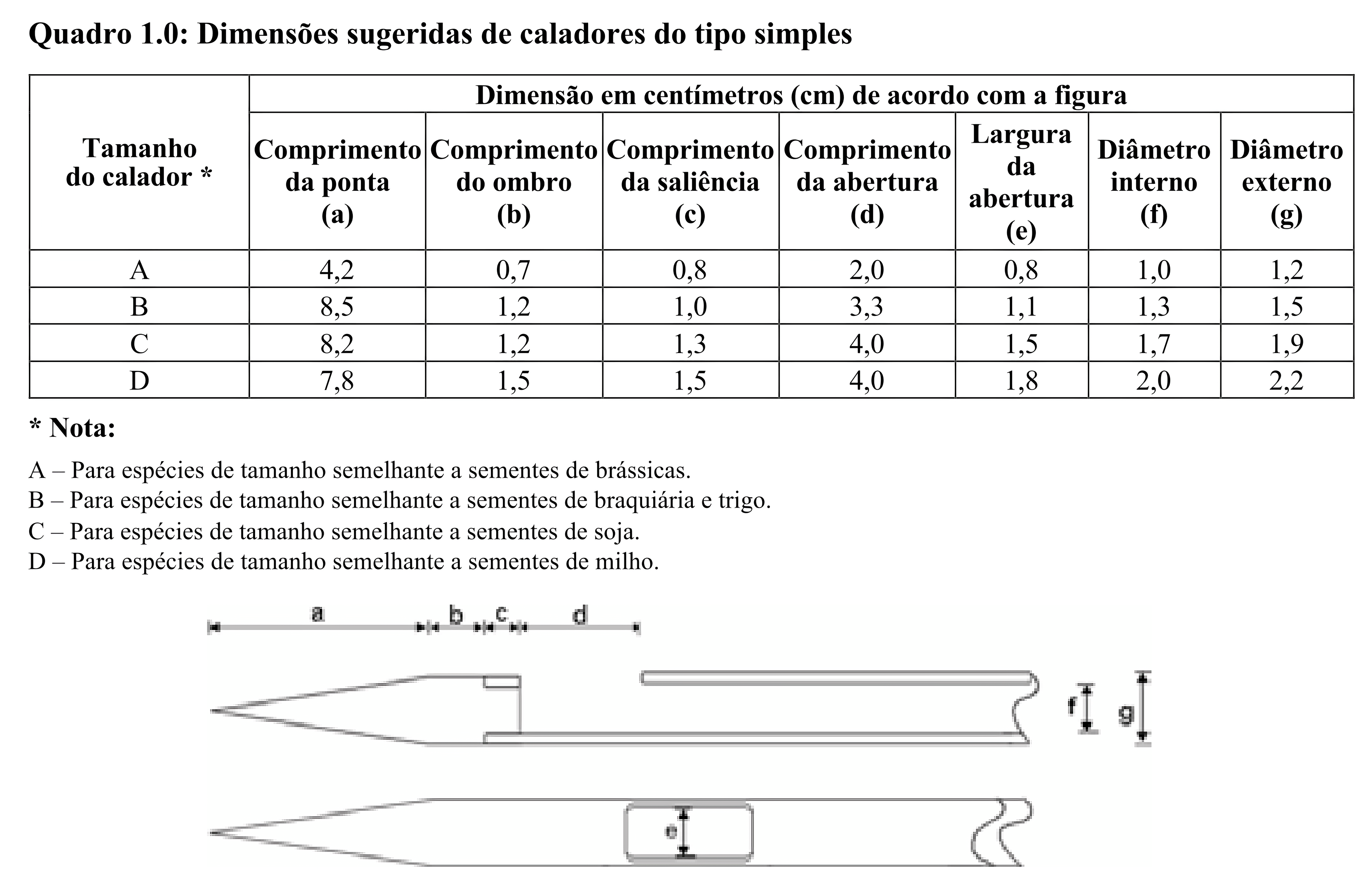
a) Caladores do tipo simples (Calador Nobbe):
Esse tipo de calador serve para a coleta de amostras de sementes acondicionadas em embalagens perfuráveis. Não deve ser utilizado em sementes a granel (silos, galpões, tulhas).
Nota 1: Esse tipo de calador também pode ser utilizado para certas sementes de espécies florestais, desde que tenha as dimensões adequadas às sementes, para que essas deslizem com facilidade e não sofram danos mecânicos, a exemplo das sementes de Ceiba speciosa, Copaiba langsdorffii, Erythrina spp., Mimosa scabrella, Ormosia arborea e similares. As embalagens, além de serem perfuráveis, precisam ser suficientemente resistentes para não serem danificadas/rasgadas durante a amostragem.
É formado por um cilindro com uma abertura oval próxima à extremidade afilada e com um cabo perfurado por onde as sementes são descarregadas (Figura 1.1). O calador deve ser suficientemente longo, de modo que a abertura atinja, no mínimo, o centro da embalagem.
O diâmetro interno mínimo do cilindro deve ser do tamanho suficiente para permitir o fluxo livre das sementes e dos demais componentes do lote. As sugestões de dimensões do calador tipo simples são apresentadas no Quadro 1.0. Em certos casos, quando as sementes do lote a ser amostrado são maiores que a média da espécie ou quando se trata de sementes revestidas, pode ser necessário utilizar caladores com diâmetros maiores do que os indicados nesse quadro.

O calador deve ser cuidadosamente inserido até o eixo central ou até o lado oposto da embalagem com a abertura voltada para baixo e a ponta para cima, formando um ângulo de aproximadamente 30° com a horizontal. Ao girar o calador em 180°, a abertura ficará voltada para cima; retira-se o calador com velocidade decrescente, agitando cuidadosamente a fim de manter o fluxo contínuo de sementes.
Após a retirada do calador, quando possível, deve-se fechar o orifício da embalagem com a ponta do calador (ex.: sacos de algodão ou de polipropileno trançado). Quando isso não for possível (ex.: sacos de papel), a perfuração deve ser fechada com uma etiqueta ou fita adesiva bem aderente e resistente.
Não é permitida a utilização do comumente denominado “calador ladrão” ou “furador”, apresentado na Figura 2.1, pois este calador possui o comprimento da abertura muito superior às recomendadas no Quadro 1.0, o que prejudica a coleta de amostras representativas.

b) Caladores do tipo duplo:
O calador do tipo duplo é composto por duas partes, uma das quais se encaixa na outra, suficientemente justapostas para que as sementes ou impurezas não deslizem entre elas. O tubo externo apresenta uma ponta sólida e afilada (Figura 1.3). Ambos os tubos têm aberturas ou janelas em suas paredes, permitindo que a cavidade do tubo interno possa ser aberta ou fechada pela movimentação de um tubo em relação ao outro por um movimento de rotação ou de empurrar-puxar.

Esse tipo de calador pode ser usado de forma horizontal, diagonal ou vertical. Deve ser longo o suficiente de forma que alcance o outro lado da embalagem ou o fundo dela, quando usado verticalmente.
Quando usado verticalmente ou diagonalmente de cima para baixo, o calador deve ter também repartições internas (septos) que o dividam em compartimentos. O seu diâmetro interno mínimo deve ser suficiente para permitir o fluxo livre das sementes e dos demais componentes do lote pelo calador.
Quando em uso, inserir lentamente o calador fechado na massa de sementes até alcançar a posição desejada. Em seguida, abrir e agitar levemente o calador para permitir que os compartimentos se encham completamente. Fechar cuidadosamente as aberturas para não danificar as sementes. Retirar o calador da massa de sementes, despejando a amostra simples em um recipiente. O conteúdo completo do calador duplo septado deve ser considerado como uma amostra simples, e não o conteúdo individual de cada compartimento. Os orifícios feitos com o calador devem ser fechados como descrito no subitem 1.4.2.a.
Nota 2: O calador tipo duplo pode ser utilizado para as sementes de espécies florestais citadas no subitem 1.4.2.a, desde que as embalagens sejam adequadas a esse tipo de calador.
c) Amostragem no fluxo:
As amostras simples deverão ser coletadas imediatamente antes do acondicionamento das sementes do lote, em intervalos regulares durante todo esse processo para a formação da amostra composta, conforme intensidade de amostragem prescrita no Quadro 1.2. Quando for usado um coletor que intercepte o fluxo de sementes, toda a seção transversal do fluxo deve ser uniformemente amostrada. O coletor pode ser movimentado manual ou mecanicamente através do fluxo de sementes.
d) Amostragem Manual:
Esse método pode ser usado para todas as espécies, sendo considerado o mais adequado para sementes que podem ser danificadas pelo uso de caladores, sementes aladas, sementes com baixa umidade, sementes em fitas, sementes em lâminas, e, ainda, sementes de espécies que não deslizam facilmente, a exemplo de sementes extremamente palhentas dos gêneros Andropogon, Cenchrus, Chloris, Hyparrhenia e Melinis.
Nota 3: Também pode ser utilizado para todas as espécies florestais, sendo o método mais indicado para sementes sensíveis a danos mecânicos ou para aquelas que não deslizam facilmente, como as sementes e/ou frutos alados. Como exemplo, citamos as espécies Cybistax antisyphilitica, Gallesia integrifolia, Jacaranda micrantha, Myrocarpus frondosus e Paratecoma peroba; e dos gêneros Aspidosperma, Balfourodendron, Cedrela, Centrolobium, Handroanthus, Khaya, Lafoensia, Swietenia, Tabebuia, Vochysia, Zeyheria.
Na amostragem manual, todas as sementes da embalagem, independentemente da posição em que se encontram, devem estar acessíveis ao amostrador. As embalagens que apresentarem camadas de difícil acesso através da sua abertura normal podem ser parcialmente ou completamente esvaziadas para a realização da amostragem e depois recompostas.
Para executar a amostragem manual, deve-se limpar as mãos e, se necessário, utilizar luvas. Inserir a mão aberta na embalagem até a posição desejada. Fechar a mão e retirá-la da embalagem, tomando cuidado para que nenhuma semente escape. A seguir, esvaziar a mão em um recipiente coletor. Cada retirada manual é considerada uma amostra simples.
¶ 1.4.3 INTENSIDADE MÍNIMA DA AMOSTRAGEM
Para lotes de sementes acondicionados em embalagens com capacidade de até 100 kg, a intensidade mínima de amostragem deve seguir os seguintes critérios:
a) Para embalagens de sementes contendo entre 15 e 100 kg (inclusive), o número de amostras simples será o previsto no Quadro 1.1.
b) Para embalagens de sementes contendo menos de 15 kg, deve-se combiná-las em unidades amostrais que não excedam 100 kg, por exemplo, 20 embalagens de 5 kg ou 33 embalagens de 3 kg ou 100 embalagens de 1 kg. Para se determinar a intensidade de amostragem prescrita no Quadro 1.1, cada unidade amostral deve ser considerada como uma única embalagem.
Nota 4: para embalagens que não podem ser amostradas com os procedimentos descritos no subitem 1.4.2, a amostragem pode ser realizada tomando-se como amostras simples as embalagens inteiras e fechadas. O número de amostras simples a ser retirado deve seguir o prescrito no Quadro 1.1 e ser suficiente para suprir a quantidade mínima de sementes exigida para compor a amostra média da espécie em questão. Este é o caso das embalagens herméticas, estas não devem ser perfuradas ou abertas, devendo, portanto, ser coletadas inteiras.
c) Para sementes revestidas acondicionadas em embalagens contendo menos do que 300.000 sementes, estas devem ser combinadas em unidades amostrais que não excedam 2.000.000 de sementes. Para se determinar a intensidade de amostragem prescrita no Quadro 1.1, cada unidade amostral deve ser considerada como uma embalagem.


|
Exemplo 1: Considerando um lote de 3.800 kg (760 embalagens de 5,0 kg): a) Cálculo do número máximo de embalagens por unidade amostral: 100 kg ÷ peso da embalagem (em kg) = 100 kg ÷ 5 kg = 20 embalagens b) Cálculo do número total de unidades amostrais: Total de embalagens do lote ÷ nº de embalagens por unidade amostral = 760 ÷ 20 = 38 unidades amostrais c) Obtenção do número de amostras simples a serem retiradas do lote: Consultar a intensidade de amostragem no Quadro 1.1: 38 unidades amostrais = 20 amostras simples. (Aproximadamente uma amostra simples a cada duas unidades amostrais ou a cada 40 embalagens) |
|
Exemplo 2: Considerando um lote de 220 kg (44 embalagens de 5,0 kg): a) Cálculo do número máximo de embalagens por unidade amostral: 100 kg ÷ peso da embalagem (em kg) = 100 kg ÷ 5 kg = 20 embalagens b) Cálculo do número total de unidades amostrais: Total de embalagens do lote ÷ nº de embalagens por unidade amostral = 44 ÷ 20 = 2,2 = 3 unidades amostrais Considerando unidades amostrais de 100kg
3 unidades amostrais = 9 amostras simples (sendo 3 de cada unidade amostral). |
Nota 5: Opcionalmente, é possível utilizar a Calculadora de Amostragem da ISTA (ISTA Sampling Calculator) para calcular a intensidade de amostragem de lotes cujos pesos máximos e de amostras médias prescritos nas Regras ISTA em vigor, sejam compatíveis com os prescritos por estas Regras para Análise de Sementes - RAS. O acesso à calculadora está disponível no link: https://www.seedtest.org/en/services-header/tools/bulking-sampling-committee.html.
¶ 1.4.4 PESOS DAS AMOSTRAS MÉDIAS
¶ 1.4.4.1 Sementes não revestidas de espécies com pesos estabelecidos
Para espécies não florestais, o Quadro 1.5 indica os pesos mínimos das amostras médias e das amostras de trabalho para a Análise de Pureza e para a Determinação de Outras Sementes por Número – DOSN.
O peso da amostra de trabalho para Análise de Pureza foi calculado para conter, no mínimo, 2.500 sementes. O peso da amostra de trabalho usado na Determinação de Outras Sementes por Número é calculado em, no máximo, 10 vezes o peso da amostra de pureza, mas limitado a um máximo de 1.000 gramas.
Para espécies florestais, os pesos mínimos de amostra média e de amostra de trabalho para Análise de Pureza estão prescritos no Quadro 1.6. Os pesos de amostras de algumas espécies foram calculados conforme descrito acima. Para a maioria das espécies, a definição dos pesos utilizou como base o número de sementes/kg e o número de sementes necessárias para fazer teste e reteste de germinação, conforme correlação apresentada na Tabela 1.1 “Indicação de número aproximado de sementes na amostra média, Análise de Pureza e Testes de Germinação de Espécies Florestais”.
Excepcionalmente, os pesos das amostras de sementes não revestidas podem constar em normas específicas.
Nota 6: Quando a amostra média se destinar à reanálise para revalidação do lote, a amostra média deve ter peso mínimo correspondente à metade da amostra média prescrita no Quadro 1.5 ou Quadro 1.6, ou, se for o caso, em normas específicas. Ressalta-se que essa orientação somente pode ser utilizada para espécies florestais que tem número de sementes por quilo igual ou maior que 5.001. Para outras espécies florestais, para não faltar sementes para os testes de germinação, o peso da amostra para revalidação deve ser no mínimo o peso da amostra média prescrito no Quadro 1.6.
¶ 1.4.4.2 Sementes não revestidas de espécies que não tem pesos estabelecidos
Quando não houver prescrição dos pesos das amostras, o Peso de Mil Sementes - PMS deve ser determinado e utilizado como referência para o cálculo do peso das amostras de trabalho.
A amostra de trabalho para Análise de Pureza deverá conter, no mínimo, 2.500 sementes e a amostra de trabalho para DOSN deverá conter, no mínimo, 25.000 sementes e, no máximo, 1.000 gramas, assim como a respectiva amostra média. No caso de sementes grandes (com Peso de Mil Sementes - PMS maior ou igual a 1.000 g), a amostra média deve ter no mínimo 1.000 sementes, limitada até 2.500 g. Para sementes florestais com PMS maior ou igual a 5.000 g, a amostra média deve ter no mínimo 250 sementes.
Quando não for possível obter o PMS para determinar o peso da amostra média, este pode ser obtido por comparação com outra espécie de semente que tenha tamanho e peso semelhantes aos da espécie em análise, devendo ser suficiente para realizar todas as análises necessárias.
¶ 1.4.4.3 Misturas de sementes
No caso de misturas de sementes, pode-se considerar o peso de amostra média do componente da mistura com o maior peso de amostra média prescrito. Por exemplo, em uma mistura de sementes contendo Raphanus sativus (amostra média = 300 g), Fagopyrum esculentum (amostra média = 600 g), Vicia sativa (amostra média = 1000 g) e Avena sativa (amostra média = 1000 g), deve-se coletar, no mínimo, 1000 g da mistura, pois esse é o maior peso prescrito de amostra média de seus componentes (V. sativa e A. sativa). Também é possível definir o peso da amostra calculando-se a média ponderada dos pesos das amostras médias de cada uma das espécies declaradas na composição da mistura de sementes, conforme os pesos prescritos no Quadro 1.5 do Capítulo 1 “Amostragem” ou em normas específicas
¶ 1.4.4.4 Sementes revestidas
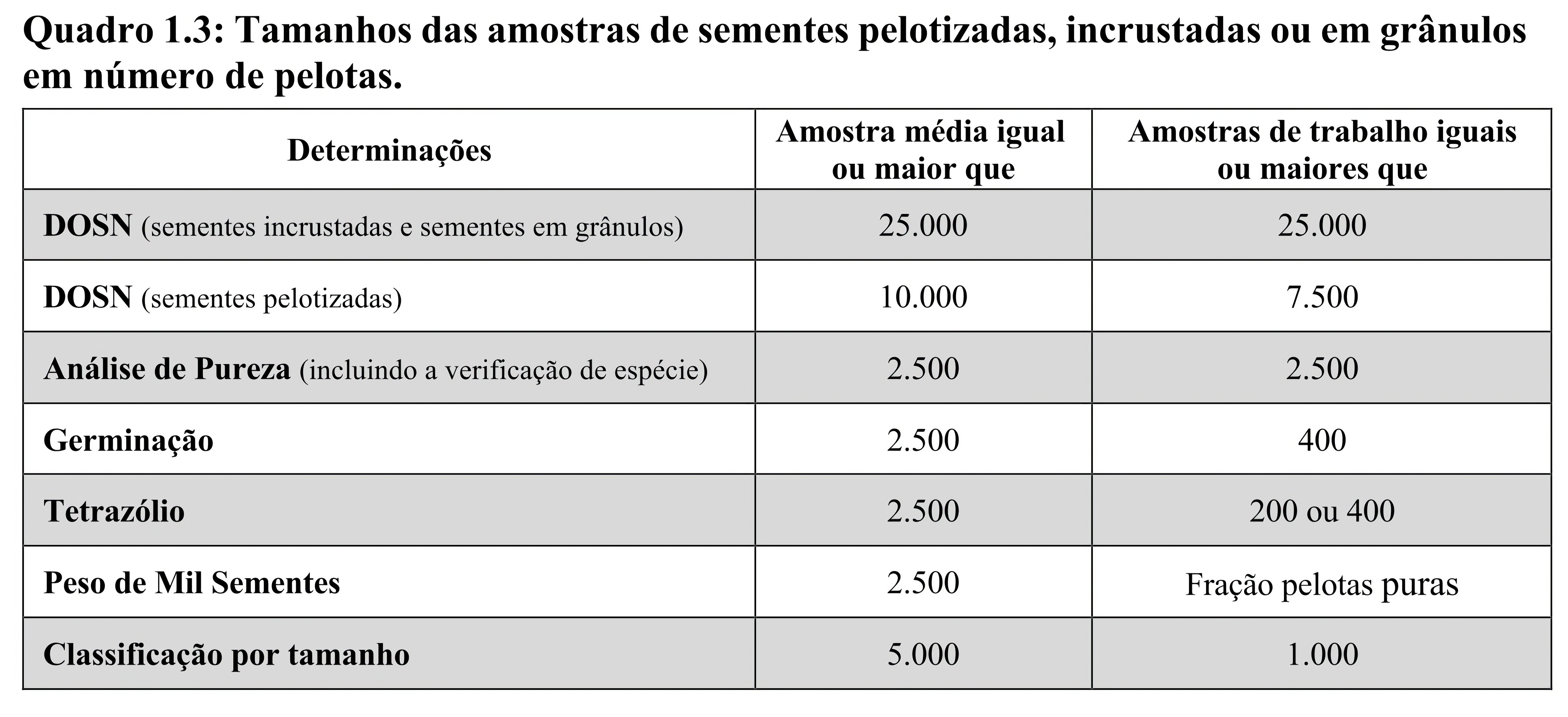
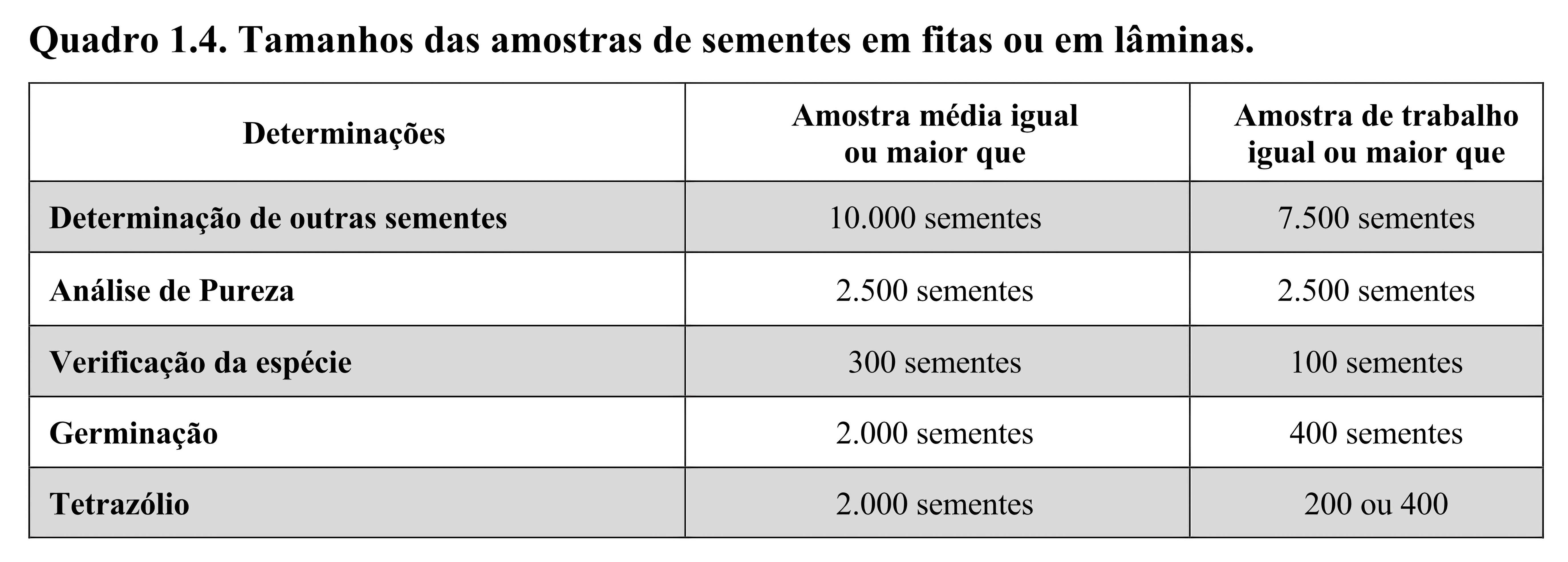
O que define os pesos das amostras médias deste tipo de sementes é o número mínimo de pelotas/sementes revestidas que deve estar contido nesta amostra. Esse número varia com o tipo de revestimento e das análises que serão realizadas. Para sementes pelotizadas, incrustadas ou em grânulos consultar a segunda coluna do Quadro 1.3 e para sementes em fitas ou em lâminas, a segunda coluna do Quadro 1.4. Os cuidados para obtenção de amostras médias de sementes revestidas constam no subitem 8.3.4 do Capítulo 8 “Análise de Sementes Revestidas” destas RAS.
A Determinação de Outras Sementes por Número – DOSN de sementes revestidas é obrigatória para todas as espécies que têm peso prescrito para essa análise no Quadro 1.5, ressalvado o disposto em normas específicas.
A amostra média deve possuir, no mínimo, o número de pelotas/sementes prescrito para a determinação que exige o maior número de sementes. Por exemplo, como pela legislação vigente é necessário realizar a DOSN de sementes incrustadas de Urochloa brizantha, a amostra média de sementes incrustadas desta espécie deve ter no mínimo 27.500 pelotas, sendo 25.000 pelotas para a realização da DOSN e 2.500 para a Análise de Pureza. Se a DOSN não for obrigatória para a espécie, a amostra média deve possuir o número mínimo de sementes revestidas prescrito para a Análise de Pureza.
Nota 7: quando se tratar de lotes pequenos ou lotes de alto valor, após a finalização das análises, há situações em que é permitida a devolução das sementes remanescentes (ver subitem 1.6.2).
Quando a amostra média se destinar à reanálise para revalidação do lote de sementes pelotizadas, incrustadas ou em grânulo, a amostra média deve possuir no mínimo 2.500 pelotas, pois este é número mínimo prescrito no Quadro 1.3 para a realização do teste de germinação ou do teste de tetrazólio. Para sementes em fita ou em lâminas, a amostra média deve possuir no mínimo 2.000 sementes. Para lotes pequenos ou lotes de alto valor, conforme definido nos subitens 1.2.6 e 1.2.7, é permitido utilizar amostras médias com menor número de sementes revestidas desde que haja número suficiente para realização de dois testes de germinação (no mínimo 850 sementes) ou dois testes de tetrazólio (no mínimo 450 sementes), o que for o caso.
Nota 8: ressalta-se que, como revestimento altera os pesos das sementes, não é possível utilizar os mesmos pesos prescritos no Quadro 1.5 ou no Quadro 1.6 ou em normas específicas para obter as amostras médias de sementes revestidas.
Nota 9: Após obter o número mínimo de pelotas/sementes necessário para a amostra média, é possível utilizar as informações da embalagem (“peso de mil sementes”, “número de sementes por unidade de peso” ou “número de sementes por embalagem”) para estimar, por regra de três, o peso mínimo da amostra média. Recomenda-se acrescentar ao peso calculado mais 20%, pois pela legislação atual, existe uma tolerância de 20% com relação ao valor expresso na embalagem.
¶ 1.4.4.5 Amostras médias menores que o prescrito
Se a amostra média recebida no laboratório de análise de sementes tiver peso ou número de pelotas ou de sementes inferior ao especificado nestas RAS, o requerente deve ser notificado e a análise suspensa até que outra amostra de tamanho adequado seja recebida. A critério do MAPA, amostras oficiais com pesos inferiores poderão ser recebidas e analisadas.
No caso de lotes pequenos ou lotes de alto valor (ver subitens 1.2.6 e 1.2.7), é permitido receber amostras médias menores, tendo, no mínimo, o peso suficiente para a realização das análises obrigatórias. A seguinte declaração deverá constar no Boletim de Análise de Sementes: “Lote pequeno ou de alto valor. A amostra média pesou apenas ....g”.
Os pesos mínimos das amostras médias para outras determinações, por exemplo, Grau de Umidade, se encontram relacionados nos capítulos específicos destas RAS.
¶ 1.4.5 EMBALAGEM, IDENTIFICAÇÃO E REMESSA DA AMOSTRA
A embalagem da amostra média deve ser de material resistente para não se romper durante a remessa ao laboratório. Para o transporte, as embalagens individuais devem ser adequadamente fechadas e acondicionadas de maneira a evitar danos por contaminação, impacto, excesso de calor e umidade.
A embalagem da amostra média deve ser identificada de maneira a estabelecer sua conexão com o respectivo lote e deve conter no mínimo as seguintes informações:
- Amostra para fins de identificação do lote:
a) Nome da espécie, denominação da cultivar, categoria e safra (para florestais, mês/ano da coleta).
b) Identificação do lote.
c) Indicação de que a semente foi tratada, quando for o caso.
- Amostra fiscal:
a) Número do Termo de Coleta de Amostras - TCA.
b) Nome da espécie, denominação da cultivar, categoria e safra (para florestais, mês/ano da coleta).
c) Número da amostra no TCA e identificação do lote;
d) Indicação de que a semente foi tratada, quando for o caso.
e) Assinatura do servidor da auditoria fiscal do Ministério da Agricultura e Pecuária - MAPA ou do agente público qualificado dos Estados ou do Distrito Federal e do fiscalizado ou de seu preposto ou responsável técnico ou testemunha, no caso de recusa destes.
A amostra destinada à fiscalização de sementes deverá ser acompanhada de um Termo de Coleta de Amostras - TCA. A amostra para fins de identificação do lote deve ser acompanhada do respectivo Termo de Amostragem. A amostra destinada à certificação deverá ser acompanhada do seu Termo de Amostragem, no caso de certificador de produção própria ou entidade certificadora, ou do Termo de Coleta de Amostra, no caso de certificação feita pelo próprio MAPA. Para outras finalidades, o laboratório deve manter registros dos dados fornecidos pelo requerente.
Amostras cujas sementes serão utilizadas em Testes de Germinação não devem ser acondicionadas em embalagens herméticas, exceto quando se tratar de lotes de sementes acondicionados originalmente em embalagens herméticas. O material da embalagem deve assegurar a qualidade e identidade do lote de sementes, considerando o comportamento fisiológico das sementes em relação à tolerância à dessecação e ao armazenamento.
Quando as amostras médias forem destinadas a outras determinações, devem ser seguidas as recomendações específicas que constam do capítulo que descreve essa determinação. Por exemplo, é recomendável que amostras para a determinação do Grau de Umidade sejam remetidas separadamente, utilizando-se, preferivelmente, embalagens impermeáveis e herméticas.
O responsável pela amostragem deve remeter as amostras coletadas, sem demora, ao laboratório de análise de sementes. Quando as sementes forem tratadas quimicamente com agrotóxicos, é recomendado que o nome do produto, do ingrediente ativo e a dosagem utilizada sejam fornecidos juntamente com a amostra.
¶ 1.5 OBTENÇÃO DE AMOSTRA DE TRABALHO
¶ 1.5.1 INSTRUÇÕES GERAIS
A amostra média recebida pelo laboratório necessita ser homogeneizada e reduzida a uma ou mais amostras de trabalho, de peso igual ou até 3% superior aos prescritos no Quadro 1.5 (espécies não florestais) ou Quadro 1.6 (espécies florestais) ou normas específicas, as quais serão usadas nas diversas determinações.
Para obtenção de amostras de trabalho de sementes revestidas, o tamanho das amostras deverá considerar o Peso de Mil Sementes - PMS da amostra e estar de acordo com as instruções e Quadros do Capítulo 8 “Análise de Sementes Revestidas” destas RAS.
Quando se tratar de misturas de sementes, os pesos das amostras de trabalho devem estar de acordo com o prescrito no Capítulo 10 “Análise de Mistura de Sementes” destas RAS.
Ao retirar a amostra média da embalagem original, deve-se realizar uma inspeção minuciosa do fundo, das dobras e das suas paredes internas para a retirada dos componentes da amostra que porventura ali ficarem retidos, de forma a refletir a composição real desses componentes nos lotes originais. Preferencialmente, não se deve reutilizar a embalagem original para outras amostras para prevenir possíveis contaminações cruzadas.
É recomendável não utilizar pincéis para o manuseio de amostras e seus componentes, dando prioridade a pinças, espátulas ou batidas leves nos recipientes para movimentá-los. O uso de trinchas (pincéis chatos) deve ficar restrito à limpeza de equipamentos e bancadas, na ausência de amostras em análise e quando não for possível a utilização de jatos de ar. Antes de utilizar trinchas, verificar se estão limpas.
O processo de homogeneização consiste no revolvimento manual ou passagem das sementes pelo menos por duas vezes em um divisor de amostras. A amostra de trabalho poderá ser obtida por divisões consecutivas e por combinação de porções obtidas por divisão.
É muito importante que essa homogeneização e redução sejam realizadas com atenção e cuidado, a fim de garantir que as amostras de trabalho sejam realmente representativas da amostra média e, consequentemente, do lote de sementes em análise.
Os equipamentos e métodos mais adequados a esse propósito encontram-se descritos no subitem 1.5.2. Também é possível utilizar um, dois ou mais desses métodos em uma mesma operação de redução de amostra.
Após a obtenção da amostra de trabalho, o remanescente da amostra média deve ser novamente homogeneizado antes da obtenção de uma outra amostra de trabalho. Essa recomendação não se aplica à divisão da amostra completa de DOSN para obtenção de uma amostra de trabalho para Análise de Pureza e da sua amostra de trabalho complementar para DOSN, para as quais basta a homogeneização inicial.
Para otimizar o processo de obtenção de amostras de trabalho, é recomendável obter, primeiramente, a amostra de trabalho completa para DOSN e, desta, retirar a amostra de trabalho para Análise de Pureza. Nesse caso, as sementes que restarem após a retirada da amostra de trabalho para Análise de Pureza constituirão a amostra de trabalho complementar para DOSN. Para espécies palhentas e com muito material inerte de diferentes tipos e pesos, como amostras de Urochloa spp. e Megathyrsus maximus, deve-se homogeneizar a amostra completa de DOSN antes da retirada da amostra de pureza.
As sementes restantes do processo de homogeneização e de redução das amostras médias farão parte da amostra de arquivo e deverão ser armazenadas em condições adequadas, conforme disposto no subitem 1.6.2.
Independentemente do método utilizado para a obtenção da amostra de trabalho, não se deve tentar obter exatamente o peso mínimo estabelecido no Quadro 1.5 ou Quadro 1.6, mas, sim, uma quantidade de sementes cujo peso seja um pouco maior do que esse mínimo, até um limite de 3% da amostra de trabalho.
Durante o processo de obtenção de amostras de trabalho, não é permitida a interferência pessoal do analista de colocar ou retirar da balança pequenas porções de sementes que não tenham sido obtidas exclusivamente por divisão.
¶ 1.5.2 EQUIPAMENTOS E MÉTODOS DE DIVISÃO E SEU USO
Um dos seguintes métodos deve ser usado na obtenção das amostras de trabalho:
a) MÉTODO MECÂNICO
Esse método é adequado para todas as sementes que deslizem facilmente no equipamento. A amostra passada pelo equipamento é dividida em duas partes aproximadamente iguais e homogêneas.
Para homogeneizar a amostra média, esta deve ser passada, no mínimo, duas vezes pelo divisor e recomposta antes da divisão propriamente dita, que é executada por meio de repetidas passagens das sementes pelo divisor de amostras, removendo-se, em cada passada, uma das porções. O processo de divisões consecutivas é repetido até que se obtenha a amostra de trabalho de peso nunca inferior ao exigido para a espécie e, no máximo, 3% acima do peso prescrito no Quadro 1.5 ou Quadro 1.6. Porções obtidas por divisão podem ser combinadas para se obter o peso necessário. É recomendável alternar o lado dos coletores do divisor de amostras de onde as porções serão removidas ou selecionadas para continuar o processo.
Independentemente do divisor utilizado, os cuidados com a limpeza interna e dos coletores são de fundamental importância antes de cada operação para evitar contaminações entre amostras. Preferencialmente, os equipamentos devem ser limpos com jatos de ar seco. Além disso, o divisor deve estar nivelado para não afetar a uniformidade da divisão das amostras.
Recomenda-se que os divisores sejam verificados, quanto à divisão propriamente dita e quanto à seletividade, antes de serem colocados em uso, sendo que esta checagem deve ser repetida periodicamente.
Os divisores de amostra a seguir descritos são os mais comumente usados:
a.1) Divisor de solo (quarteador)
Esse tipo de divisor de amostra é adequado para qualquer semente que deslize facilmente por seus canais, inclusive algumas espécies de sementes palhentas (por exemplo, dos gêneros Urochloa e Megathyrsus) e de algumas espécies florestais. Esse equipamento não deve ser utilizado com sementes frágeis, tais como Arachis hypogaea.
|
O divisor de solo geralmente é o modelo mais indicado para sementes florestais. Pode ser utilizado quando as sementes deslizam facilmente e não são danificadas durante as passagens neste equipamento. Isso depende da semente (formato, tamanho e da ausência de estruturas salientes) e também da largura dos canais do divisor. Também deve permitir a passagem livre de todos os outros componentes da amostra, inclusive contaminantes, material inerte e sementes dentro de frutos. Um divisor com canaletas de 1,5 cm geralmente é adequado para ser usado, por exemplo, em sementes de Erythrina spp., Euterpe edulis, Azadirachta indica, Mimosa scabrella, Ormosia arborea, Senna macranthera, Schinus terebinthifolia, Copaifera langsdorffii, Aegiphila integrifolia e Dalbergia nigra e similares. Mas, geralmente, não é adequado para sementes de Joannesia princeps e as dos gêneros Hymenaea, Handroanthus e Tabebuia, dentre outras. Nota 10: A lista acima é apenas uma referência. Quando o responsável pela homogeneização observar que a amostra não desliza facilmente nos canais do divisor, mesmo que a amostra seja de uma espécie listada acima, deve optar por realizar a obtenção da amostra de trabalho manualmente. |
O divisor de solo é composto por uma moega com canais em linha direcionados alternadamente para lados opostos. Quanto maior o número de canais, melhor será a divisão. O número mínimo de canais requeridos para o divisor de solo é de 10 canais. Para gramíneas forrageiras e sementes florestais, deve-se utilizar um divisor com no mínimo 16 canais (preferencialmente, 18 canais).
Para sua correta operação, é necessária a utilização de pelo menos quatro coletores iguais e com o mesmo comprimento da moega. Os canais devem ter as mesmas medidas e largura suficiente para permitir o fluxo livre de sementes e contaminantes. Existem modelos apropriados para diversos tamanhos de sementes. É recomendável que os coletores sejam bem ajustados na parte inferior do aparelho e com altura compatível, sem deixar espaços livres ou vãos, de forma a evitar a perda de sementes. Para uso em sementes revestidas, a altura de queda das sementes no divisor não deve ultrapassar 25 cm.
Para iniciar a homogeneização, deve-se garantir que o divisor esteja adequadamente nivelado. As sementes devem ser uniformemente distribuídas na moega ou nos coletores, por toda a sua extensão, preferencialmente, com movimento oscilatório. Elas devem ser vertidas no divisor de solo de tal forma que caiam por gravidade por todos os canais e sejam direcionadas aos coletores posicionados na parte inferior do aparelho. As sementes contidas nesses coletores devem ser vertidas novamente na moega da mesma forma, de maneira simultânea ou alternada.
Para divisão e obtenção das amostras de trabalho, proceder conforme instruções no subitem 1.5.1.
a.2) Divisor cônico (tipo Boerner)
Esse tipo de divisor elimina a interferência do operador e apresenta excelente desempenho para as amostras de sementes com componentes de diferentes naturezas, como, por exemplo, sementes palhentas, especialmente aquelas com contaminantes pesados (como torrões e pedras) e com pesos de amostras de análise de pureza reduzidos.
É um divisor de amostra robusto que pode também ser usado para grandes volumes de sementes, porque o tamanho máximo da amostra não é definido pelo divisor, mas apenas pelo tamanho da moega e dos coletores. Por outro lado, apresenta como desvantagem a dificuldade de limpeza interna, que pode ser facilitada com o uso de jatos de ar.
Esse divisor é composto por uma moega cônica ou alimentador, por um cone invertido e por uma série de lâminas separadoras que formam pequenos canais e espaços iguais na largura e comprimento. As sementes são alternadamente conduzidas, durante sua queda, para duas bicas opostas situadas na base do aparelho. Uma válvula na base da moega retém as sementes. As sementes devem ser vertidas na moega com a válvula fechada. Quando essa válvula é aberta, as sementes caem por gravidade sobre o cone invertido, sendo uniformemente distribuídas para os canais que levam para uma das duas bicas e para espaços que levam para a outra bica, de onde são conduzidas para os coletores.
Divisores cônicos típicos tem 15 canais e 15 espaços, que, portanto, equivalem a 30 canais de um divisor de solo. Divisores cônicos maiores têm 19 canais e 19 espaços, equivalentes a 38 canais de um divisor de solo. Quanto maior o número de canais e espaços, mais precisa será a divisão das sementes. Nesse tipo de divisor, os canais e espaços devem ter as mesmas medidas e largura suficiente para permitir o fluxo livre de sementes e contaminantes. A válvula da base da moega deve se mover facilmente, mas não permitir que as sementes passem pelos seus bordos quando fechada. Não deve haver orifício e bordas ásperas nas superfícies sobre as quais as sementes deslizam para evitar a retenção de sementes, partículas e a contaminação de outras amostras.
|
Observação: Pode ser utilizado para sementes florestais desde que os componentes da amostra deslizem facilmente pelas canaletas deste divisor. |
a.3) Divisor centrífugo (tipo Gamet)
Esse tipo de divisor de amostra pode ser usado para espécies com sementes que não apresentem apêndices ou impurezas que possam prejudicar o fluxo de sementes.
No entanto, o divisor tipo Gamet não deve ser usado para:
a) sementes revestidas;
b) sementes frágeis, como, por exemplo, Arachis hypogaea;
c) sementes de Brassica spp., de linho (Linum usitatissimum) e de outras espécies para as quais são requeridas amostras de trabalho de peso reduzido;
d) misturas de sementes,
e) certas gramíneas forrageiras palhentas, como aquelas dos gêneros Urochloa, Lolium, Megathyrsus e Paspalum;
f) sementes de Glycine max, Phaseolus vulgaris e Pisum sativum com baixa umidade (para minimizar o risco de danos mecânicos).
|
O Divisor centrífugo não é aconselhável para espécies florestais com sementes recalcitrantes, sementes aladas/com estruturas salientes ou sementes frágeis que podem ser danificadas pelo equipamento, como as de: Tabebuia, Cedrela, Handroanthus, Kielmeyera, Luhea, Lafoensia, Swietenia, Jacaranda, Peltophorum, Aspidosperma, Vochysia, Machaerium e Myroxylon. |
Esse tipo de divisor emprega a força centrífuga para misturar e espalhar as sementes sobre a superfície divisora. Nesse aparelho, as sementes caem da moega para um receptáculo de borracha em forma de taça, o qual, girando a certa velocidade por meio de um motor elétrico, joga as sementes para um compartimento cilíndrico fechado, dividido em dois setores iguais, cada um dos quais ligado a uma bica, sendo a amostra dividida em duas porções aproximadamente iguais. Convém alertar que as sementes sempre devem ser vertidas com o equipamento desligado.
Esse equipamento deve ter necessariamente uma moega removível, pés ajustáveis e nível de bolha. Os recipientes coletores devem ser preferencialmente de metal ou de outro material que não apresente efeito eletrostático e ter altura compatível com a da bica de saída, de forma a evitar a perda de sementes.
A limpeza do equipamento deve ser realizada com a retirada da moega e utilização de jatos de ar. A limpeza dos coletores deve ser verificada para evitar qualquer tipo de contaminação cruzada. Também deve ser verificado se o divisor está nivelado e com os coletores bem-posicionados.
Homogeneizar e obter a amostra de trabalho conforme instruções no subitem 1.5.1.
a.4) Divisor rotatório
Nesse tipo de divisor, a homogeneização e a divisão das amostras são realizadas simultaneamente. Ele é mais adequado para espécies com sementes pequenas, amostras com peso reduzido e para a maioria das espécies de sementes palhentas de gramíneas, flores ou olerícolas. Também pode ser utilizado para misturas contendo sementes palhentas e não palhentas. Apenas sementes muito palhentas (por exemplo, Andropogon gayanus) não podem ser divididas neste tipo de divisor de amostras, pois elas podem ficar retidas na moega.
O divisor rotatório é composto por uma coroa ou unidade-base giratória, geralmente, com 6 a 32 frascos acoplados de subamostras, uma calha vibratória e um funil. Na utilização desse tipo de divisor de amostras, as sementes são colocadas na moega e o equipamento ligado para que a unidade-base com os frascos coletores acoplados girem em alta velocidade e a calha vibratória comece a despejar as sementes no cilindro de entrada da unidade-base. Quanto maior for a duração da operação de divisão, melhor será a precisão do processo. A taxa de alimentação e a duração da divisão podem ser ajustadas alterando-se a distância entre o funil da moega e a calha, além da intensidade da sua vibração.
Em uma mesma operação, o divisor rotatório pode produzir subamostras entre um sexto e um 32 avos da amostra total, dependendo do tipo de coroa/base utilizada. A amostra de trabalho pode ser considerada como o conteúdo de um ou mais recipientes, de modo que uma faixa considerável de proporções de divisão pode ser alcançada pelo divisor rotatório.
b) MÉTODO MANUAL
É o método usado sempre que não for possível utilizar um dos métodos anteriores em razão das características da espécie em análise.
|
Também pode ser utilizado para todas as espécies florestais, sendo o método mais indicado para sementes florestais que não deslizem facilmente nos divisores, as sensíveis a danos mecânicos ou sementes e/ou frutos alados. Exemplos: sementes das espécies Cybistax antisyphilitica, Gallesia integrifolia, Jacaranda micranta, Myrocarpus frondosus e Paratecoma peroba; e dos gêneros Aspidosperma, Balfourodendron, Cedrela, Centrolobium, Handroanthus, Khaya, Lafoensia, Swietenia, Tabebuia, Vochysia, Zeyheria. |
A redução da amostra média deve ser feita manualmente, obedecendo ao mesmo princípio das divisões consecutivas em que se baseiam os divisores de amostra, conforme os métodos a seguir:
b.1) Método das divisões sucessivas
Esse é o método adequado para sementes de alta pureza ou muito pequenas como fumo (Nicotiana tabacum) ou muito grandes como feijão-de-porco (Canavalia ensiformis). Na ausência de divisores mecânicos de tamanho adequado para sementes pequenas, também pode ser usado para espécies de olerícolas, condimentares, medicinais e ornamentais com essa característica. Pode ser empregado, ainda, na divisão de sementes frágeis e facilmente danificáveis tais como espécies dos gêneros Arachis, Glycine e Phaseolus.
|
É o método mais adequado para sementes florestais grandes, como as de Joannesia princeps e de Hymenaea spp. Também é adequado para sementes florestais com estruturas salientes, como alas e sementes frágeis, como as sementes de Handroanthus, Khaya, Tabebuia e Zeyheria, desde que a amostra não possua componentes com pesos e tamanhos muito desuniformes. |
Para poáceas palhentas que usualmente têm muito material inerte (ex.: Andropogon, Hyparrhenia, Cenchrus, Chloris e Melinis), bem como para outras espécies com características semelhantes, deve-se usar o método das divisões constantes descrito no subitem b.2.
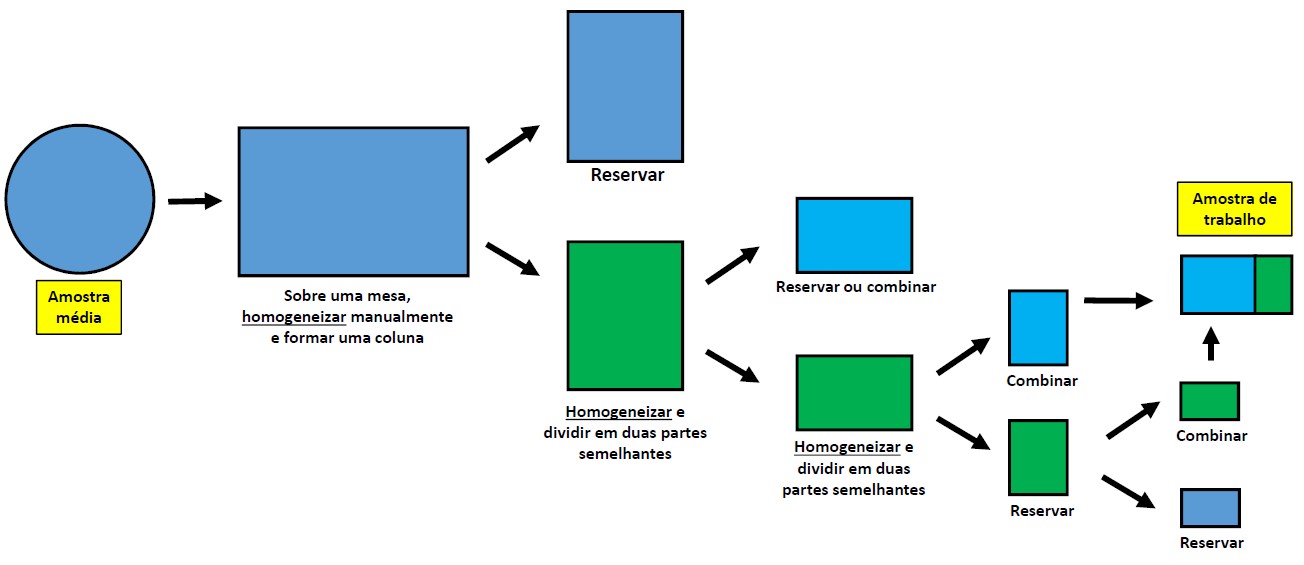
A amostra média deverá ser colocada sobre uma superfície limpa e lisa, manualmente homogeneizada, amontoada e dividida ao meio com o auxílio de uma régua ou objeto semelhante. Reservando-se uma das metades, repete-se a homogeneização e a divisão com a outra metade, até que seja obtida uma amostra de trabalho com peso até 3% superior ao mínimo prescrito para a espécie (ver subitem 1.5.1 e Figura 1.4).
Ao separar as duas porções resultantes de cada divisão, é imprescindível que todo o material presente, inclusive o constituído de pequenas partículas como terra e pedras, que normalmente se acumulam na parte inferior da amostra, também seja dividido e incluído em cada metade.
b.2) Método das divisões constantes
| É um método adequado para sementes florestais palhentas, com estruturas salientes ou sementes frágeis, como as sementes de Handroanthus, Khaya, Tabebuia e Zeyheria, especialmente se amostra possuir componentes com pesos e tamanhos muito desuniformes. |
O método das divisões constantes também pode ser usado com as espécies nas quais todos os outros métodos de divisão forem de uso extremamente difícil ou quase impossível. Esse método é recomendado para as sementes palhentas com apêndices, espinhos ou alas, a exemplo das sementes dos gêneros Andropogon, Hyparrhenia, Cenchrus, Chloris e Melinis, exceto se essas estruturas tiverem sido removidas durante o beneficiamento. Pode ser utilizado, também, para os gêneros de sementes frágeis e facilmente danificáveis, como Arachis, Glycine e Phaseolus. Para sementes esféricas, o método das divisões constantes modificado é mais indicado.
No caso de obtenção de amostras de trabalho para testes de sanidade de sementes, esse método pode ser utilizado para todas as espécies.
A amostra média deve ser colocada sobre uma superfície limpa e lisa e, em seguida, homogeneizada com as mãos ou com o auxílio de uma espátula, formando um amontoado, que será dividido ao meio. Cada metade é novamente dividida, resultando em quatro porções aproximadamente iguais. Cada uma dessas porções é dividida novamente, resultando em oito porções, as quais devem ser dispostas em duas fileiras de quatro. Deve-se combinar e reter as porções alternadamente, desprezando-se as porções restantes. Homogeneizar novamente a porção retida, repetindo o procedimento tantas vezes quantas forem necessárias até que seja obtida a amostra de trabalho com peso até 3% superior ao mínimo prescrito para a espécie (ver subitem 1.5.1 e Figura 1.5).
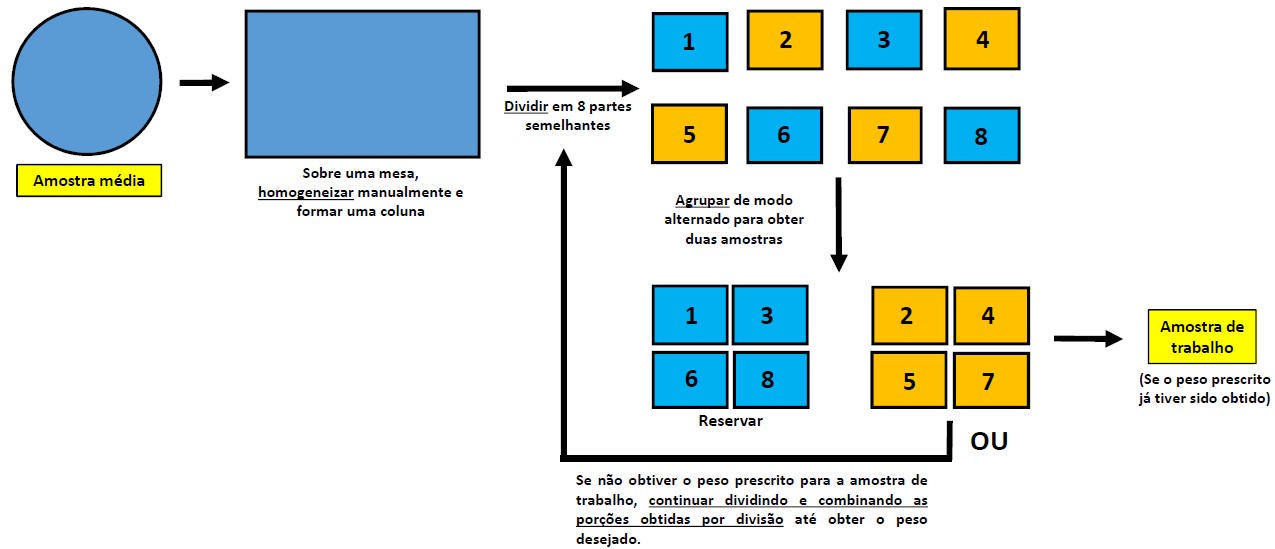
b.3) Método das divisões constantes modificado
Para redução de amostras com grandes volumes de sementes ou amostras de sementes esféricas, como as de Glycine max, é possível usar um artifício para facilitar a obtenção da amostra de trabalho com o uso de uma caixa ou engradado dividido em, no mínimo, oito células cúbicas de tamanhos idênticos, sendo metade das células alternadamente fechada na sua base e a outra metade aberta, conforme exemplo da Figura 1.6.a. Após uma homogeneização manual preliminar, as sementes são distribuídas uniformemente na caixa ou engradado, conforme exemplo da Figura. 1.6.b.
Quando caixa for levantada, aproximadamente a metade da amostra permanecerá na caixa e a outra metade cairá na bandeja. Desta forma, a amostra será sucessivamente dividida ao meio até se obter o tamanho prescrito para a amostra de trabalho.

b.4) Método da colher
Esse método é recomendado para redução de amostras de sementes para o teste de sanidade. Para outras análises que não as sanitárias, é restrito às espécies de sementes menores do que as de trigo, aos gêneros Arachis, Glycine e Phaseolus.
Também pode ser utilizado para auxiliar a obtenção das amostras para a determinação do Peso de Mil Sementes - PMS de sementes revestidas.
| É um dos métodos mais indicados para as espécies florestais dos gêneros Abies, Cedrus e Pseudotsuga e outros com sementes similares. |
Para utilizar este método são necessários: uma bandeja de fundo plano e regular, uma espátula e uma colher com borda reta. Após uma homogeneização preliminar, despejar as sementes uniformemente sobre a bandeja tomando-se cuidado para não as agitar a partir desse momento. Com uma das mãos, manter a colher inclinada em um ângulo de 45°. Com a outra mão, segurar a espátula em um ponto fixo da amostra movendo a colher até a borda da espátula levantando-as simultaneamente para transferir pequenas porções. Repetir o procedimento, no mínimo, em cinco pontos diferentes da amostra média para compor a amostra de trabalho, conforme o subitem 1.5.1.
¶ 1.6 ARMAZENAMENTO DAS AMOSTRAS
¶ 1.6.1 ANTES DA ANÁLISE
O laboratório deve se esforçar ao máximo para iniciar a análise da amostra no dia do seu recebimento ou reduzir ao mínimo o intervalo entre a amostragem e a análise. Se for necessário guardar a amostra média durante algum tempo antes da análise, esta deve ser armazenada em local, preferencialmente climatizado, de tal maneira que as alterações na qualidade das sementes sejam as menores possíveis.
As análises de sementes não ortodoxas (recalcitrantes ou intermediárias) devem ser priorizadas, sendo as análises de sementes recalcitrantes preferencialmente iniciadas no mesmo dia do recebimento. Após a obtenção da amostra média, as análises devem ser realizadas o mais rapidamente possível, eliminando-se ou reduzindo-se o tempo de armazenamento. O manuseio da amostra média e o seu armazenamento, se necessário, devem ser feitos sob condições específicas consideradas como ótimas para a espécie. Durante o manuseio das amostras média e de trabalho de sementes não-ortodoxas, deve ser evitada a perda de umidade das sementes, pois isso pode resultar em mudanças da qualidade fisiológica destas.
¶ 1.6.2 DEPOIS DA ANÁLISE
Uma vez retiradas todas as amostras de trabalho necessárias para as diversas análises, as sementes restantes da amostra média devem ser colocadas em embalagens apropriadas para constituir a amostra de arquivo. Esta e todas as sobras de sementes, além dos componentes resultantes da Análise de Pureza (sementes puras, outras sementes, material inerte, sementes não pelotizadas e sementes da verificação da espécie em sementes revestidas) ou de qualquer outra determinação, deverão ser armazenadas de forma individualizada por um período equivalente ao da validade do Teste de Germinação ou de Tetrazólio. Esses constituintes da amostra de arquivo, incluindo as sementes puras, podem ser armazenados juntos em uma mesma embalagem maior, desde que individualizados e identificados em embalagens menores.
As amostras devem ser armazenadas em locais adequados, de acordo com a espécie, com controle de temperatura e da umidade relativa do ar. Para a maioria das espécies, temperaturas inferiores a 20 °C e umidade relativa do ar inferior a 60% são as mais adequadas para o armazenamento das sementes por pelo menos um ano ou pelo período equivalente ao da validade do Teste de Germinação ou de Tetrazólio. As condições de armazenamento deverão ser claramente definidas no sistema de gestão de qualidade do laboratório. Os laboratórios devem manter registros da temperatura e umidade relativa do local de armazenamento, adequadas ao escopo de espécies. O uso de temperaturas abaixo de 15 °C e/ou tratamentos com inseticidas e contra roedores podem ser necessários para o armazenamento seguro das amostras
O laboratório não pode, entretanto, ser responsabilizado pelo declínio da germinação durante o armazenamento das amostras de arquivo.
Para amostras de lotes pequenos ou de alto valor (ver subitens 1.2.6 e 1.2.7), se solicitado pelo requerente, o restante da amostra média pode ser devolvido depois da conclusão de todas as análises, exceto quando se tratar de amostra fiscal com resultados fora do padrão ou da garantia declarada na embalagem. Quando a devolução for permitida, o laboratório deve reservar no mínimo 25 sementes para comprovar a identidade da amostra, mas não terá condições de repetir qualquer teste já solicitado.
¶ 1.7 TESTE DE HETEROGENEIDADE PARA LOTES DE SEMENTES ACONDICIONADAS EM EMBALAGENS (Valor H e Valor R)
¶ 1.8 BIBLIOGRAFIA CONSULTADA
BRASIL. Lei nº 10.711, de 5 de agosto de 2003 (dispõe sobre o Sistema Nacional de Sementes e Mudas). Diário Oficial da União: Brasília, DF, de 6 de agosto de 2003. Seção 1, p.1-4.
BRASIL. Instrução Normativa nº 30, de 21 de maio de 2008 (estabelece normas e padrões para produção e comercialização de sementes de espécies forrageiras de clima tropical). Diário Oficial da União: Brasília, DF, de 23 de maio de 2008. Seção 1, p.45-48.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Amostragem. In: Regras para Análise de Sementes. Brasília, DF: Secretaria de Defesa Agropecuária, 2009. Cap.1, p.22-89.
BRASIL. Instrução Normativa nº 40, de 30 de novembro de 2010 (aprova os modelos e instruções de preenchimento de Boletins de Análise de Sementes para fins de identificação e certificação). Diário Oficial da União: Brasília, DF, de 1º de dezembro de 2010. Seção 1, p.4-7.
BRASIL. Instrução Normativa nº 30, de 09 de junho de 2011 (altera o peso mínimo das amostras de trabalho para análise de pureza e determinação de outras sementes por número de espécies forrageiras de clima tropical). Diário Oficial da União: Brasília, DF, de 10 de junho de 2011. Seção 1, p. 9.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instruções para análises de sementes de espécies florestais. Brasília, DF, 2013. 97p.
BRASIL. Instrução Normativa nº 41, de 11 de setembro de 2013 (insere ou altera informações para algumas espécies no Quadro 1.2 das Regras para Análise de Sementes constantes do Anexo I da Instrução Normativa nº 40, de 30 de setembro de 2009). Diário Oficial da União: Brasília, DF, de 20 de setembro de 2013. Seção 1, p.6-27.
BRASIL. Instrução Normativa nº 45, de 17 de setembro de 2013 (estabelece padrões de identidade e qualidade para produção e comercialização de sementes de diversas culturas). Diário Oficial da União: Brasília, DF, de 20 de setembro de 2013. Seção 1, p.6-27.
BRASIL. Instrução Normativa nº 44, de 22 de novembro de 2016 (estabelece padrões de identidade e qualidade de sementes de espécies forrageiras de clima temperado). Diário Oficial da União: Brasília, DF, de 1º de dezembro de 2016. Seção 1, p.8-11.
BRASIL. Instrução Normativa nº 42, de 17 de setembro de 2019 (estabelece normas para a produção de sementes e mudas de espécies olerícolas, condimentares, medicinais e aromáticas e seus padrões de sementes). Diário Oficial da União: Brasília, DF, de 19 de setembro de 2019. Seção 1, p.4-9.
BRASIL. Portaria nº 538, de 20 de dezembro de 2022 (estabelece as normas para a produção, a certificação, a responsabilidade técnica, o beneficiamento, a reembalagem, o armazenamento, a amostragem, a análise, a comercialização e a utilização de sementes.). Diário Oficial da União: Brasília, DF, de 21 de dezembro de 2022. Seção 1- p. 14-20.
HALL, G. et al. ISTA handbook on seed sampling. 3rd edition. Switzerland: International Seed Testing Association (ISTA), 2022, p. 115.
ISTA - INTERNATIONAL SEED TESTING ASSOCIATION. International rules for seed testing. ed. 2025. Wallisellen, Switzerland, 2025. Chapter 2: Sampling, p.2.1-2.48.
ISTA - INTERNATIONAL SEED TESTING ASSOCIATION. List of stabilized plant names. 7.ed. Bassersdorf: Nomenclature Committee, 2021. 73p. Disponível em: https://www.seedtest.org/en/services-header/tools/nomenclature-committee.html. Acesso em: 30 Ago 2024.
REFLORA. Flora e Funga do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: < http://floradobrasil.jbrj.gov.br/ >. Acesso em: 30 Ago 2024
USDA. GRIN-Global U.S. National Plant Germplasm System. Acesso em 21/06/2024. https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomysearch
¶ 1.9 HISTÓRICO DE REVISÕES
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
|
1 |
- |
28/03/2025 |
Criação do documento. |
|
1.1 |
Quadro 1.5 rev. 1.2 |
01/07/2025 |
Criação da rev. 1.3 do Quadro 1.5, com correções marcadas em amarelo nas seguintes espécies: Arctium lappa; Brassica campestris; Carica papaya; Fragaria vesca; Luffa acutangula; Luffa aegyptiaca; Lychnis chalcedonica; Lychnis coronaria; Lychnis viscaria; Satureja montana; Silene chalcedonica; Silene coronaria; Solanum (sect. Lycopersicon) spp.; Solanum (sect. Lycopersicon) hybrids; Solanum lycopersicum; Vigna unguiculata subsp. sesquipedalis Group; Vitis vulpina. |
¶ ANEXOS
Tabela 1.1: Indicação de número aproximado de sementes na amostra média, Análise de Pureza e Testes de Germinação de Espécies Florestais.
Item 1.7: Teste de heterogeneidade para sementes acondicionadas em embalagens (Teste do Valor H e Teste do Valor R).
Quadro 1.5 rev. 1.3: Indica, por espécie botânica, o tamanho máximo do lote, o uso da espécie, o peso mínimo da amostra média e das amostras de trabalho para Análise de Pureza e para a Determinação de Outras Sementes por Número, bem como o número de sementes por grama para sementes de espécies não florestais.
Quadro 1.6: Indica, por espécie botânica, a origem da espécie, o tamanho máximo do lote, o peso mínimo da amostra média e da amostra de trabalho para Análise de Pureza, bem como o número de sementes por quilograma para sementes de espécies florestais.