¶ Folha de rosto
©2025 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária - MAPA
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Coordenação-Geral de Laboratórios Agropecuários - CGAL
Esplanada dos Ministérios, Bloco D, Anexo A, 3º andar, sala 315
CEP: 70.043-900, Brasília - DF
Tel.: (61) 3218-3269
Sítio eletrônico: https://wikisda.agricultura.gov.br
e-mail (dúvidas e sugestões): ras@agro.gov.br
Central de Relacionamento: 0800-704-1995
Coordenação dos trabalhos técnicos: Júlio César Garcia - (LASO/LFDA-MG)
Equipe Técnica:
| Alessandra de Oliveira Pulcineli - (LASO/LFDA-GO) | Maria Izabel Furst Gonçalves - (LASO/LFDA-MG) |
| Érica Cardoso Vilela Barbara - (LASO/LFDA-GO) | Maria Paula Domene - (LASO/CATI) |
| Ernesto do Nascimento Viegas - (CGAL/DTEC) | Matheus Emanuel de Queiroz - (LASO/LFDA-MG) |
| Fábio Lopes da Cruz - (LASO/LFDA-MG) | Melissa Yurie Toguchi - (LASO/LFDA-GO) |
| Fabrício Pedrotti - (CGAL/DTEC) | Nilson C. Castanheira Guimarães - (CGAL/DTEC) |
| Henrique Martins Sant’Anna - (LASO/LFDA-RS) | Patrícia Branco Piano - (LASO/LFDA-RS) |
| Henrique Sérgio Lima - (LASO/LFDA-PE) | Patrícia Ribeiro Cursi - (LASO/CATI) |
| Hiromi S. Y. Sassagawa Sant’Anna - (LASO/LFDA-RS) | Sylvia T. B. de Oliveira Sabino - (LASO/LFDA-PE) |
| Luiz Artur Costa do Valle - (LASO/LFDA-MG) | Vitor Breda Bezerra Rego - (LASO/LFDA-RS) |
| Magda Birck Garcia - (LASO/LFDA-RS) |
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Definir os métodos oficiais a serem utilizados nas análises para identificação e verificação da qualidade de lotes de sementes a serem comercializados no mercado interno. |
|||
|
Processo: Análises de sementes |
||||
|
Entrega: Garantia da identidade e qualidade de lotes de sementes |
Público alvo e demais interessados: Laboratórios de análise de sementes credenciados no Renasem |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação-Geral de Laboratórios Agropecuários – CGAL, vinculada ao Departamento de Serviços Técnicos - DTEC da Secretaria de Defesa Agropecuária – SDA, do Ministério da Agricultura e Pecuária – MAPA é o órgão responsável pela Rede Nacional de Laboratórios Agropecuários do Sistema Unificado de Atenção à Sanidade Agropecuária e possui dentre suas atribuições estabelecer, uniformizar e oficializar métodos para a realização de análises. |
||||
¶ 2.0 ESCOPO
Este capítulo trata da metodologia para a realização da Análise de Pureza para todas as espécies não florestais e florestais.
Há dois quadros com as Definições de Semente Pura: Quadro 2.3 para espécies florestais e Quadro 2.2 para as demais espécies.
As instruções para Análise de Pureza de sementes revestidas constam no subitem 8.4 do Capitulo 8 “Análise de Sementes revestidas”.
Instruções para amostras de mistura de sementes estão no subitem 10.4 do Capítulo 10 “Análise de Mistura de Sementes”.
¶ 2.1 OBJETIVO
Determinar a composição percentual por peso, a identidade das diferentes espécies de sementes e do material inerte da amostra e, por inferência, a do lote de sementes.
¶ 2.2 PRINCÍPIOS GERAIS
Nessa análise, a amostra de trabalho é separada em três componentes: “Semente Pura”, “Outras Sementes” e “Material Inerte”, que são indicados em porcentagem por peso da amostra de trabalho.
Quando a Determinação de Outras Sementes por Número - DOSN for realizada em peso complementar, as outras sementes encontradas na Análise de Pureza devem ser identificadas e incluídas nessa determinação.
Cada tipo de material inerte presente deve ser identificado tanto quanto possível e, quando solicitado pelo requerente, sua porcentagem em peso pode ser determinada.
¶ 2.3 EQUIPAMENTOS
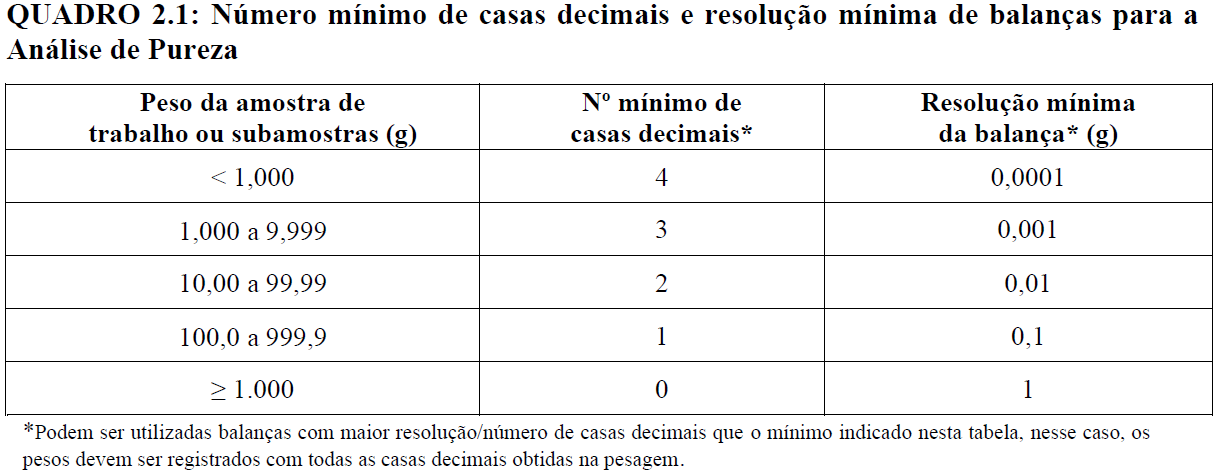
O laboratório deve dispor de lupas de mesa (com aumento mínimo de 4x) e balanças com resoluções (número de casas decimais) compatíveis com o seu escopo de análise, conforme as especificações definidas no Quadro 2.1.
O microscópio estereoscópico ótico ou digital, com aumento de no mínimo 20x, é obrigatório para todos os laboratórios de sementes, pois é necessário para a correta identificação de sementes, separação de sementes pequenas e/ou unidades de dispersão, fragmentos diversos e para a revisão do material inerte. Convém utilizar o estereomicroscópio para conferência da natureza do material inerte, antes das pesagens dos componentes da amostra.
Outros equipamentos podem ser obrigatórios dependendo do escopo do laboratório, a exemplo de lupas de mesa de diversos aumentos com iluminação própria, equipamentos de luz transmitida e luz refletida de boa qualidade ótica e sopradores de sementes.
O uso da luz transmitida (microscópio estereoscópico ou diafanoscópio) é indispensável para determinadas espécies de Poaceae, por exemplo, Lolium spp., bem como para detectar galhas de nematoides e frutificações de fungos.
Alguns acessórios geralmente são essenciais tais como, peneiras de laboratório, pinças, espátulas e placas de petri. É recomendável utilizar um conjunto de peneiras de laboratório na Análise de Pureza, principalmente, quando houver evidências da ocorrência de muito material inerte na amostra, para facilitar a separação de outras sementes, palhas, torrões, pedras e outras pequenas partículas. Seu uso também é indicado antes da utilização do soprador de sementes. “Mesinhas de pureza” são recomendadas, especialmente, na análise de sementes esféricas que rolam com facilidade como as de soja (Glycine max).
Os sopradores de sementes podem ser usados para algumas espécies de Poaceae como ferramenta auxiliar na execução da Análise de Pureza para separar o material leve, como palhas e antécios vazios, das sementes pesadas (subitem 2.5.3.1).
Nota 1: o número de equipamentos deve ser compatível com a capacidade operacional e a equipe técnica do laboratório.
¶ 2.4 DEFINIÇÕES
¶ 2.4.1 SEMENTE PURA
São consideradas puras todas as sementes e/ou unidades de dispersão pertencentes à espécie em exame declarada pelo requerente ou como sendo a espécie predominante na amostra, incluindo todas as variedades botânicas e cultivares dessa espécie, conforme as definições de semente pura que constam nos quadros das “Definições de Sementes Puras (DSP)” mencionados no subitem 2.8.
Além das sementes inteiras, maduras e não danificadas das espécies, também devem ser classificadas como sementes puras aquelas que se encontrarem nas seguintes condições:
1. As seguintes estruturas (mesmo imaturas, com tamanho menor, enrugadas, infectadas ou germinadas, desde que possam ser confiavelmente identificadas como da espécie em análise), exceto aquelas que transformadas em esclerócio fúngico visível (ergot ou outros fungos), estruturas típicas de carvão ou galhas de nematoides:
A. Unidades de dispersão intactas (aquênios, esquizocarpos, mericarpos, outros frutos e sementes) como definido para cada gênero ou espécie na respectiva Definição de Semente Pura (subitem 2.8).
Nas sementes da família Poaceae:
a) Antécio fértil (lema e pálea) envolvendo uma cariopse com endosperma.
b) Cariopses.
B. Pedaços de unidades de dispersão maiores do que a metade de seu tamanho original. Quando não houver padronização de tamanho das sementes, tomar uma semente inteira com tamanho e aspecto semelhantes ao fragmento de semente para utilizar como referência.
2. Dos princípios gerais acima, são feitas exceções para alguns gêneros ou espécies apresentadas no subitem 2.8, nos Quadros 2.2 e 2.3.
A. Sementes das famílias Berberidaceae, Brassicaceae, Cupressaceae, Fabaceae, Pinaceae, Taxaceae e Taxodiaceae com tegumento completamente removido são consideradas material inerte.
Na família Fabaceae, cotilédones separados são considerados material inerte, independentemente se o eixo hipocótilo-radícula + plúmula e/ou mais da metade de seu tegumento estiver aderido.
B. Em certos gêneros da família Poaceae:
a) A cariopse deve ter um tamanho mínimo (subitem 2.5.3.b.1).
b) Nem sempre é obrigatória a presença de cariopses em espiguetas e antécios férteis (consultar a definição de semente pura da espécie em questão no subitem 2.8).
c) A separação entre sementes puras e material inerte pode ser feita por métodos de ventilação uniforme (subitem 2.5.3.2), por exemplo, Poa pratensis, Poa trivialis e Dactylis glomerata.
d) As unidades-sementes múltiplas (USMs) são deixadas intactas na fração “Semente Pura” (DSP nº 33 do Quadro 2.2.).
e) Os antécios estéreis que estejam ligados a antécios férteis não são removidos (subitem 2.5.3.b.3).
f) Em certos gêneros, os apêndices que permanecem aderidos às sementes não são removidos, e, quando solicitado pelo requerente, os apêndices mais longos que o comprimento das sementes (ver subitem 2.5.3.e), podem ser informados de acordo com o subitem 2.7.
¶ 2.4.2 OUTRAS SEMENTES
Em outras sementes, devem ser incluídas as unidades de dispersão de qualquer outra espécie de planta que não tenham sido classificadas como semente pura.
Com respeito à classificação como outras sementes ou material inerte, as características distinguíveis descritas na “Definição de Semente Pura” (item 2.8) e definições gerais do subitem 2.4.1.1 também devem ser aplicadas, exceto quando a semente estiver vazia, quando será classificada como material inerte.
Como exemplo desse tipo de exceção, embora a definição de pureza do Andropogon spp. não exija a presença de cariopse para a semente ser considerada pura, quando sementes deste gênero forem encontradas como contaminantes, só devem ser consideradas como “Outras sementes” se for constada a presença de cariopse. Se a semente de Andropogon sp. estiver vazia, classificar como “Material Inerte”. O mesmo critério deve ser usado quando uma semente de girassol (Helianthus annuus) for encontrada como contaminante.
Unidades-sementes múltiplas (USMs) devem ser separadas e cada unidade individual classificada se esta esta instrução constar na respectiva Definição de Semente Pura (subitem 2.8).
Nota 2: Unidades-sementes múltiplas como os esquizocarpos das espécies de Malva, Malvastrum, Pavonia, Richardia, Sida, Sidastrum, Spermacoce; o solanídio de Solanum; o receptáculo cônico de Anthemis cotula; as cápsulas de Oxalis spp., Ludwigia spp. e Silene gallica e os legumes, como de Aeschynomene, Chamaecrista, Crotalaria, Desmodium, Mimosa e Senna devem ser separados ou abertos e as sementes removidas. O material que não for semente deve ser classificado como material inerte, exceto para algumas espécies ou gênero conforme indicado nas Definições de Semente Pura (subitem 2.8).
A. Sementes de Cuscuta spp. frágeis e com coloração cinzenta a creme-esbranquiçada são classificadas como material inerte.
B. Sementes de Plantago lanceolata enrugadas e de coloração preta sem nenhuma porção de coloração marrom são classificadas como material inerte.
C. Unidades de dispersão de Ambrosia spp. com invólucro gamofilo e pericarpo ausente são classificadas como material inerte.
Nota 3: Para espécies e gêneros sem informações nas Definições de Semente Pura (subitem 2.8), devem ser usadas as definições gerais do subitem 2.4.1.1.
¶ 2.4.3 MATERIAL INERTE
O material inerte deve incluir unidades de dispersão e todos os outros materiais e estruturas não definidas como semente pura ou outras sementes, como se segue:
A. Unidades de dispersão nas quais for óbvio que não contenham a semente.
B. Antécios das espécies listadas no subitem 2.5.3.b.1 com a cariopse menor do que o tamanho mínimo prescrito. Antécios estéreis ligados a um antécio fértil devem ser removidos, exceto em alguns gêneros listados no subitem 2.5.3.b.3.
C. Pedaços de unidades de dispersão quebrados ou danificados iguais ou menores do que a metade de seu tamanho original.
D. Apêndices não classificados como parte das sementes puras nas Definições de Semente Pura da espécie (subitem 2.8) devem ser removidos e incluídos no material inerte.
E. Sementes de Berberidaceae, Brassicaceae, Cupressaceae, Fabaceae, Pinaceae, Taxaceae e Taxodiaceae com tegumento inteiramente removido.
Na família Fabaceae, cotilédones separados são considerados material inerte, independentemente se o eixo hipocótilo-radícula + plúmula e/ou se mais da metade de seu tegumento estiver aderido.
F. Sementes de Cuscuta spp., frágeis e de coloração cinzenta a creme-esbranquiçada, são classificadas como material inerte.
G. Sementes de Plantago lanceolata enrugadas e de coloração preta sem nenhuma porção de coloração marrom são classificadas como material inerte.
H. Unidades de dispersão de Ambrosia spp. com invólucro gamofilo e pericarpo ausente, são classificadas como material inerte.
I. Antécios estéreis não aderidos, glumas vazias, lemas, páleas, palhas, colmos, folhas, escamas de cones, alas, cascas, flores, pedaços de tegumento ou pericarpo; galhas de nematoides, insetos e larvas, frutificações de fungos como ergot, esclerócios e estruturas típicas de carvão; terra, areia e pedras; e qualquer outro material que não seja semente.
J. Todos os materiais da “fração leve”, quando a separação for feita pelo Método da Ventilação Uniforme (subitem 2.5.3.2), exceto outras sementes (subitem 2.4.2).
K. Na “fração pesada”, quando a separação for feita pelo Método da Ventilação Uniforme (2.5.3.2), antécios quebrados e cariopses iguais ou menores do que a metade de seu tamanho original e qualquer outro material que não seja semente pura (subitem 2.4.1) ou outras sementes (subitem 2.4.2).
¶ 2.5 PROCEDIMENTO
¶ 2.5.1 AMOSTRA DE TRABALHO
A amostra de trabalho deve ser obtida por homogeneização e divisão da amostra média de acordo com o subitem 1.5 do Capítulo 1 “Amostragem”.
¶ 2.5.2 PESO MÍNIMO DA AMOSTRA DE TRABALHO
a) Espécies relacionadas no Quadro 1.5 ou Quadro 1.6 ou normas específicas:
Os pesos mínimos das amostras de trabalho para as diferentes espécies de sementes encontram-se nos Quadros 1.5 e 1.6, os quais podem ser maiores até um limite de 3% do peso prescrito.
A amostra de trabalho deve ser pesada com o número de casas decimais/resolução da balança igual ou maior definido no subitem 2.5.2.e.
A Análise de Pureza também pode ser realizada em duas subamostras representativas com a metade do peso da amostra de trabalho, conforme indicado no Anexo 2.1.
b) Espécies não relacionadas no Quadro 1.5 ou Quadro 1.6 ou normas específicas:
Nesses casos, o Peso de Mil Sementes - PMS deve ser determinado e utilizado como referência para o cálculo do peso das amostras de trabalho para a Análise de Pureza. Essa amostra deverá conter, no mínimo, 2.500 sementes, limitada a 1.000 g e nunca inferior a 0,1 g.
No caso de sementes muito grandes (com PMS maior do que 1.000 g), a amostra de trabalho para Análise de Pureza deve ter no mínimo 1.000 sementes, limitada até 2.000 g. Para sementes florestais com PMS maior do que 5.000 g, a amostra de trabalho de pureza deve ter no mínimo 200 sementes.
c) Mistura de sementes:
A determinação do peso mínimo de amostras de trabalho de misturas de sementes deve ser realizada conforme instruções específicas contidas no Capítulo 10 “Análise de Mistura de Sementes” destas Regras para Análise de Sementes - RAS.
d) Sementes revestidas:
A determinação do peso mínimo de amostras de trabalho de sementes revestidas deve considerar o número de pelotas/sementes e o Peso de Mil Pelotas, e ser realizada conforme estabelecido no Capítulo 8 “Análise de Sementes Revestidas” destas RAS.
e) Número mínimo de casas decimais para a pesagem:
O número mínimo de casas decimais necessárias ou resolução da balança para a pesagem com a finalidade de calcular a porcentagem com uma casa decimal é indicado no Quadro 2.1. O registro dos valores das pesagens deve ser realizado com o mesmo número de casas decimais da balança utilizada.
Caso a balança utilizada não seja suficientemente sensível para a detecção do peso de algum componente da amostra, é permitido o uso de balanças de maior resolução para esta pesagem. Nesse caso, o peso também deve ser registrado com todas as casas decimais.
¶ 2.5.3 SEPARAÇÃO DOS COMPONENTES
A amostra de trabalho, ou as subamostras, depois de pesadas e conferidas quanto à autenticidade dos dados do requerente com relação à espécie, deve(m) ser examinada(s) e separada(s) nos três componentes: Semente Pura, Outras Sementes e Material Inerte.
A separação das sementes puras deve ser realizada com base na Definição de Semente Pura - DSP (subitem 2.8) para a espécie em exame e nas definições gerais de sementes puras do subitem 2.4.1.1.
Deve ser realizada através das características visíveis da semente, com ajuda mecânica (peneiras ou sopradores) ou, para algumas Poaceae (subitem 2.5.3.b.2), pressionando moderadamente cada semente suspeita de estar vazia (chocha) sem prejudicar a sua capacidade de germinação. Para outras espécies de Poaceae é necessário utilizar luz transmitida (DSP nº 33, subitem 2.5.3.b.1).
Nota 4: Para classificar os componentes como sementes puras, não é necessário que cada unidade de dispersão seja virada para determinar a presença ou ausência de orifícios ou outras áreas danificadas na parte inferior. Os detalhes da classificação de sementes danificadas estão subitem 2.5.3.c.
Nota 5: Quando não existir Definição de Semente Pura para a espécie em análise, devem ser utilizadas apenas as definições gerais do subitem 2.4.1.1.
Os componentes devem ser pesados em gramas com a precisão necessária para calcular a percentagem com uma casa decimal, conforme o prescrito no subitem 2.5.2.e.
As seguintes particularidades devem ser consideradas na separação dos componentes:
a) Em todas as famílias, inclusive para sementes florestais, exceto em Poaceae:
As unidades de dispersão devem ser examinadas apenas superficialmente, sem o uso de pressão, sem luz transmitida ou outro equipamento especial. As unidades de dispersão pequenas devem ser examinadas na lupa. Se nesse exame for óbvio que não contêm sementes, elas devem ser consideradas como material inerte.
b) Em Poaceae
1) Em Lolium, Festuca, xFestulolium e Elytrigia repens, um antécio fértil (lema e pálea) com uma cariopse de pelo menos um terço do comprimento da pálea, medido a partir da base da ráquila, é considerado como semente pura ou outra semente. Por outro lado, um antécio fértil com uma cariopse menor do que um terço do comprimento da pálea é considerado como material inerte. É necessário utilizar luz transmitida para verificar a presença e o comprimento da cariopse.
2) Em outros gêneros ou espécies, antécios férteis com a cariopse em qualquer estádio de desenvolvimento são considerados como sementes puras (ex.: Urochloa spp. e Megathyrsus maximus). Nesses gêneros, é recomendado o uso de soprador de sementes como equipamento auxiliar (ver subitem 2.5.3.1).
3) Em Arrhenatherum, Avena, Bromus, Chloris, Dactylis, Festuca, xFestulolium, Holcus, Koeleria, Lolium, Poa, Sorghum e Triticum aestivum subsp. spelta, antécios estéreis presos a antécios férteis não devem ser removidos, permanecendo aderidos para serem incluídos na fração semente pura.
c) Sementes danificadas
Não é necessário que cada unidade de dispersão seja virada para determinar a presença ou ausência de orifícios ou outras áreas danificadas na parte inferior antes da unidade de dispersão ser considerada Semente Pura.
Porém, quando ocorrerem danos no tegumento ou no pericarpo, deve-se verificar se a parte remanescente da unidade de dispersão é maior do que a metade de seu tamanho original para então classificar como Semente Pura, Outras Sementes ou Material inerte, conforme prescrito no subitem 2.4.1.1.B. Se esta avaliação não puder ser facilmente realizada, a unidade de dispersão será classificada como Semente Pura ou Outras Sementes.
Em Poaceae, antécios e cariopses quebrados são classificados como Semente Pura ou Outras Sementes, se o pedaço remanescente for maior do que a metade de seu tamanho original.
d) Sementes aladas:
Quando a Definição de Semente Pura da espécie em análise informar que o tegumento é o tecido que forma a ala e envolve o núcleo seminífero, se estiverem presentes sementes aladas, estas devem ser consideradas Semente Pura, porém devem ser separadas, e sua porcentagem por peso deve ser informada em separado, de acordo com o descrito na definição de sementes puras da espécie e com o subitem 2.7.
Nota 6: Após a pesagem, as sementes aladas e o restante da porção “Semente Pura” (não alada) devem ser recombinadas (homogeneizadas), antes de se tomarem as repetições para o Teste de Germinação.
|
A instrução acima deve ser utilizada para as sementes florestais aladas de Pinaceae com Definições de Semente Pura (Quadro 2.3) n° 10 e 31, como as de Abies, Cedrus, Larix, Picea, Pinus, Pseudotsuga e Tsuga. |
e) Sementes com apêndices aderidos:
Em certos gêneros, por exemplo, nas Definições de Semente Pura nº 15, 38, 46 e 62, os frutos podem ter vários apêndices aderidos como aristas, hastes, dentre outros. Esses apêndices devem ser deixados aderidos aos frutos e, quando solicitado pelo requerente, os apêndices mais longos que o maior comprimento da semente devem ser informados, de acordo com o indicado no subitem 2.7.
f) Unidade-semente múltipla
Quando solicitado pelo requerente, para Triticum aestivum subsp. spelta e nos gêneros Avena, Bromus, Dactylis, Festuca, xFestulolium, Koeleria e Lolium, as unidades-sementes múltiplas, como consta na Definição de Semente Pura nº 33 do Quadro 2.2, podem ser pesadas separadamente e informadas, de acordo com o informado no subitem 2.7.
g) Procedimento para quando determinadas impurezas causarem dúvidas nos resultados:
Impurezas consideravelmente diferentes em tamanho ou peso da semente da amostra que está sendo analisada podem comprometer os resultados do teste. Isso pode acontecer com pedras ou sementes grandes de cereais em amostras de sementes pequenas.
Nesses casos, a Análise de Pureza deve ser realizada conforme instruções específicas contidas no Anexo 2.2.
h) Sementes de espécies indistinguíveis:
Quando for difícil ou quase impossível a distinção entre espécies botânicas, podem ser seguidas as instruções específicas contidas no Anexo 2.3.
¶ 2.5.3.1 Uso do soprador como equipamento auxiliar nas análises
Equipamentos de ventilação (sopradores de sementes) podem ser utilizados como ferramenta auxiliar na realização da Análise de Pureza, como, por exemplo, em Poaceae, para separar o material leve, como palhas e antécios vazios, das sementes pesadas, assim como fragmentos de sementes resultantes de quebras ou danos causados por insetos ou doenças.
A intensidade da corrente de ar deve ser controlada de modo a separar o material leve, o qual é retido na(s) aleta(s) do equipamento, enquanto o material pesado permanece no recipiente localizado na parte de baixo do equipamento. Em situações especiais, quando a amostra apresentar material muito diversificado, qualquer fração poderá ser repassada no soprador para facilitar a separação. Todas as frações devem ser examinadas para a detecção de outras sementes.
A Análise de Pureza com o uso do soprador de sementes como equipamento auxiliar (não é um método de ventilação uniforme) é rotineiramente usado no Brasil para sementes não revestidas de Urochloa spp. e Megathyrsus maximus. Pode-se aplicar método equivalente para outras espécies da família Poaceae com sementes de características semelhantes.
Para a Análise de Pureza de amostras de sementes de Urochloa spp. e Megathyrsus maximus com o uso de soprador, deve-se:
a) Primeiramente, peneirar a amostra de trabalho de pureza para remover o material inerte (MI) fino, reservando para posterior análise, caso contrário o mesmo será perdido no soprador, que tem um recipiente telado em sua parte inferior.
b) Verificar a presença de outras sementes no material inerte fino peneirado.
c) Soprar o material retido na peneira em uma primeira abertura do soprador suficientemente baixa para que subam apenas as sementes chochas e outros tipos de material inerte leve, sem que subam sementes puras. O tempo de sopragem deve ser suficiente para que o material inerte leve suba. Usa-se, normalmente, o tempo de três minutos, contados a partir do momento em que se chega à abertura desejada, pois deve-se abrir gradualmente o soprador até essa abertura. O material que sobe não precisa ser apertado para verificar a presença de sementes puras, é apenas avaliado criteriosamente para a detecção de outras sementes. Ou seja, as espiguetas e antécios que sobem nessa primeira abertura são considerados MI. Por essa razão, é crítico que essa abertura seja determinada para que as sementes puras permaneçam no recipiente de fundo telado na parte inferior do soprador após essa primeira sopragem. Se elas subirem, serão pesadas como MI, gerando erro no resultado da Análise de Pureza. Esse material que ficou na parte inferior do equipamento será soprado com a segunda abertura. Pode-se retirar manualmente o material inerte mais pesado antes da realização da sopragem com a segunda abertura.
Nota 7: A amostra de trabalho que subiu na primeira abertura do soprador pode ser repassada em uma abertura menor. Esse procedimento permite verificar a presença de sementes puras que sejam significativamente menores e/ou mais leves que a maioria das sementes puras, cujos pesos podem ser semelhantes aos de sementes chochas. Se essa situação estiver ocorrendo com muita frequência, deve-se ajustar a primeira abertura para a espécie em análise.
d) Soprar na segunda abertura, que deve ser suficientemente alta para remover todo o MI leve e para fazer com que algumas poucas sementes puras também subam. As “sementes” (espiguetas/antécios) que sobem nessa abertura são apertadas para verificar a presença da cariopse, de forma que as sementes puras que subirem serão recuperadas e juntadas à porção semente pura. As sementes que ficarem na parte inferior do soprador já serão consideradas como puras e não serão apertadas, mas apenas separadas do MI mais pesado que ficou em baixo (ex: pedras, torrões, fragmentos vegetais pesados). Em ambas as frações é verificada a presença de outras sementes.
e) Nos casos em que o material que subiu na segunda abertura for composto apenas de sementes chochas, sem presença de sementes puras, usar uma terceira abertura, pois nesse caso, comumente, ainda haverá material inerte leve no material que ficou na parte inferior do soprador. As sementes que subirem nessa terceira abertura devem ser apertadas para detectar as sementes puras e em ambas as frações (material que subiu e material que ficou na parte inferior) deve ser verificada a presença de outras sementes.
f) Pesar separadamente as sementes puras, material inerte e outras sementes, conforme subitem 2.5.2.e (Quadro 2.1). Efetuar os cálculos e a informação dos resultados conforme subitens 2.6 e 2.7.
g) Arquivar todos os componentes da Análise de Pureza.
¶ 2.5.3.1.1 Determinação da abertura de sopradores de sementes
Para determinar as aberturas a serem usadas, recomenda-se testar diferentes aberturas com algumas amostras de sementes puras da espécie que se deseja analisar.
Como primeira abertura, selecionar a maior abertura em que não subiram sementes puras das amostras testadas. Como segunda abertura, usar uma abertura maior que a primeira, que permita que algumas sementes puras subam. Como terceira abertura, usualmente, é suficiente aumentar em 0,5 a 1,0 cm a segunda abertura.
Uma vez tabuladas as aberturas determinadas para cada espécie (ou até para cultivares, se necessário), elas poderão ser usadas na rotina de análises indefinidamente, mas com o cuidado de avaliar a sua adequação na rotina, bem como em caso de suspeita de resultados errados ou periodicamente.
Na rotina de análises, por exemplo, a presença de sementes chochas (vazias) ao cortar sementes puras para o Teste de Tetrazólio indica sopragem insuficiente na Análise de Pureza, que não removeu adequadamente as sementes chochas. Já a presença de sementes puras no material que subiu na primeira abertura indica que ela está muito alta e precisa ser ajustada. Essa avaliação da primeira abertura não é feita na rotina, mas pode ser feita em caso de suspeita de erros ou periodicamente, apertando todas as sementes que subiram nessa abertura, para confirmar a sua adequação.
¶ 2.5.3.2 Análise de pureza de Poa pratensis, Poa trivialis e Dactylis glomerata
O Método de Ventilação Uniforme pode ser utilizado para a Análise de Pureza de Poa pratensis, Poa trivialis e Dactylis glomerata. Para execução desse método, devem ser seguidas as instruções específicas contidas no Anexo 2.4.
Alternativamente, para realizar a Análise de Pureza das espécies citadas acima, o laboratório poderá utilizar o método de separação manual de acordo com a Definição de Semente Pura da espécie analisada. Para este método, é obrigatório o uso de diafanoscópio ou de outro equipamento que forneça luz transmitida.
¶ 2.6 CÁLCULO E EXPRESSÃO DE RESULTADOS
¶ 2.6.1 DE UMA ÚNICA AMOSTRA DE TRABALHO INTEIRA
¶ 2.6.1.1 Teste para verificação para ganho ou perda de peso durante a análise
Somar o peso de todas as frações da amostra de trabalho. Esta soma deve ser comparada com o peso inicial para verificar se ocorreu ganho ou perda de peso. Se houver uma diferença maior do que 3% do peso inicial, repesar os componentes para verificar se houve erro de pesagem e no caso de o peso se manter o mesmo, um novo teste deverá ser realizado. O resultado do novo teste é então informado.
¶ 2.6.1.2 Cálculo da porcentagem dos componentes
A porcentagem por peso de cada componente deve ser informada no Boletim de Análise de Sementes, com uma casa decimal. As porcentagens devem ser baseadas na soma dos pesos dos componentes e não no peso inicial da amostra de trabalho. Componentes com menos de 0,05% devem ser informados como “Traço”.
¶ 2.6.1.3 Procedimento de arredondamento
Frações informadas como “Traço” são excluídas do cálculo. Somando as porcentagens de todas as frações, estas devem totalizar 100,0%. Se a soma não totalizar 100,0% (99,9 ou 100,1%), deve-se subtrair ou adicionar 0,1% ao maior valor (normalmente na fração de semente pura). Se for necessária uma correção maior do que 0,1%, deve-se verificar se não houve erro de cálculo.
¶ 2.6.2 DE DUAS OU MAIS AMOSTRAS DE TRABALHO INTEIRAS
Há ocasiões em que pode ser necessário testar uma segunda amostra de trabalho inteira. Neste caso, o procedimento a ser seguido encontra-se nas instruções específicas contidas no Anexo 2.5.
¶ 2.7. INFORMAÇÃO DOS RESULTADOS
O peso real analisado deve ser informado no Boletim de Análise de Sementes individual, respeitando-se o peso da amostra de trabalho prescrito no Quadro 1.5 ou no Quadro 1.6 ou de normas específicas, além da tolerância estabelecida nestas RAS.
No Boletim de Análise de Sementes coletivo, deve ser informado o peso prescrito no Quadro 1.5 ou Quadro 1.6 ou normas específicas.
O resultado da Análise de Pureza deve ser fornecido com uma casa decimal e a porcentagem de todos os componentes deve totalizar 100,0%. Conforme informado no subitem 2.6.1.2, componentes com menos de 0,05% devem ser informados como “Traço”.
As porcentagens de Semente Pura, Outras Sementes e Material Inerte devem ser informadas nos espaços apropriados do Boletim de Análise de Sementes. Se o resultado de um componente for zero, este deve ser informado como “0,0” no espaço apropriado.
O nome científico da espécie da Semente Pura deve ser informado no Boletim de Análise de Sementes conforme consta no Registro Nacional de Cultivares – RNC ou com os Quadros 1.5 ou 1.6 ou com a Lista de Nomes Estabilizados da ISTA em vigor, ou GRIN-USDA ou REFLORA - Plantas do Brasil.
O nome científico de cada espécie de Outras Sementes deve ser informado de acordo, primeiramente, com a Lista de Nomes Estabilizados da ISTA em vigor, seguido do GRIN-USDA e depois do REFLORA - Plantas do Brasil, nessa ordem. O relato deve ser feito conforme indicado no subitem 3.3 do Capítulo de Determinação de Outras Sementes por número.
Mais detalhes sobre o relato das outras sementes encontradas na Análise de Pureza estão informados no Capítulo 3 “Determinação de Outras Sementes por Número – DOSN”.
|
Para sementes florestais, quando não houver previsão para a realização da Determinação de Outras Sementes por Número – DOSN na legislação específica, se forem encontradas outras sementes na amostra, esse resultado deve ser relatado de acordo com o subitem 3.7 do Capítulo 3 “Determinação de Outras Sementes por Número”. Ressalvando-se que:
10 - Acacia mangium (1); Dalbergia nigra (1) |
A natureza do material inerte encontrado na amostra deve ser relatada levando-se em consideração as definições do subitem 2.4.3, mais especificamente o subitem “I”. Exemplo: fragmentos de sementes, tegumentos, aristas, palhas, torrões, pó, escleródios, insetos mortos, galhas de nematoides etc. Se não houver material inerte, anular esse campo. Quando solicitado pelo requerente, a porcentagem de algum Material Inerte específico deve ser informada no campo “Observações".
Se, de acordo com o subitem 2.5.3.d, for necessário calcular a porcentagem de sementes aladas, esse resultado deve ser informado no campo “Observações” do Boletim de Análise de Sementes.
Esse mesmo campo do boletim deve ser utilizado quando, a pedido do requerente, for quantificado um determinado tipo de material inerte ou uma espécie de uma outra semente ou uma unidade-semente múltipla - USM ou sementes com apêndices aderidos como especificado no subitem 2.5.3.e.
¶ 2.8 DEFINIÇÕES DE SEMENTE PURA
No Quadro 2.2, encontra-se o número da Definição de Semente Pura (DSP) por gênero e família botânica de diversas espécies agrícolas.
No Quadro 2.3, encontra-se o número da Definição de Semente Pura (DSP) por gênero e família botânica das espécies florestais.
A Definição de Semente Pura refere-se a todas as espécies pertencentes ao mesmo gênero (observando-se as possíveis exceções informadas nos Quadros 2.2 e 2.3) e tem a finalidade de padronizar a classificação das estruturas como “Semente Pura” e “Outras Sementes” durante a Análise de Pureza. Na última coluna do quadro, a letra “P” indica as unidades de dispersão que não deslizam facilmente, como as palhentas em Poaceae (a não ser que suas estruturas palhentas tenham sido previamente removidas) ou indica outros gêneros que apresentam unidades de dispersão com apêndices (ganchos, espinhos, alas etc.) ou ainda por apresentarem superfície rugosa. Esta observação (“P” = Palhentas) tem o propósito de indicar a coluna correta a ser usada nas tabelas de tolerância da Análise de Pureza.
Nas Definições de Semente Pura, são utilizados termos botânicos para identificar as estruturas das sementes e frutos, por isso, quando necessário, o laboratório deve utilizar o Glossário Ilustrado de Morfologia (BRASIL, 2009) ou outro Dicionário Botânico para melhor entendimento das definições.
¶ 2.9 TABELAS DE TOLERÂNCIA DA ANÁLISE DE PUREZA
As tabelas de tolerância para Análise de Pureza estão contidas no Anexo 2.6 (rev. 1.1):
TABELA 2.6.1 (rev. 1.1): Comparação de resultados de duas amostras de trabalho, obtidas da mesma amostra média, no mesmo ou em diferentes laboratórios.
TABELA 2.6.2 (rev. 1.1): Comparação de resultados de duas amostras de trabalho, obtidas de duas amostras médias do mesmo lote, e analisadas no mesmo ou em diferentes laboratórios.
TABELA 2.6.3 (rev. 1.1): Comparação de resultados de duas subamostras (com metade do peso recomendado para a amostra de trabalho) obtidas da amostra média.
TABELA 2.6.4 (rev. 1.1): Comparação de resultados de duas amostras de trabalho obtidas de diferentes amostras médias, do mesmo lote, quando o resultado da segunda análise é pior de que o resultado da primeira análise, realizada no mesmo laboratório ou em diferentes laboratórios.
¶ 2.10 BIBLIOGRAFIA
BRASIL. Lei nº 10.711, de 5 de agosto de 2003 (dispõe sobre o Sistema Nacional de Sementes e Mudas). Diário Oficial da União: Brasília, DF, de 6 de agosto de 2003. Seção 1, p.1-4.
BRASIL. Instrução Normativa nº 30, de 21 de maio de 2008 (estabelece normas e padrões para produção e comercialização de sementes de espécies forrageiras de clima tropical). Diário Oficial da União: Brasília, DF, de 23 de maio de 2008. Seção 1, p.45-48.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Análise de Pureza. In: Regras para Análise de Sementes. Brasília, DF: Secretaria de Defesa Agropecuária, 2009. Cap.1, p.91-133.
BRASIL. Instrução Normativa nº 40, de 30 de novembro de 2010 (aprova os modelos e instruções de preenchimento de Boletins de Análise de Sementes para fins de identificação e certificação). Diário Oficial da União: Brasília, DF, de 1º de dezembro de 2010. Seção 1, p.4-7.
BRASIL. Instrução Normativa nº 30, de 09 de junho de 2011 (altera o peso mínimo das amostras de trabalho para análise de pureza e determinação de outras sementes por número de espécies forrageiras de clima tropical). Diário Oficial da União: Brasília, DF, de 10 de junho de 2011. Seção 1, p. 9.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instruções para análises de sementes de espécies florestais. Brasília, DF, 2013. 97p.
BRASIL. Instrução Normativa nº 41, de 11 de setembro de 2013 (insere ou altera informações para algumas espécies no Quadro 1.2 das Regras para Análise de Sementes constantes do Anexo I da Instrução Normativa nº 40, de 30 de setembro de 2009). Diário Oficial da União: Brasília, DF, de 20 de setembro de 2013. Seção 1, p.6-27.
BRASIL. Instrução Normativa nº 45, de 17 de setembro de 2013 (estabelece padrões de identidade e qualidade para produção e comercialização de sementes de diversas culturas). Diário Oficial da União: Brasília, DF, de 20 de setembro de 2013. Seção 1, p.6-27.
BRASIL. Instrução Normativa nº 44, de 22 de novembro de 2016 (estabelece padrões de identidade e qualidade de sementes de espécies forrageiras de clima temperado). Diário Oficial da União: Brasília, DF, de 1º de dezembro de 2016. Seção 1, p.8-11.
BRASIL. Instrução Normativa nº 17, de 26 de abril de 2017 (Regulamentar a Produção, a Comercialização e a Utilização de Sementes e Mudas de Espécies Florestais ou de Interesse Ambiental ou Medicinal, Nativas e Exóticas, visando garantir sua procedência, identidade e qualidade.). Diário Oficial da União: Brasília, DF, de 28 de abril de 2017. Seção 1, p.6-14.
BRASIL. Instrução Normativa nº 19, de 16 de maio de 2017 (Retifica a IN 17, DE 26 de abril de 2017). Diário Oficial da União: Brasília, DF, de 19 de maio de 2017. Seção 1, p.2-2.
BRASIL. Instrução Normativa nº 42, de 17 de setembro de 2019 (estabelece normas para a produção de sementes e mudas de espécies olerícolas, condimentares, medicinais e aromáticas e seus padrões de sementes). Diário Oficial da União: Brasília, DF, de 19 de setembro de 2019. Seção 1, p.4-9.
BRASIL. Portaria nº 538, de 20 de dezembro de 2022 (estabelece as normas para a produção, a certificação, a responsabilidade técnica, o beneficiamento, a reembalagem, o armazenamento, a amostragem, a análise, a comercialização e a utilização de sementes.). Diário Oficial da União: Brasília, DF, de 21 de dezembro de 2022. Seção 1- p. 14-20.
HALL, G. et al. ISTA handbook on Pure Seed Definitions. 3rd edition. Switzerland: International Seed Testing Association (ISTA), 2010.127p.
ISTA - INTERNATIONAL SEED TESTING ASSOCIATION. International rules for seed testing. ed. 2024. Wallisellen, Switzerland, 2024. Chapter 3: The purity analysis, p.3.1-3.25.
ISTA - INTERNATIONAL SEED TESTING ASSOCIATION. List of stabilized plant names. 7.ed. Bassersdorf: Nomenclature Committee, 2021. 73p. Disponível em: https://www.seedtest.org/en/services-header/tools/nomenclature-committee.html. Acesso em: 30 Ago 2024.
REFLORA. Flora e Funga do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: < http://floradobrasil.jbrj.gov.br/ >. Acesso em: 30 Ago 2024
USDA. GRIN-Global U.S. National Plant Germplasm System. Acesso em 21/06/2024. https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomysearch
¶ 2.11 HISTÓRICO DE REVISÕES
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1 | - | 28/03/2025 | Criação do documento |
| 1.1 | Links do Quadro 1.5 | 01/07/20025 | Atualização dos links do Quadro 1.5 da rev. 1.2 para a rev. 1.3 |
¶ ANEXOS
ANEXO 2.1: CÁLCULO E EXPRESSÃO DE RESULTADOS DA ANÁLISE DE PUREZA QUANDO FOREM UTILIZADAS DUAS SUBAMOSTRAS DE TRABALHO COM METADE DO PESO RECOMENDADO (rev.1).
ANEXO 2.2: PROCEDIMENTO PARA QUANDO DETERMINADAS IMPUREZAS CAUSAREM DÚVIDAS NOS RESULTADOS DA ANÁLISE DE PUREZA (rev. 1).
ANEXO 2.3: IDENTIFICAÇÃO DE SEMENTES DE ESPÉCIES INDISTIGUÍVEIS NA ANÁLISE DE PUREZA (rev. 1).
ANEXO 2.4: ANÁLISE DE PUREZA PELO MÉTODO DE VENTILAÇÃO UNIFORME (rev. 1).
ANEXO 2.5: ANÁLISE DE PUREZA COM DUAS OU MAIS AMOSTRAS DE TRABALHO INTEIRAS (rev. 1).
ANEXO 2.6: TABELAS DE TOLERÂNCIA DA ANÁLISE DE PUREZA (rev. 1).
QUADRO 2.2: DEFINIÇÕES DE SEMENTE PURA (DSP) PARA ESPÉCIES AGRÍCOLAS (rev. 1).
QUADRO 2.3: DEFINIÇÕES DE SEMENTE PURA (DSP) PARA ESPÉCIES FLORESTAIS (rev. 1).