¶ Folha de rosto
©2025 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária - MAPA
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Coordenação-Geral de Laboratórios Agropecuários - CGAL
Sítio eletrônico: https://wikisda.agricultura.gov.br
e-mail (dúvidas e sugestões): ras@agro.gov.br
Central de Relacionamento: 0800-704-1995
Coordenação dos trabalhos técnicos: Júlio César Garcia - (LASO/LFDA-MG)
Equipe Técnica:
| Alessandra de Oliveira Pulcineli - (LASO/LFDA-GO) | Maria Izabel Furst Gonçalves - (LASO/LFDA-MG) |
| Érica Cardoso Vilela Barbara - (LASO/LFDA-GO) | Maria Paula Domene - (LASO/CATI) |
| Ernesto do Nascimento Viegas - (CGAL/DTEC) | Matheus Emanuel de Queiroz - (LASO/LFDA-MG) |
| Fábio Lopes da Cruz - (LASO/LFDA-MG) | Melissa Yurie Toguchi - (LASO/LFDA-GO) |
| Fabrício Pedrotti - (CGAL/DTEC) | Nilson C. Castanheira Guimarães - (CGAL/DTEC) |
| Henrique Martins Sant’Anna - (LASO/LFDA-RS) | Patrícia Branco Piano - (LASO/LFDA-RS) |
| Henrique Sérgio Lima - (LASO/LFDA-PE) | Patrícia Ribeiro Cursi - (LASO/CATI) |
| Hiromi S. Y. Sassagawa Sant’Anna - (LASO/LFDA-RS) | Sylvia T. B. de Oliveira Sabino - (LASO/LFDA-PE) |
| Luiz Artur Costa do Valle - (LASO/LFDA-MG) | Vitor Breda Bezerra Rego - (LASO/LFDA-RS) |
| Magda Birck Garcia - (LASO/LFDA-RS) |
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Definir os métodos oficiais a serem utilizados nas análises para identificação e verificação da qualidade de lotes de sementes a serem comercializados no mercado interno. |
|||
|
Processo: Análises de sementes |
||||
|
Entrega: Garantia da identidade e qualidade de lotes de sementes |
Público alvo e demais interessados: Laboratórios de análise de sementes credenciados no Renasem |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação-Geral de Laboratórios Agropecuários – CGAL, vinculada ao Departamento de Serviços Técnicos - DTEC da Secretaria de Defesa Agropecuária – SDA, do Ministério da Agricultura e Pecuária – MAPA é o órgão responsável pela Rede Nacional de Laboratórios Agropecuários do Sistema Unificado de Atenção à Sanidade Agropecuária e possui dentre suas atribuições estabelecer, uniformizar e oficializar métodos para a realização de análises. |
||||
¶ 4.0 ESCOPO
Este capítulo trata da metodologia dos testes de germinação de espécies não florestais.
A metodologia para testes de germinação de espécies florestais encontra-se descrita no Capítulo 14 “Análise de Espécies Florestais” destas Regras para Análise de Sementes - RAS.
Para testes de germinação por repetições pesadas, de sementes revestidas e de misturas de sementes deve-se consultar primeiramente os capítulos específicos destas RAS (Capítulos 12, Capítulo 8 e Capítulo 10, respectivamente) e, posteriormente, utilizar esse capítulo no que for aplicável.
Os testes de germinação de misturas devem ser realizados com 400 sementes para cada componente da mistura, utilizando-se a metodologia descrita neste capítulo.
¶ 4.1 OBJETIVO
Determinar, em condições ótimas e controladas de laboratório, o potencial máximo de germinação de um lote de sementes, o qual pode ser usado para comparar a qualidade de diferentes lotes e também estimar o seu valor para fins de semeadura. As condições de análise são padronizadas para que os resultados dos testes de germinação possam ser reproduzidos e comparados, dentro de limites tolerados por estas RAS.
¶ 4.2 DEFINIÇÕES
¶ 4.2.1 GERMINAÇÃO
A germinação de sementes em testes de laboratório é considerada como a emergência e o desenvolvimento das estruturas essenciais do embrião, demonstrando sua aptidão para produzir uma planta normal sob condições favoráveis.
¶ 4.2.2 PORCENTAGEM DE GERMINAÇÃO
Nos testes de laboratório, a porcentagem de germinação das sementes corresponde à proporção do número de sementes que produziu plântulas classificadas como normais, nas condições e períodos especificados no Quadro 4.1, ou seja, a porcentagem de plântulas normais.
¶ 4.2.3 ESTRUTURAS ESSENCIAIS
Para que uma plântula possa continuar seu desenvolvimento, ela deve apresentar uma combinação específica das seguintes estruturas essenciais:
- Sistema radicular: raiz primária e, em certos gêneros, raízes seminais.
- Parte aérea: hipocótilo, epicótilo, mesocótilo (em certas Poaceae), gema terminal, cotilédones (um ou mais) e coleóptilo (em todas Poaceae).
Para uma avaliação mais precisa de defeitos nas estruturas essenciais durante a avaliação do Teste de Germinação, pode ser necessário o uso de lupa ou de estereomicroscópio para verificação da intensidade dos danos.
¶ 4.2.4 REGRA DOS 50%
A regra dos 50% é usada na avaliação dos cotilédones e das folhas primárias.
Tecido cotiledonar:
- As plântulas são consideradas normais quando metade ou mais do total do tecido dos cotilédones for funcional.
- As plântulas são consideradas anormais quando mais da metade do tecido dos cotilédones estiver ausente, necrosado, deteriorado ou descolorido.
Folhas primárias:
- É necessária a avaliação das folhas primárias para algumas espécies, tais como as do gênero Phaseolus.
- As plântulas são consideradas normais quando metade ou mais do tecido da folha primária for funcional.
- As plântulas são consideradas como anormais quando mais da metade do tecido da folha primária estiver ausente, necrosado, deteriorado ou descolorido.
- A regra dos 50% não é aplicável se os dois pontos de ligação dos cotilédones ao eixo embrionário ou se a gema terminal estiver necrosada ou apodrecida. Essas plântulas são anormais independentemente da condição dos cotilédones ou das folhas primárias. Essa regra também não se aplica quando o ponto de ligação de um cotilédone estiver necrosado ou apodrecido e o outro cotilédone não estiver intacto, situação em que a plântula será considerada anormal.
¶ 4.2.5 PLÂNTULAS NORMAIS
Plântulas normais são aquelas que mostram potencial para continuar seu desenvolvimento e dar origem a plantas satisfatórias, quando desenvolvidas sob condições favoráveis. Para serem classificadas como normais, as plântulas devem estar de acordo com uma das seguintes categorias:
Plântulas intactas: plântulas com todas as suas estruturas essenciais bem desenvolvidas, completas, proporcionais e saudáveis (ver detalhes no subitem 4.2.5.1).
Plântulas com defeitos aceitáveis: plântulas apresentando pequenos defeitos em suas estruturas essenciais de maneira a não comprometer seu desenvolvimento, desde que elas apresentem desenvolvimento equilibrado e comparável aos das demais plântulas intactas do mesmo teste (ver subitem 4.2.5.2).
Plântulas com infecção secundária: plântulas nas quais for evidente que se enquadrariam em uma das categorias acima, mas que foram afetadas por fungos ou bactérias provenientes de fontes externas não originadas da própria semente (ver subitem 4.2.5.3).
¶ 4.2.5.1 Plântulas Intactas
Plântulas intactas, dependendo da espécie que estiver sendo analisada, devem mostrar uma combinação específica de algumas das seguintes estruturas essenciais:
Sistema radicular bem desenvolvido e formado por:
- Raiz primária longa e delgada geralmente revestida por numerosos pelos absorventes e terminando numa extremidade afilada.
- Raízes secundárias produzidas dentro do período de duração do teste.
- Várias raízes secundárias em vez de uma raiz primária, em certos gêneros como Avena, Cyclamen, Hordeum, Secale, Triticum e xTriticosecale.
Parte aérea bem desenvolvida e formada por:
- Hipocótilo reto, geralmente delgado e alongado, nas plântulas de germinação epígea.
- Hipocótilo e epicótilo, ambos alongados, em alguns gêneros com germinação epígea.
- Epicótilo bem desenvolvido, nas plântulas de germinação hipógea.
- Mesocótilo alongado, em certos gêneros de Poaceae.
Número específico de cotilédones:
- Um cotilédone em monocotiledôneas ou, excepcionalmente, também em dicotiledôneas (pode ser verde e foliáceo ou modificado, permanecendo total ou parcialmente no interior da semente).
- Dois cotilédones em dicotiledôneas. Em plântulas com germinação epígea, eles geralmente são verdes e foliáceos, com tamanho e forma variando com a espécie em análise. Em plântulas com germinação hipógea, os cotilédones são geralmente carnosos e, geralmente, permanecem dentro do tegumento.
- Número variável de cotilédones (2–18) em Coníferas (geralmente verdes, longos e estreitos).
Folhas primárias verdes e em expansão:
- Uma folha primária, algumas vezes precedida por folhas escamiformes (catafilos), em plântulas com folhas alternadas.
- Duas folhas primárias, em plântulas com folhas opostas.
Gema apical:
- Uma, no ápice da parte aérea, cujo desenvolvimento varia de acordo com a espécie em análise.
Coleóptilo:
- Um, reto e bem desenvolvido, em Poaceae, com uma folha verde, a plúmula, que se estende até o ápice ou, eventualmente, emergindo através dele.
|
Plântulas de espécies arbóreas com germinação epígea:
|
¶ 4.2.5.2 Plântulas com Defeitos Aceitáveis
Plântulas apresentando pequenos defeitos em suas estruturas essenciais de maneira a não comprometer seu desenvolvimento quando comparadas com uma plântula intacta do mesmo teste, desde que elas apresentem desenvolvimento equilibrado e comparável aos das demais plântulas intactas do mesmo teste. Detalhes sobre os defeitos aceitáveis para cada “Grupo de Avaliação de Plântulas” (Quadro 4.2) estão listados na Tabelas 1 (monocotiledôneas) e na Tabela 3 (dicotiledôneas) do Anexo “Critérios de Avaliação de Plântulas”.
Sistema radicular:
- Raiz primária com danos limitados (não afetando o tecido condutor) ou pequeno retardamento no crescimento (em Spinacia oleracea, o comprimento da raiz primária tem que ser igual ou maior do que metade do comprimento do hipocótilo).
- Para todas as espécies que pertencem a um dos “Grupos de Avaliação de Plântulas” que tenha final 2 (ver Quadro 4.2), raiz primária deficiente, mas com raízes secundárias suficientemente bem desenvolvidas. São exemplo desses gêneros e espécies: Cucumis, Cucurbita, Citrullus e Gossypium (Grupo 2-1-1-2), Phaseolus vulgaris (Grupo 2-1-2-2), Pisum e Vicia (Grupo 2-2-2-2) e Sorghum e Zea mays (Grupo 1-2-3-2).
- Para Glycine max (Grupo 2-1-2-2) e Helianthus annuus (Grupo 2-1-1-2), quando a raiz primária estiver defeituosa, há um critério específico: uma plântula deve ser considerada normal (com defeitos aceitáveis) se houver pelo menos três raízes secundárias maiores ou iguais à metade do hipocótilo (ver ilustrações na publicação da ISTA “Seedling evaluation of Glycine max”).
- Apenas uma raiz seminal forte e sem defeitos em Avena, Hordeum, Secale, Securigera, Triticum e xTriticosecale.
- Pelo menos duas raízes seminais fortes e sem defeitos em Cyclamen.
Parte aérea:
- Hipocótilo, epicótilo ou mesocótilo com danos limitados (que não atinjam os tecidos dos vasos condutores).
- Cotilédones com danos limitados (se metade ou mais da área total do tecido ainda funcionar normalmente, conforme a regra dos 50% (ver subitem 4.2.4), e se não houver evidência de dano ou deterioração do ápice da parte aérea ou dos tecidos adjacentes).
- Somente um cotilédone normal, em dicotiledôneas (se não houver evidência de dano ou deterioração do ápice da parte aérea ou dos tecidos adjacentes).
- Três cotilédones ao invés de dois, desde que atenda a regra dos 50% (ver subitem 4.2.4).
- Cotilédones fundidos (desde que atendam a regra dos 50% - ver subitem 4.2.4).
- Folhas primárias com danos limitados, se metade ou mais da área total do tecido ainda funcionar normalmente, dentro da regra dos 50% (ver subitem 4.2.4).
- Somente uma folha primária normal (ex.: Phaseolus), se não houver evidência de dano ou deterioração da gema apical.
- Três ou mais folhas primárias ao invés de duas (por ex.: Phaseolus), desde que atendam a regra dos 50% (ver subitem 4.2.4).
- Em testes em areia, folhas primárias em Phaseolus que estão completamente formadas, mas com tamanho reduzido, desde que sejam maiores do que um quarto do tamanho normal.
- Coleóptilo com dano limitado.
- Coleóptilo com uma fenda que se estende do ápice à base até um terço do comprimento total (seguir esta instrução para Zea mays, se a plântula ainda não tiver emitido a folha primária). Porém, se a plântula já tiver emitido a folha primária, a classificação das plântulas deve considerar a condição desta folha, devendo-se utilizar o critério descrito na nota abaixo.
Nota 1: Se a folha primária das plântulas de milho (Zea mays) já tiver sido emitida, as plântulas apresentadas na Figura 4.1.a (com defeitos no coleóptilo) são consideradas normais somente se a primeira folha estiver intacta ou levemente danificada, conforme as duas primeiras ilustrações da Figura 4.1.b. Porém, são consideradas anormais se a primeira folha estiver danificada conforme ilustrações de “folhas danificadas” da Figura 4.1.b.
- Coleóptilo com leve torção ou formando um laço, porque está preso sob a lema e a pálea ou pericarpo do fruto.
- Coleóptilo com uma folha verde (plúmula) que não se estende do interior até o ápice, mas alcança pelo menos a metade do comprimento total.
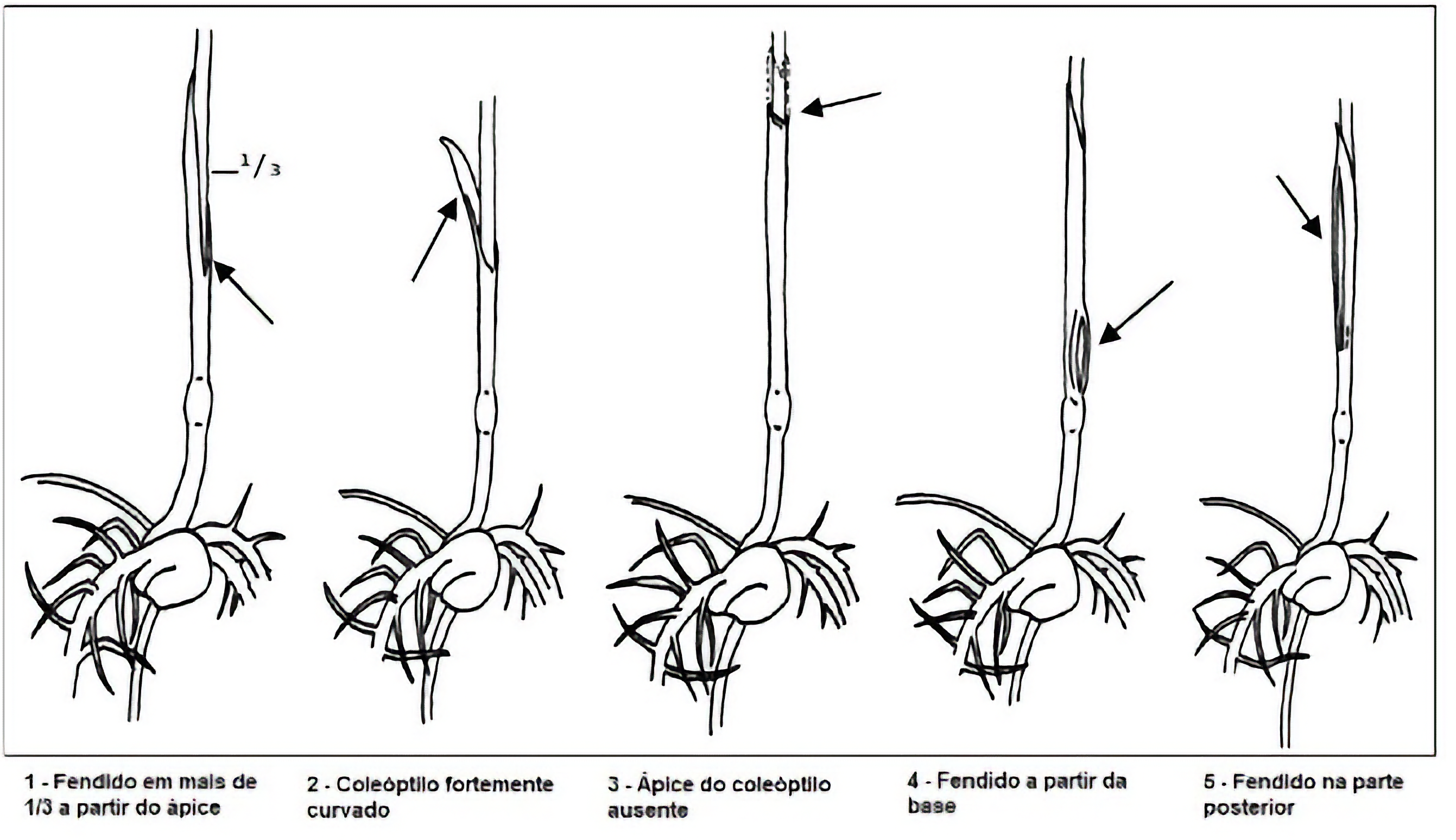
FIGURA 4.1.a: Plântulas normais de milho (Zea mays) com pequenos defeitos no coleóptilo.
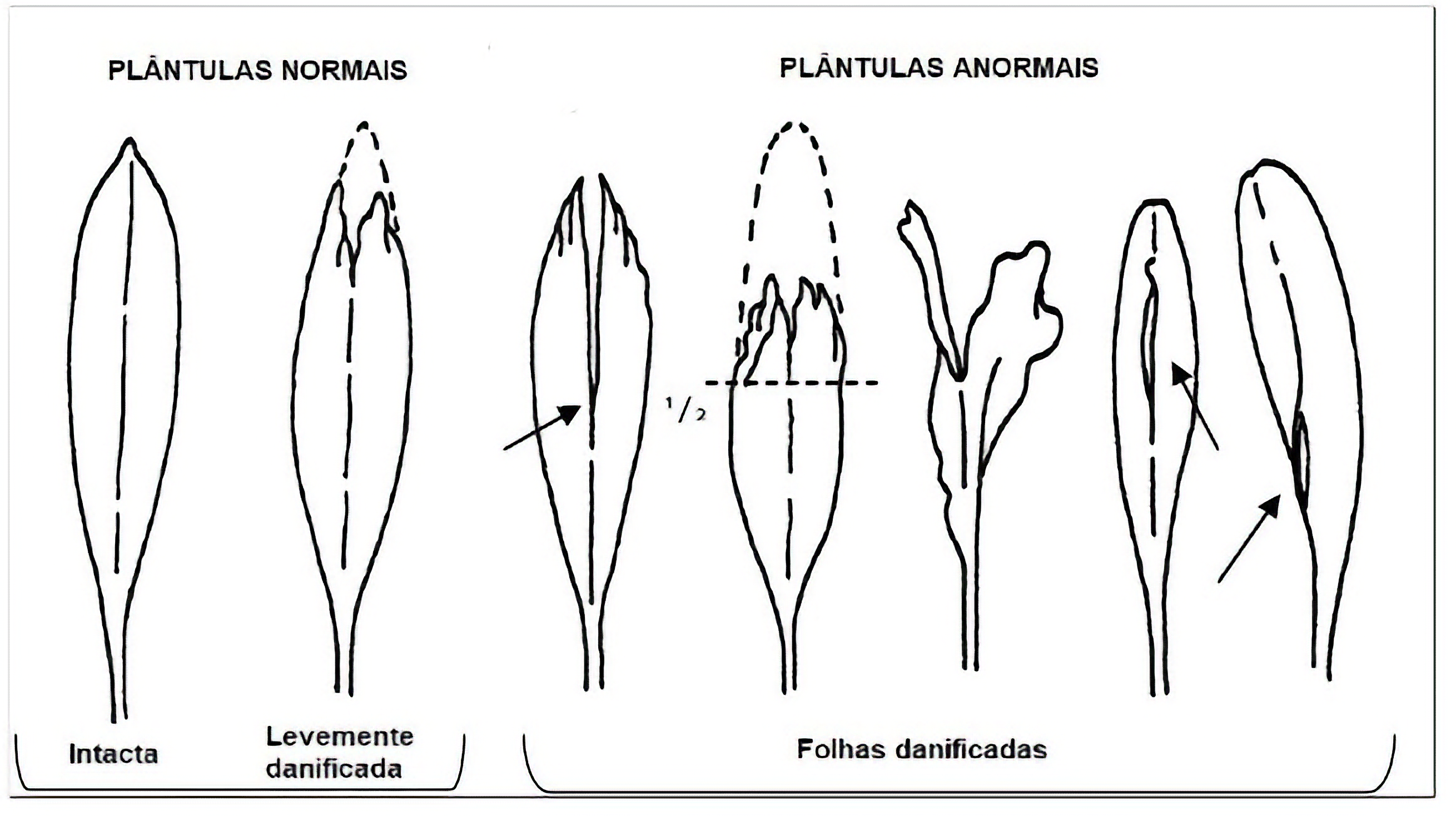
FIGURA 4.1.b: Folhas primárias intactas, levemente danificadas e danificadas para avaliação de plântulas com defeitos no coleóptilo.
¶ 4.2.5.3 Plântulas com Infecção Secundária
Plântulas que estão deterioradas devido à presença de fungos ou bactérias são classificadas como normais, se ficar evidente que a própria semente não é a fonte da infecção e se possa verificar que todas as estruturas essenciais estão presentes.
São exemplos de fontes de contaminação secundária, plântulas e sementes deterioradas próximas da plântula afetada.
¶ 4.2.6 PLÂNTULAS ANORMAIS
Plântulas anormais são aquelas que não mostram potencial para continuar seu desenvolvimento e dar origem a plantas normais, mesmo crescendo em condições favoráveis. As seguintes plântulas são classificadas como anormais:
Plântulas Danificadas: plântulas com qualquer uma das suas estruturas essenciais ausentes ou tão danificadas que impeçam o seu desenvolvimento proporcional.
Plântulas Deformadas ou desbalanceadas: plântulas com desenvolvimento fraco ou com distúrbios fisiológicos ou com estruturas essenciais deformadas ou desproporcionais.
Plântulas Deterioradas: plântulas com qualquer uma de suas estruturas essenciais muito infectadas ou muito deterioradas, como resultado de uma infecção primária (originada da própria semente), que comprometa o seu desenvolvimento normal.
Os detalhes sobre as anormalidades para cada “Grupo de Avaliação de Plântulas” (Quadro 4.2) estão listados na Tabela 1 (monocotiledôneas) e na Tabela 3 (dicotiledôneas) do Anexo “Critérios de Avaliação de Plântulas”.
¶ 4.2.6.1 Anormalidades de plântulas:
Uma plântula é classificada como anormal quando apresentar um ou mais dos seguintes defeitos:
a) Plântula como um todo:
- Deformada
- Profundamente rachada ou quebrada
- Cotilédones emergindo antes da raiz
- Duas plântulas fundidas
- Endosperma anelar persistente
- Albina ou muito amarelada (se a condição não for provocada por deficiência de luz durante o teste)
- Muito retorcida
- Hialina (aspecto vítreo)
- Com sintomas de fitoxicidade conforme descrito em 4.3.1.b.
- Desbalanceadas (com estruturas desproporcionais entre si).
- Deteriorada devido a uma infecção primária.
- Em Poaceae: endosperma destacado da plântula.
b) Sistema radicular:
b.1 Raiz primária:
- Atrofiada
- Muito curta e grossa
- Desenvolvimento menor, desproporcional em relação às outras estruturas da plântula
- Ausente
- Profundamente rachada ou quebrada
- Fendida na extremidade ou em toda sua extensão
- Com forte estrangulamento
- Muito fina e fraca
- Muito retorcida
- Se ao final do teste ainda estiver presa no tegumento da semente
- Com geotropismo negativo (se não tiver sido provocado pela condição do teste)
- Hialina (com aspecto vítreo)
- Deteriorada devido a uma infecção primária
Nota 2: Em espécies pertencentes a um “Grupo de Avaliação de Plântulas” para o qual raízes secundárias determinam a classificação da plântula (ou seja, quando a raiz primária puder ser substituída por raízes secundárias), como ocorre nos grupos de avaliação de plântulas com final 2, quando existirem raízes secundárias suficientes, as plântulas devem ser consideradas normais (ver subitem 4.2.5.2). Por outro lado, se as raízes secundárias apresentarem um ou mais dos defeitos listados acima, serão consideradas anormais e não poderão substituir uma raiz primária anormal, sendo as plântulas classificadas como anormais.
b.2 Raízes seminais:
- Ausente
- Atrofiada
- Curta e grossa
- Pouco desenvolvida
- Com geotropismo negativo
- Hialina
- Deteriorada devido a uma infecção primária
Nota 3: Raízes seminais com um ou mais dos defeitos listados acima são anormais e não podem substituir uma raiz primária anormal. Ressaltando-se que em Avena, Hordeum, Secale, Securigera, xTriticosecale e Triticum pelo menos uma raiz seminal forte (e sem defeitos) é requerida para uma plântula ser considerada normal, e para Cyclamen, pelo menos duas raízes seminais fortes (e sem defeitos) são requeridas.
c) Parte aérea:
c.1 Hipocótilo, epicótilo e mesocótilo:
- Com rachadura profunda ou quebrada
- Com fenda que atravessa a estrutura, atingindo os tecidos dos vasos condutores
- Ausente
- Muito curvado ou formando um laço ou espiral fechados
- Com estrangulamento
- Torção completa ao longo de todo o comprimento da estrutura
- Fortemente espiralado ou muito retorcido
- Hialino (aspecto vítreo)
- Mostra fototropismo negativo (que não foi provocado pela condição do teste)
- Deteriorado devido a uma infecção primária
- Muito curto e grosso, exceto em Cyclamen
- Não formando um tubérculo, somente em Cyclamen
c.2 Cotilédones (aplicar a regra dos 50% conforme explicação do subitem 4.2.4):
- Inchados ou enrolados
- Deformados
- Quebrados
- Separados da plântula ou ausentes
- Descoloridos
- Necrosados
- Hialinos (aspecto vítreo)
- Deteriorados devido a uma infecção primária
Nota 4: Danos ou deterioração dos cotilédones nos dois pontos de inserção com o eixo da plântula ou nos tecidos adjacentes da gema apical (ápice da parte aérea) classificam a plântula como anormal, independentemente da regra dos 50%. A regra dos 50% não deve ser aplicada se o ponto de inserção de um cotilédone estiver necrosado ou deteriorado e o outro cotilédone não estiver intacto, sendo tais plântulas também consideradas anormais.
c.2.1 Defeitos específicos para o cotilédone de Allium:
- Sem “joelho” definido (joelho é uma dobra típica de plântulas normais deste gênero)
- Muito curto e grosso
- Com estrangulamento
- Formando um laço fechado ou fortemente espiralado (muito retorcido)
- Muito fino e comprido (se não for devido à condição do teste)
- Deteriorado devido a uma infecção primária
c.3 Folhas primárias (aplicar a Regra dos 50% conforme explicação do subitem 4.2.4):
- Muito deformadas
- Danificadas
- Ausentes
- Descoloridas (brancas ou amareladas se tal condição não foi provocada por falhas na iluminação do teste)
- Necrosadas
- Somente em testes em areia de Phaseolus: de formato normal, porém menor que ¼ do tamanho normal.
- Deterioradas devido a uma infecção primária
c.4 Gema apical e tecidos adjacentes:
- Deformados
- Danificados
- Ausentes
- Deteriorados, devido a uma infecção primária
Nota 5: Se a gema apical estiver defeituosa ou ausente, a plântula é considerada anormal mesmo que uma ou duas gemas axilares (ex.: Phaseolus) ou brotos axilares (ex.: Pisum) tenham se desenvolvido.
c.5 Coleóptilo (em monocotiledôneas, exceto para milho (Zea mays), cujo critério consta em c.7):
- Muito curto, grosso ou deformado
- Quebrado
- Ausente
- Com ápice danificado ou ausente
- Muito curvado ou formando um laço fechado
- Formando uma espiral (muito retorcido)
- Fendido por mais de um terço do comprimento a partir do ápice
- Fendido em local diferente do ápice (frequentemente a folha primária emerge nesta fenda)
- Preso sob a lema ou sob a testa e pouco desenvolvido
- Deteriorado devido a uma infecção primária
c.6 Folha primária (em monocotiledôneas):
- Estendendo-se por menos da metade do comprimento do coleóptilo
- Ausente
- Retalhada em tiras ou deformada
- Emergindo de uma fenda na parte de baixo do coleóptilo
- Muito amarelada ou branca (não clorofilada)
- Deteriorada devido a uma infecção primária
c.7 Coleóptilo e folha primária de Zea mays:
c.7.1 Se a folha primária não emergiu no tempo de avaliação:
- O ápice do coleóptilo está danificado ou ausente
- O coleóptilo está fendido por mais de um terço a partir do ápice
- A folha primária emerge abaixo do ápice do coleóptilo
c.7.2 Se a folha primária emergiu no tempo de avaliação:
Se a folha primária tiver emergido, a plântula é considerada anormal, se o coleóptilo apresentar algum dos seguintes defeitos juntamente com danos na folha primária, como mostram as Figuras 4.1.a e 4.1.b:
- Fendido por mais de um terço do comprimento, a partir do ápice
- Fortemente curvado
- Com o ápice danificado ou ausente
- Fendido em qualquer região abaixo do ápice
- Deteriorada devido a uma infecção primária.
¶ 4.2.7 UNIDADES-SEMENTES MÚLTIPLAS
Nos testes de germinação, sementes de diversas espécies podem produzir mais de uma plântula, tais como:
a) Unidades contendo mais de uma semente verdadeira (ex.: unidades-sementes múltiplas em Dactylis, Festuca, xFestulolium e Lolium; em esquizocarpos não separados de Apiaceae (ex.: coentro – Coriandrum sativum) e em glomérulos de beterraba (Beta vulgaris); em nuculânios de espinafre-da-Nova-Zelândia (Tetragonia tetragonoides).
b) Semente verdadeira contendo mais que um embrião, como no caso de espécies poliembriônicas ou, excepcionalmente, em outras espécies com embriões gêmeos, sendo que nestas, frequentemente, uma das plântulas é fraca ou retorcida, mas, ocasionalmente, ambas são de tamanho aproximadamente normal.
c) Embriões unidos: ocasionalmente duas plântulas que estão fundidas são oriundas da mesma semente.
Nesses casos, quando uma unidade-semente múltipla produzir mais de uma plântula normal, somente uma é contada para a determinação da porcentagem de germinação.
A identidade das plântulas provenientes de uma mesma “unidade-semente múltipla”, deve ser mantida por meio de contagens e remoções periódicas das mesmas, antes que elas se separem ou, por meio de algum dispositivo, como papel plissado, que possibilite manter as unidades-sementes múltiplas separadas durante todo o teste.
Quando solicitado pelo requerente, também pode ser determinado o número de plântulas normais produzidas por cem sementes ou o número de sementes que tenham produzido uma, duas ou mais plântulas normais.
¶ 4.2.8 SEMENTES NÃO GERMINADAS
a) SEMENTES DURAS
São as sementes que apresentam aspecto de sementes recém-colocadas no substrato no final do teste, ou seja, não intumescidas, pois permanecem sem absorver água. A dureza física é uma forma de dormência motivada pela impermeabilidade do tegumento à água e é relativamente comum em determinadas espécies de Fabaceae, mas também pode ocorrer em outras famílias, como Malvaceae. Essas sementes não são capazes de absorver água nas condições estabelecidas no Quadro 4.1. Algumas sementes, como as de gimnospermas e de Brassicaceae, podem parecer duras, porque são rígidas devido a restrições físicas e fisiológicas, mas possuem tegumento permeável e absorvem água, por isso, não devem ser classificadas como duras.
Quando ocorrerem sementes duras ao final do teste, é opcional realizar tratamentos para superação da dormência (dureza). Caso não seja realizado o tratamento, deve-se reportar no Boletim de Análise de Sementes a porcentagem de sementes duras encontradas (ver subitem 4.8.1).
Quando solicitado ou a critério do laboratório, é possível retestar as sementes utilizando tratamentos para superação de dureza, conforme subitem 4.12.2 “Reteste opcional”.
b) SEMENTES DORMENTES
São sementes capazes de absorver água durante o teste, (não estão duras), mas que não germinam mesmo quando colocadas nas condições especificadas para a espécie no Quadro 4.1, pois há um bloqueio em virtude de algum tipo de dormência. Estas sementes são capazes de absorver água e intumescer, por isso há mudança de cor, formato e/ou tamanho, mas não germinam, permanecendo firmes até o final do teste, ou seja, não apodrecem durante o teste.
Nem todas as sementes aparentemente dormentes ao final do Teste de Germinação são viáveis, podendo haver entre elas sementes mortas, por isso, a viabilidade das sementes classificadas como dormentes deve ser verificada sempre que a porcentagem sementes dormentes for igual ou maior que 5% (ver subitem 4.11.c).
c) SEMENTES MORTAS
São as sementes que no final do teste não germinaram, não estão duras, nem dormentes e não apresentam nenhum sinal de início de germinação. Geralmente apresentam-se amolecidas, atacadas por micro-organismos.
Nota 6: Quando se pode observar que uma semente produziu qualquer parte de uma plântula (ex.: a extremidade de uma raiz primária), mesmo que deteriorada no momento da avaliação, é contada como plântula anormal e não como semente morta.
d) OUTRAS CATEGORIAS DE SEMENTES NÃO GERMINADAS
A pedido do requerente, sementes não germinadas também podem ser classificadas como sementes vazias, sementes sem embrião e sementes danificadas por insetos. Essas outras categorias de sementes não germinadas podem ser determinadas antes ou após o Teste de Germinação, conforme descrito no subitem que trata da avaliação do Teste de Germinação (ver subitem 4.11.c).
Se realizada, esta classificação alternativa deve ser reportada no campo de “Observações” do Boletim de Análise de Sementes.
¶ 4.3 SUBSTRATOS
Os substratos utilizados para os testes de germinação são os suportes que fornecem espaços suficientemente porosos de ar e água para o crescimento do sistema radicular e para o contato com as soluções (água) necessárias para o crescimento. Podem ser de papel, areia, mistura de compostos orgânicos com adição de partículas minerais ou combinação de papel com uma fina camada de vermiculita.
¶ 4.3.1 SUBSTRATO PAPEL
Os tipos de papel comumente utilizados como substrato são o mata-borrão, o papel “germitest” e o de filtro.
a) Especificações Gerais
- Composição: deve ser de fibra de madeira, crepado, de algodão ou de outra celulose vegetal purificada.
- Capacidade de retenção de água: o papel deve ter a capacidade de reter água suficiente para assegurar o suprimento adequado de umidade para as sementes.
- Estrutura: o papel deve ter uma estrutura aberta e porosa e ser isento de detritos ou impurezas que possam afetar as análises.
- Limpeza e inocuidade: todo papel deve estar livre de fungos, bactérias e de substâncias tóxicas que possam interferir na germinação, no crescimento ou na avaliação das plântulas. O papel não deve conter substâncias tóxicas em quantidades que possam causar danos às raízes das plântulas. Esta verificação poderá ser feita por meio de um teste biológico (4.3.1.b).
- pH: o papel umedecido com a água que será utilizada nos testes de germinação deve ter um pH entre 6,0 e 7,5, a não ser que haja evidências de que pHs fora dessa faixa não tenham efeito negativo sobre os resultados dos Testes de Germinação. O pH do papel umedecido pode ser obtido por um peagâmetro equipado com um eletrodo de superfície ou por fitas indicadoras de pH apropriadas para medição nesta faixa.
- Resistência: o papel deve ter resistência suficiente para não rasgar, quando manuseado durante o teste.
- Textura: a textura do papel deve ser suficiente para que as raízes das plântulas se desenvolvam sobre e não através do papel.
- Tamanho: o tamanho das folhas do papel devem ser o mais uniforme possível.
- Armazenamento: o papel deve ser acondicionado, preferencialmente, em ambiente arejado e com umidade relativa baixa; o pacote de papel deverá estar embalado para protegê-lo de poeira, umidade ou dano durante o transporte e armazenamento.
b) Controle de Qualidade
Teste biológico para substâncias nocivas
Antes de serem utilizados, os novos lotes de papel devem ser testados, montando-se pelo menos dois testes de germinação: um com o novo substrato a ser testado e outro com um lote de substrato de qualidade conhecida. Neste teste, são utilizadas sementes de certas espécies reconhecidamente sensíveis às substâncias tóxicas no papel, tais como: Allium cepa, Apium graveolens, Beta vulgaris, Brassica sp., Cichorium intybus, Eragrostis curvula, Festuca rubra, Hordeum vulgare subsp. vulgare, Lactuca sativa, Lepidium sativum, Petunia sp., Phaseolus vulgaris, Phleum pratense, Pisum sativum, Sesamum indicum, Solanum lycopersicum, Sorghum bicolor, Trifolium sp., Triticum aestivum subsp. aestivum e Zea mays.
O laboratório deve utilizar pelo menos uma das espécies sensíveis que estejam no seu escopo de credenciamento. Se considerar necessário, pode avaliar o substrato com mais de uma espécie. Caso nenhuma das espécies do escopo seja considerada sensível à toxidez, o laboratório pode utilizar a espécie do escopo que considerar mais adequada para o tipo de substrato em teste.
Pelo menos 400 sementes de uma espécie sensível devem ser divididas em quatro subamostras de 100 sementes que serão semeadas em quatro subamostras do substrato que está sendo testado (subamostras são retiradas de caixas ou pacotes diferentes do mesmo lote de substrato). As quatro subamostras do substrato em teste devem ser identificadas e utilizadas separadamente para que também se possa avaliar a uniformidade deste novo lote. Por exemplo, em um Teste de Germinação, os papéis de cada subamostra poderão ser utilizados para semeadura de dois rolos de germinação com 50 sementes. Paralelamente, outras 400 sementes desta mesma espécie devem ser utilizadas em um Teste de Germinação conduzido com o substrato de referência.
A avaliação desses substratos deve ser feita comparando-se o desenvolvimento das raízes das plântulas germinadas em ambos os papéis pelo menos na data prevista no Quadro 4.1 para primeira contagem, pois os sintomas de fitotoxidade são mais pronunciados nas raízes em estádio inicial de desenvolvimento. Esses sintomas são caracterizados por raízes mais curtas e, algumas vezes, extremidades radiculares escurecidas, raízes levantadas do papel e pelos absorventes aglomerados. Em Poaceae, os coleóptilos podem ser achatados e mais curtos.
Os resultados dos Testes de Germinação conduzidos com o novo substrato e com o substrato de referência devem ser comparados utilizando-se Tabelas de Tolerância ou outras ferramentas estatísticas. Se houver evidências estatísticas de que a porcentagem de plântulas normais foi menor no substrato em teste do que no substrato de referência, o substrato em teste é considerado fitotóxico e não deve ser utilizado. O substrato em teste somente será considerado uniforme se as quatro repetições de 100 sementes forem compatíveis.
Outros controles de qualidade
Durante o teste biológico, outras características do novo lote de papel, como resistência, textura, capacidade de retenção de água, pureza microbiológica e uniformidade do tamanho das folhas podem ser avaliadas.
Também se recomenda que seja determinado, preferencialmente, em cada subamostra, o pH do substrato umedecido.
¶ 4.3.2 SUBSTRATO AREIA
a) Especificações Gerais
- Composição: é recomendada a padronização da granulometria da areia, de modo que no mínimo 90% das partículas passem por uma peneira de orifício de 2 mm de malha. Recomenda-se que partículas grandes (> 5 mm) e as muito pequenas (< 0,05 mm) sejam evitadas, sendo aceitas apenas em pequena proporção.
- Limpeza e inocuidade: a areia deve estar livre de fungos, bactérias e substâncias tóxicas que possam interferir na germinação, no crescimento ou na avaliação das plântulas. A areia não deve conter substâncias tóxicas em quantidades que possam causar danos às raízes das plântulas. Esta verificação poderá ser feita por meio de um teste biológico (ver subitem 4.3.1.b);
- pH: a areia umedecida com a água a ser utilizada no Teste de Germinação deve apresentar pH entre 6,0 e 7,5. Fora dessa faixa, deve haver evidência através de teste biológico de que esse pH não influencia negativamente os resultados dos testes de germinação.
Nota 7: Para medição do pH da areia umedecida, deve-se utilizar a areia a ser avaliada misturada com cinco volumes da água normalmente utilizada nos Testes de Germinação. Agitar a mistura por 5 minutos e deixar em repouso de 2 a 24 horas. Após esse período, agitar novamente a mistura e medir o pH estabilizado da suspensão.
- Capacidade de retenção de água: quando uma quantidade apropriada de água for adicionada às partículas de areia, esta deve ter capacidade de retenção suficiente para suprir as sementes e plântulas continuamente de água. Além disso, deve permitir a aeração adequada para possibilitar a germinação e o crescimento das raízes. Instruções para obtenção da capacidade máxima de retenção encontram-se no subitem 4.7.4.
- Esterilização: a areia pode ser lavada e esterilizada antes do uso a fim de eliminar micro-organismos presentes. A esterilização é feita em autoclave a 1 atmosfera, a 120 ºC por 60 minutos ou em estufa a 200 ºC por 2 horas; ou a 120 ºC por 12 horas; ou a 105 ºC por 24 horas. Esses são os tempos mínimos recomendados para cada temperatura. Como a eficiência da esterilização depende do recipiente e do equipamento utilizado, o laboratório pode utilizar um maior tempo de esterilização para garantir que esse substrato fique livre de micro-organismos que podem interferir nos resultados dos testes de germinação.
- Reutilização: não é recomendável a reutilização de substratos. Caso seja necessário, a areia deve ser peneirada, lavada, seca e esterilizada antes da reutilização. A areia utilizada em testes com sementes tratadas quimicamente ou com alta contaminação por micro-organismos deve obrigatoriamente ser descartada.
b) Controle de Qualidade
Para assegurar que a areia esteja livre de substâncias tóxicas, deve ser feito um teste biológico semelhante ao descrito para o papel.
Também se recomenda que seja determinado, preferencialmente em cada subamostra, a granulometria, o pH do substrato umedecido e a capacidade máxima de retenção de água ou da areia.
¶ 4.3.3 ORGÂNICO
- Os substratos orgânicos são definidos como aqueles contendo os dois elementos abaixo:
- Compostos orgânicos: turfa, fibra de coco ou de madeira, com tamanho menor do que 5 mm.
- Partículas minerais: areia, perlita, dolomita ou vermiculita. A proporção deverá estar entre 15 e 30% em volume. É recomendável que 90% das partículas passem por peneira com furos ou malha de 3 mm de largura.
Nota 8: É possível utilizar qualquer outra mistura de compostos orgânicos e partículas minerais. A proporção dos componentes do substrato orgânico deve ser conhecida e ajustada aos requisitos essenciais para os substratos conforme descrito para a areia no subitem 4.3.2: limpeza e inocuidade, pH no substrato úmido, capacidade de retenção de água, esterilização e utilização. A composição do substrato deve estar claramente descrita no Boletim de Análise de Sementes.
Nota 9: A medição do pH do substrato orgânico deve utilizar a mesma metodologia descrita para a medição do pH da areia.
¶ 4.3.4 ROLO DE PAPEL + VERMICULITA
Este substrato é composto por uma combinação de “rolo de papel” com uma fina camada de vermiculita distribuída na folha de papel onde serão colocadas as sementes.
O papel a ser utilizado para montagem do rolo deve estar de acordo com os requisitos definidos no subitem 4.3.1.
A vermiculita deve atender às seguintes recomendações:
- Granulometria: pode ter granulometria média (55 a 95% das partículas > 2,4 mm) ou fina (65 a 95% das partículas > 1,2 mm).
- Limpeza e inocuidade: a vermiculita deve estar livre de sementes, fungos, bactérias ou substâncias tóxicas, que possam interferir na germinação das sementes, no crescimento e na avaliação das plântulas.
- pH: da vermiculita umedecida com a água que será utilizada nos testes de germinação deve variar entre 6,0 e 7,5, a não ser que haja evidências de que pHs fora dessa faixa não tenham efeito negativo sobre os resultados dos testes de germinação.
Nota 10: Para medição do pH da vermiculita umedecida, deve-se misturar a vermiculita com cinco volumes da água normalmente utilizada nos testes de germinação. Agitar a mistura por 5 minutos e deixar em repouso de 2 a 24 horas. Após esse período, agitar a mistura novamente e medir o pH estabilizado da suspensão.
- Capacidade de retenção de água: deve ter suficiente capacidade de retenção para suprir as sementes e plântulas continuamente de água, além disso, deve permitir a aeração adequada para possibilitar a germinação e o crescimento das raízes.
- Esterilização: pode ser feita em autoclave a 1 atmosfera, a 120 ºC por 60 minutos; ou em estufa a 200 ºC por 2 horas, ou a 120 ºC por 12 horas; ou a 105 ºC durante 24 horas (não é obrigatório esterilizar a vermiculita, é opcional).
- Reutilização: quando for utilizada para sementes tratadas, a vermiculita não poderá ser reutilizada.
¶ 4.4. ESPECIFICAÇÕES PARA A ÁGUA
a) Especificações Gerais
- Qualidade: a água usada para umedecer o substrato deve estar livre de impurezas orgânicas e inorgânicas que possam interferir no Teste de Germinação. É permitido o uso de água de torneira, água mineral e água purificada (desmineralizada ou deionizada), desde que possuam as características adequadas. Portanto, se a água da torneira não atender ao especificado, deve-se usar água mineral ou água purificada.
- pH: quando medido no substrato umedecido, o pH deve estar entre 6,0 e 7,5. Fora dessa faixa, deve haver evidência através de teste biológico de que o pH da água não influencia negativamente os resultados dos Testes de Germinação.
b) Controle de Qualidade
Recomenda-se realizar o monitoramento periódico da água para assegurar a sua qualidade, por exemplo, em relação ao seu aspecto visual, pH, condutividade elétrica (especialmente se a fonte de água for um poço artesiano), laudo emitido pela companhia de abastecimento da água, dentre outros.
¶ 4.5 EQUIPAMENTOS PARA GERMINAÇÃO
¶ 4.5.1 GERMINADORES
Embora bastante variáveis quanto ao tamanho, sistema empregado para a acomodação das amostras, dispositivos adotados para o controle de temperatura, luz, umidade relativa do ar interno e de outros detalhes, os germinadores mais usados na grande maioria dos Laboratórios de Análise de Sementes podem ser incluídos em um dos tipos a seguir descritos:
a) Germinador de câmara: germinadores deste tipo consistem, em linhas gerais, de uma câmara de paredes duplas, adequadamente isoladas por uma camada de ar ou de material isolante a fim de diminuir as variações internas de temperatura, equipados com um conjunto de bandejas ou outro de tipo de suporte, onde as amostras são colocadas para germinar.
a.1) Tipo “Mangelsdorf”: o fundo desse germinador é construído de modo a formar um depósito onde deve ser colocada a água, a qual deve ser mantida em nível adequado. Os germinadores desse tipo possuem apenas sistema de aquecimento somente podendo ser regulados à temperatura igual ou superior a do ambiente da sala em que estiver localizado. A temperatura no seu interior é controlada pelo aquecimento da água do fundo do equipamento, o que mantém umidade relativa do ar alta (geralmente acima de 90%) dentro deste tipo de germinador. A maioria não possui sistema próprio de iluminação. Como não possui sistema de resfriamento, não é o tipo de germinador mais indicado para Testes de Germinação em temperaturas alternadas, a não ser que sejam utilizados dois germinadores (ver subitem 4.7.5).
a.2) Tipo B.O.D.: para ser utilizado em testes de germinação deve manter o ambiente controlado de acordo com as condições prescritas para o Teste de Germinação da espécie em análise. Para que possam ser utilizados em testes com temperaturas alternadas, devem possuir, além de um sistema para aquecimento, um sistema de resfriamento, iluminação interna e controle de termoperíodo e fotoperíodo. Em geral, a umidade relativa dentro das B.O.D.s é baixa, sendo necessário, para evitar o ressecamento, que os substratos contendo as sementes sejam envolvidos por recipientes ou materiais resistentes a troca do vapor d’água com o ambiente, como por exemplo, sacos plásticos e caixas plásticas com tampa. Alguns modelos possuem sistema de circulação de umidade no interior da câmara, mas nem sempre essa umidade é suficiente para eliminar a necessidade de proteção contra perda de água.
b) Sala de germinação: este tipo de germinador, cujos princípios de construção e funcionamento são semelhantes aos de um germinador de câmara, é suficientemente grande para permitir a entrada de pessoas, devendo possuir sistemas de aquecimento/resfriamento para garantir que a temperatura permaneça dentro da faixa recomendada para o Teste de Germinação, independentemente das condições ambientais externas. É recomendável que possua temporizadores ou outro sistema para regular o termoperíodo e o fotoperíodo. As amostras são colocadas em prateleiras ou alternativamente sobre carrinhos ou gabinetes que são levados para dentro da sala, aí permanecendo por todo o período do teste.
Deve-se garantir que não há possibilidade de estratificação da temperatura na sala. Em salas com mais de 10 m2, é recomendado que a temperatura seja monitorada em mais de um ponto.
Os testes devem ser protegidos em recipientes à prova de umidade ou deve-se usar umidificadores para evitar o ressecamento dos substratos durante os testes.
c) Combinação de Germinadores (Sala x Câmara): outra modificação é a combinação dos germinadores de sala e de câmara. A sala é construída com isolamento térmico e a temperatura do ambiente é mantida por meio de aparelhos de ar-condicionado ou outro sistema de refrigeração, a uma temperatura constante correspondente à mais baixa normalmente usada nos Testes de Germinação. Germinadores dotados apenas de aquecimento elétrico, como os germinadores “Mangelsdorf”, são colocados nessa sala e individualmente regulados à temperatura desejada, por meio de seus termostatos.
¶ 4.5.2 CONTADORES DE SEMENTES
Dois tipos de contadores são frequentemente usados: placas perfuradas e contadores a vácuo. Sempre que possível, as sementes devem ser contadas com o uso desses contadores, pois facilita a operação em si e a distribuição ao acaso das sementes sobre o substrato.
a) Placas Perfuradas
São em geral usadas para sementes grandes, tais como: milho, feijão, ervilha, soja e outras, mas existem placas com orifícios apropriados para sementes menores, como as de sorgo.
O tamanho da placa aproxima-se ao do substrato (papel) a ser usado e sua parte superior consiste em uma superfície contendo 25, 50 ou 100 orifícios de tamanho e forma semelhantes ao das sementes a serem contadas. A parte superior movimenta-se no sentido horizontal. Acoplada sob essa placa, uma outra fixa e menos espessa serve de fundo falso com orifícios paralelos aos da placa superior.
As sementes são distribuídas sobre a placa superior. Em seguida, retira-se o excesso de sementes inclinando-se a placa. Após verificar que cada orifício da contêm apenas uma semente, a placa é colocada sobre o substrato e sua parte superior da placa é puxada no sentido horizontal (para haver a coincidência dos orifícios dela com os orifícios da parte inferior da placa) e as sementes caem uniformemente espaçadas no substrato.

FIGURA 4.2: Exemplo de um contador de placas perfuradas ("Tabuleiro Contador")
b) Contadores a Vácuo
São aparelhos usados principalmente para sementes de espécies que possuem forma regular e são relativamente lisas, como as de cereais, de Brassica e de Trifolium.
Um contador a vácuo contém três partes essenciais: um sistema de vácuo; um conjunto de placas ou chapas para contagem adequada dos tipos de sementes serem testadas e ao tamanho dos substratos de germinação; e uma válvula de controle de vácuo.
As placas, contendo geralmente 50 ou 100 orifícios, devem ser ligeiramente menores do que o substrato e providas de bordas para impedir que as sementes rolem para fora das mesmas. O diâmetro dos orifícios deve estar em correspondência com o tamanho da semente e com o vácuo aplicado.
As sementes são despejadas, uniformemente, sobre a placa contadora com o vácuo desligado. O vácuo é então aplicado, o excesso de sementes é removido. Verifica-se se todos os orifícios estão preenchidos com apenas uma semente. Em seguida, a placa é colocada sobre o substrato de germinação e o vácuo é interrompido a fim de que as sementes caiam por gravidade, bem distribuídas sobre o mesmo.
Devem ser tomadas precauções, para que não haja seleção de sementes causando variação entre as repetições. Por exemplo, não se deve mergulhar a placa na massa de sementes, ou aplicar o vácuo quando as sementes estiverem sendo distribuídas sobre a placa, pois estes procedimentos selecionam as mais leves.
¶ 4.5.3 LUPA DE MESA E MICROSCÓPIO ESTEREOSCÓPICO
O laboratório deve dispor e utilizar, quando necessário, microscópio estereoscópico e lupa de mesa com aumento mínimo de 4x.
¶ 4.6 CONDIÇÕES SANITÁRIAS DE MATERIAIS E EQUIPAMENTOS
Os substratos e todos os utensílios usados nos Testes de Germinação devem ser conservados limpos para evitar contaminação. Os substratos devem ser guardados em local seco, arejado e protegido de pó. Utensílios como caixas plásticas, placas de Petri, recipientes de alumínio e de plástico usados para testes de areia, grades e bandejas de germinadores devem ser cuidadosamente lavados com água e sabão neutro, e secados adequadamente.
Os germinadores merecem especial atenção, devendo ser lavados com água e sabão neutro e desinfetados periodicamente. A desinfestação pode ser feita com álcool a 70% e “Lysoform” ou similares, cada um deles empregado na dosagem recomendada na embalagem.
É recomendável que a assepsia seja efetuada logo após o uso, ocasião em que também se procede à substituição da água mantida no fundo do germinador “Mangelsdorf”.
¶ 4.7 PROCEDIMENTO
As sementes são testadas em repetições e em condições favoráveis de umidade, seguindo-se os procedimentos previstos nestas RAS.
O tipo de substrato, a temperatura, a duração do teste, as exigências quanto à luminosidade e outras instruções adicionais estão indicados para cada espécie no Quadro 4.1. Procedimentos prescritos para promover a germinação no subitem 4.8 também podem ser utilizados.
Quando forem indicados métodos alternativos, qualquer um deles pode ser usado. A escolha dependerá da experiência técnica, da disponibilidade de equipamentos, das condições dos laboratórios e, até certo ponto, da procedência e condição da amostra. Testes em paralelo são permitidos. Caso a amostra não responda satisfatoriamente ao método escolhido é necessário repetir o teste, usando-se outros métodos alternativos.
Após o período indicado no Quadro 4.1, as repetições são avaliadas e é feita a contagem de plântulas e sementes das várias categorias requeridas para a informação de resultado (subitem 4.11), conforme definições dos itens 4.2.3 a 4.2.8.
¶ 4.7.1 AMOSTRA DE TRABALHO
As sementes a serem utilizadas nos testes de germinação devem ser tomadas ao acaso da porção “Semente Pura”, exceto quando for prescrito o Teste de Sementes por Repetições Pesadas, pois para esse tipo de semente não se realiza a Análise de Pureza e, portanto, não há a porção “Semente Pura”.
Deve-se aplicar a Definição de Semente Pura de cada espécie. A semente pura pode ser retirada tanto da fração semente pura da Análise de Pureza executada, conforme definido no Capítulo 2 “Análise de Pureza”, como de uma fração representativa da amostra média. Quando as sementes forem revestidas, deve-se utilizar a definição de pelota pura, exceto nos casos de fitas ou lâminas em que as sementes são testadas sem remoção do material das fitas ou lâminas.
Não deve haver seleção de sementes para não causar resultados tendenciosos. Da porção “Semente Pura”, depois de homogeneizada, são retiradas ao acaso 400 sementes em repetições de 4 de 100, 8 de 50 ou 16 de 25 sementes. As sementes restantes da porção “Semente Pura” fazem parte da amostra de arquivo e devem ser devidamente identificadas e conservadas no arquivo de amostras pelo menos até o vencimento da validade do Teste de Germinação.
“Unidades-Sementes Múltiplas”, exceto para amendoim (Arachis hypogaea), não são separadas para o Teste de Germinação, sendo testadas como se fossem sementes individuais.
Para Arachis hypogaea, embora a vagem (fruto) seja uma unidade-semente múltipla pura, quando as sementes estiverem dentro da vagem devem ser removidas antes de serem utilizadas em um Teste de Germinação.
Para algumas espécies, como Chloris gayana, a análise da germinação pode, alternativamente, ser realizada de acordo com o peso das repetições indicado no Quadro 4.1 e com o prescrito no Capítulo 12 “Testes de Sementes por Repetições Pesadas” destas RAS.
Quando a legislação exigir a realização apenas do Teste de Germinação, por exemplo, no caso de revalidação de um Teste de Germinação, as sementes devem ser retiradas ao acaso da porção “Semente Pura” que foi obtida de uma amostra de trabalho, com peso equivalente a no mínimo metade da quantidade indicada para a amostra de trabalho para Análise de Pureza da espécie no Quadro 1.5.
Nota 11: As sementes não devem sofrer nenhum pré-tratamento no laboratório, a não ser aqueles indicados nestas RAS, para não alterar a representatividade da amostra em relação ao lote original.
¶ 4.7.2 ESPAÇAMENTO DE SEMEADURA
As sementes devem ser colocadas no substrato com espaçamento uniforme e suficiente para minimizar a competição e contaminação entre as sementes e plântulas em desenvolvimento.
Embora a semeadura de quatro repetições de 100 sementes seja a mais utilizada, às vezes, é conveniente usar repetições com 50 ou 25 sementes para que elas fiquem mais espaçadas a fim de minimizar o efeito das sementes adjacentes no desenvolvimento das plântulas. Maiores espaçamentos são recomendados para sementes grandes ou quando aumentam muito de tamanho durante o teste ou são portadoras de micro-organismos O tamanho e a rapidez do desenvolvimento das plântulas também devem ser considerados. Um espaçamento entre as sementes de 1,5 a 5,0 vezes a sua largura ou diâmetro, é o ideal.
¶ 4.7.3 ESCOLHA DO SUBSTRATO E DA FORMA DE MONTAGEM
Na escolha do substrato, devem ser levados em consideração o tamanho da semente, sua exigência com relação à quantidade de água, sua sensibilidade à luz, a ocorrência de fungos, a facilidade que o substrato oferece para a realização das contagens e para a avaliação das plântulas.
Os tipos de substratos mais utilizados nos testes de germinação em laboratório são o papel e a areia. No Quadro 4.1, acham-se indicados quais desses substratos são recomendados para cada espécie, bem como, de que forma devem ser empregados.
a) Métodos usando o substrato “Papel”
Os tipos de papel mais comumente utilizados como substrato são o mata-borrão, o “germitest” e o de filtro. No subitem 4.3.1, são dadas recomendações das características desses papéis e a instruções relativas aos testes biológicos para verificação da fitotoxidade do substrato.
a.1 Entre Papel (EP)
As sementes são colocadas para germinar entre duas ou mais folhas de papel, usando-se uma das seguintes formas de montagem:
- Cobrindo frouxamente as sementes com uma camada adicional de papel. Este método é o mais recomendado para as sementes pequenas que preferem ambientes úmidos e que não são exigentes em luz para germinar.
- Colocando as sementes em envelopes de papel dobrados, que podem ser posicionados na vertical ou na horizontal dentro dos germinadores.
- Colocando as sementes para germinar entre duas ou mais folhas de papel “germitest”, embrulhados em forma de rolos e depois colocados no germinador na posição vertical. Esta forma de montagem é conhecida como rolo de papel (RP). Este método é o mais recomendado para as sementes que não são exigentes em luz para germinar e que não são muito pequenas (sementes das grandes culturas, das leguminosas forrageiras, sementes de algumas gramíneas forrageiras e de algumas de hortaliças).
a.2 Sobre Papel (SP)
As sementes são colocadas para germinar sobre duas ou mais folhas de papel que podem ser colocadas diretamente nas bandejas do germinador, em placas de Petri ou caixas de plástico incolor e transparente. A quantidade de água apropriada (ver subitem 4.7.4) deve ser adicionada no início do teste e a evaporação pode ser minimizada por uma tampa justa ou colocando as placas ou caixas em sacos plásticos. Este método é o mais recomendado para as sementes pequenas e que exigem luz para germinar.
a.3 Papel plissado (PP)
As sementes são colocadas para germinar entre folhas de papel plissado, em formato de uma sanfona (pode ser adquirido desta forma ou feito de folhas de papel “germitest” dobradas). Usualmente, são cinco canaletas, com cinco sementes por canaleta. As folhas plissadas são colocadas em caixas, ou diretamente na bandeja do germinador, com uma folha lisa geralmente ao redor do papel plissado para assegurar condições uniformes de umidade. Os recipientes podem ser posicionados na horizontal, inclinados ou na vertical. Mesmo quando não estiver previsto no Quadro 4.1, este método pode ser usado como uma alternativa onde os métodos SP (sobre papel) ou EP (entre papel) forem prescritos. Este sistema é o mais recomendado para “Unidades-Sementes Múltiplas” de Beta vulgaris, Tetragonia tetragonoides, Coriandrum sativum e sementes pelotizadas.
b) Métodos usando “Areia” ou “Substrato Orgânico”:
Recomendações sobre as especificações deste material são dadas nos subitens 4.3.2 e 4.3.3:
A areia e o substrato orgânico podem ser usados no lugar do papel mesmo se não forem indicados no Quadro 4.1, desde que estes testes sejam conduzidos em uma das temperaturas prescritas para a espécie em análise no Quadro 4.1.
Os substratos areia e o orgânico são particularmente indicados para:
- Confirmar a avaliação de plântulas em caso de dúvidas.
- Quando houver suspeita de ocorrência de toxidez ou foram observados sintomas fitotóxicos.
- Quando a avaliação de uma amostra for difícil de ser realizada por excesso de infecção.
b.1) Entre Areia (EA) ou Entre Substrato Orgânico (EO)
As sementes são colocadas sobre uma camada uniforme de substrato umedecido e cobertas com substrato solto, sem pressionar, de forma a obter uma camada de 1 a 5 cm sobre as sementes, dependendo do tamanho das sementes e plântulas. Para assegurar uma boa aeração e distribuição uniforme da umidade, é recomendável que o substrato seja revirado e afofado com um pequeno ancinho antes de proceder a semeadura.
b.2) Sobre Areia (SA) ou Sobre Substrato Orgânico (SO)
As sementes são colocadas sobre uma camada uniforme de substrato não compactado, umedecido e levemente comprimidas contra a superfície do mesmo.
c) Método empregando Rolo de Papel e Vermiculita (RP + V)
Este método pode ser utilizado apenas quando for indicado para a espécie e as com as condições do teste prescritas no Quadro 4.1. As recomendações para as características do papel encontram-se no subitem 4.3.1 e para a vermiculita no subitem 4.3.4.
O método Rolo de Papel + Vermiculita (RP + V) consiste em usar rolos de papel “germitest” com 50 sementes (8 rolos de 50 sementes para um Teste de Germinação completo), umedecidos com água igual a 3x o peso do papel seco.
Sobre as duas folhas do papel já molhado, uma camada fina e uniforme de vermiculita umedecida (proporção de 1 g de vermiculita: 1 mL de água) é adicionada e distribuída na quantidade de 100 mL por rolo. A seguir, as 50 sementes de cada rolo são distribuídas com o auxílio de um contador de sementes, cobrindo-se o conjunto com outra folha de papel umedecido e, por fim, os rolos são fechados como normalmente é feito em testes de germinação com rolo de papel.
Alternativamente, é permitido que as sementes sejam distribuídas com o contador sobre o papel molhado antes da adição da vermiculita, cuja distribuição será feita após a distribuição das sementes sobre o papel molhado. Após a adição da vermiculita, faz-se a colocação da folha de papel superior e o fechamento do rolo, como normalmente é feito para rolos de papel.
¶ 4.7.4 UMIDADE E AERAÇÃO
O fornecimento de água é condição essencial para que a semente inicie a germinação e se desenvolva normalmente. A umidade suficiente para a germinação e o bom desenvolvimento depende da espécie testada. Cucurbita spp., sorgo e cevada são exemplos de espécies sensíveis ao excesso de umidade no substrato, bem como espécies de sementes muito pequenas, tais como fumo e begônia. Outras espécies como o milho e feijão requerem substratos saturados para uma germinação adequada.
O substrato deve estar, durante todo o teste, suficientemente úmido a fim de dar às sementes a quantidade de água necessária para sua germinação. O substrato, especialmente o de papel, não deve estar tão umedecido a ponto de formar uma película de água em torno das sementes, já que este excesso restringe a aeração prejudicando a germinação.
Dependendo da espécie, o excesso de umidade pode provocar dormência secundária e até morte de sementes no Teste de Germinação. Por outro lado, uma umidade abaixo da requerida também prejudica os resultados do Teste de Germinação, pois sementes viáveis podem não germinar ou as plântulas não se desenvolvem adequadamente.
Testes em temperaturas ≤ 20 °C e em temperaturas alternadas geralmente requerem menor umidade do que os com temperaturas constantes maiores ou iguais a 25 °C. Dentro das temperaturas constantes, quanto maior a temperatura, na maioria dos casos, maior umidade é necessária.
Sementes pequenas ou com formato achatado são geralmente mais sensíveis ao excesso de umidade. Sementes que possuem dormência relacionada à restrição a troca de gases (como as de Urochloa spp.), com alto conteúdo lipídico ou que produzem mucilagem geralmente precisam de substratos menos úmidos. Sementes grandes e revestidas normalmente exigem mais umidade.
Os substratos devem ser umedecidos o mais uniformemente possível. Precauções devem ser tomadas para assegurar que o substrato não resseque e que contenha água suficiente para toda a duração do teste. A fim de evitar a perda de água por evaporação, a amostra deve ser mantida em ambiente com alta umidade, ou ainda, se mantendo os Testes de Germinação em recipientes fechados, como por exemplo sacos ou caixas plásticas.
Deve-se evitar, sempre que possível, o umedecimento posterior dos testes, já que isto pode aumentar a variabilidade entre as repetições e entre os testes. Contudo, especialmente os testes com duração maior que 10 dias, pode ser necessária a adição de água nas contagens intermediárias.
Em geral, medidas especiais para a aeração não são necessárias para testes SP e PP conduzidos em caixas plásticas, gerbox ou em placas de Petri.
Entretanto, para testes EP, deve-se tomar cuidado para que os envelopes ou os rolos de papel fiquem suficientemente frouxos para permitir a aeração necessária em torno das sementes. Esses mesmos cuidados devem ser tomados para testes em RP + V.
Pela mesma razão, areia e substratos orgânicos não devem ser comprimidos e a camada que cobre as sementes não deve ser muito espessa.
Cálculo da quantidade de água para os substratos
- Substrato de papel: para que se calcule a quantidade de água a ser adicionada é conveniente utilizar a relação volume de água (mL) por peso do substrato (g). Para a maioria das sementes, geralmente é utilizado um volume de água de 2,0 a 3,0 vezes o peso do papel. Nem sempre a quantidade média de 2,5 vezes o peso do papel é a ideal. O laboratório pode determinar a quantidade de água considerando as características do papel, da espécie, a temperatura e as condições do ensaio (equipamento, forma de proteção contra perda de umidade), podendo essa quantidade ficar fora da faixa citada anteriormente. A quantidade de água a ser utilizada depende da capacidade máxima de retenção do substrato, por isso pode variar de acordo com o lote de papel que será utilizado. A capacidade máxima de retenção do papel pode ser calculada, quando necessário.
- Substrato Areia ou Substrato Orgânico: a quantidade ótima de água a ser adicionada depende da granulometria da areia (ou da composição do substrato orgânico), das características da semente a ser semeada, da temperatura e das condições de condução do teste. Recomenda-se que seja determinada previamente para que seja usada a mesma quantidade padronizada nos testes de rotina do laboratório. Geralmente, nos Testes de Germinação da maioria das sementes, a quantidade de água utilizada para umedecer o substrato é a equivalente a 45-50% de sua capacidade máxima de retenção. Sementes grandes de Fabaceae e sementes de milho, exigem mais água para germinar, nesse caso, então, se o laboratório considerar adequado, a areia pode ser umedecida entre 55-60% dessa capacidade.
O cálculo da quantidade de água a ser adicionada quando se utiliza areia ou substrato orgânico pode ser efetuado como se segue:
- Pesar 500 g desse material seco, que deverá ser colocado em um filtro de papel (tipo coador de café comercial). Dependendo da densidade do substrato, a quantidade testada poderá ser ajustada.
- Adicionar uma quantidade de água previamente determinada.
- Quando o excesso de água tiver sido drenado, medir o volume de água e calcular, por diferença, a quantidade de água que ficou retida no substrato.
Nota 12: Estima-se que o tempo mínimo para a drenagem da água é de 30 minutos, podendo durar mais, dependendo da granulometria do substrato e do filtro de papel.
Nota 13: O cálculo da capacidade máxima de retenção da areia ou do substrato orgânico pode ser realizado apenas uma vez, quando da avaliação de um novo lote de substrato antes de ser colocado em uso, utilizando-se a média da capacidade máxima obtida em cada subamostra do substrato.

¶ 4.7.5 TEMPERATURA
As temperaturas indicadas no Quadro 4.1 foram determinadas pela pesquisa para cada espécie e são aquelas a que as sementes devem ser expostas dentro ou sobre os substratos. Quando temperaturas alternadas forem indicadas, a temperatura mais baixa deve ser mantida durante 16 horas, período noturno, e a mais alta por oito horas, período diurno.
As temperaturas devem permanecer tão uniformes quanto for possível no interior dos germinadores, câmaras ou salas de germinação. Para qualquer teste realizado na ausência de luz ou com luz solar indireta ou com luz artificial, a variação da temperatura prescrita não deve ser maior do que ± 2 ºC. Quando a temperatura do teste for constante, essa variação é a máxima permitida a cada período de 24 horas.
Para sementes não dormentes, uma mudança gradual de temperatura que leva três horas é considerada satisfatória. Já para sementes dormentes, é necessária uma mudança mais rápida de temperatura e que não exceda uma hora. Caso o germinador não mude rapidamente a temperatura, é primordial a imediata remoção das sementes para outro germinador, previamente regulado à temperatura desejada. Testes de germinação em temperaturas alternadas devem ser conduzidos, preferencialmente, em germinadores que possuem sistemas de resfriamento, a exemplo das B.O.D.s.
Na coluna referente à temperatura do Quadro 4.1, um número isolado significa que a temperatura é constante e dois números separados por um traço significa que essas temperaturas são alternadas.
Em tratamentos das sementes, as temperaturas prescritas são aquelas a que as sementes devem ser expostas dentro ou sobre o substrato, também neste caso, a variação da temperatura prescrita no Quadro 4.1 não pode ser maior que ± 2 ºC. Quando for alternada, não deve ser maior que ± 2 ºC em cada período. As temperaturas devem ser monitoradas por termômetros anualmente calibrados ou checados/verificados. Nas checagens/verificações, o termômetro de referência utilizado deve ter calibração RBC (Rede Brasileira de Calibração) e essa calibração deve estar em conformidade com os critérios de aceitação estabelecidos pelo laboratório solicitante.
Quando for definida uma faixa de temperaturas, nenhuma tolerância poderá ser aplicada nas temperaturas mais alta e mais baixa. Por exemplo, quando for prescrita uma temperatura de pré-resfriamento de 5 a 10 °C, a amplitude será de 5 a 10 °C e não de 5 ± 2 °C a 10 ± 2 °C.
¶ 4.7.6 LUZ
Sementes da maioria das espécies germinam tanto na presença de luz como no escuro. Mesmo quando a luz não for indicada, a iluminação durante o teste, seja de fonte natural ou artificial, geralmente, é recomendada a fim de favorecer o desenvolvimento das estruturas essenciais das plântulas, facilitando, assim, a avaliação e reduzindo a possibilidade de ataque de microrganismos. Plântulas que crescem em condições de completa escuridão ficam estioladas (finas e alongadas) e hialinas (transparentes) e, muitas vezes, mais sensíveis ao ataque de microrganismos. Além disso, certos defeitos como a deficiência de clorofila não podem ser detectados.
Em certos casos, a luz pode promover a germinação de sementes dormentes (ver subitem 4.8.2.c), como em algumas gramíneas forrageiras tropicais e subtropicais. Dependendo da espécie, a exigência em luz pode variar com o lote/cultivar, podendo ser determinante apenas em testes de germinação de sementes recém-colhidas. Sementes pré-tratadas antes de serem comercializadas (por exemplo, submetidas a priming), podem se tornar menos exigentes em luz que o normal da espécie.
Há também algumas poucas espécies, como Phacelia tanacetifolia, que germinam no escuro e para as quais a presença de luz pode inibir a germinação (ver subitem 4.8.2.1). A presença de luz pode tornar a germinação de sementes de mamona (Ricinus communis) mais lenta e até mesmo inibir a germinação de alguns lotes. De forma similar, alguns lotes de sementes de maracujá-amarelo (Passiflora edulis), maxixe (Cucumis anguria) e, raramente, de cebola (Allium cepa) só expressam a germinação máxima em testes conduzidos no escuro.
A luz, quando indicada, deve ser bem distribuída por toda a superfície do substrato. Pode ser obtida de lâmpadas fluorescentes ou de LED que forneçam entre 3.000 K (branco neutro) e 4.000 K (branco frio), podendo chegar a 6.500 K (luz branca azulada, é geralmente o tipo de lâmpada LED disponível em BODs comercializadas no Brasil), sem afetar a germinação. Para algumas espécies de sementes, a luz fluorescente ou de LED promove a germinação mais efetivamente do que a luz solar ou proveniente de filamentos incandescentes que contêm radiação infravermelha, inibidora de germinação.
As sementes para as quais a luz for indicada devem ser iluminadas durante, no mínimo, oito horas a cada ciclo de 24 horas e devem ser colocadas para germinar sobre o substrato para evitar qualquer filtração diferencial da luz antes que esta alcance as sementes. Quando o teste for efetuado em temperaturas alternadas, essa iluminação deve ser proporcionada durante o período de temperatura alta.
Recomendações específicas para a luz encontram-se na última coluna do Quadro 4.1.
¶ 4.8 TRATAMENTOS PARA PROMOVER A GERMINAÇÃO
Os tratamentos para promover a germinação incluem métodos para superação de diversos tipos de dormência, para evitar danos por embebição e para desinfestação das sementes (quando esta for permitida).
Por várias razões (ex.: dormência fisiológica, dormência física ou substâncias inibidoras), um número considerável de sementes duras ou dormentes podem permanecer sem germinar no final do teste. A pedido do requerente ou a critério do laboratório, uma germinação mais completa pode ser obtida realizando-se novo(s) teste(s) com um tratamento ou uma combinação de tratamentos. Se existe a suspeita de dormência, estes tratamentos também podem ser realizados no primeiro Teste de Germinação.
Os tratamentos recomendados para superação de dormência encontram-se na última coluna do Quadro 4.1. Quando necessário, estes e todos os outros tratamentos dos subitens 4.8.1 e 4.8.2 também podem ser usados sem restrição para qualquer espécie. O período de pré-tratamento não está incluído na duração do Teste de Germinação. O pré-tratamento e sua respectiva duração devem ser informados no Boletim de Análise de Sementes no campo “Tratamento Especial”.
No Quadro 4.1, é recomendado o tratamento para evitar danos por embebição rápida (subitem 4.8.3) para determinadas espécies, mas também pode ser aplicado para amostras de outras espécies quando houver suspeita ou evidências de que essas sementes podem sofrer esse tipo de dano nos Testes de Germinação.
O subitem 4.8.4 informa quando pode ser realizada a desinfestação das sementes antes da montagem do Teste de Germinação. Há também instruções de como proceder a essa desinfestação.
¶ 4.8.1 MÉTODOS PARA SUPERAR DORMÊNCIA FÍSICA
Pode ser que em alguns lotes de sementes de determinadas espécies, a porcentagem de germinação seja muito baixa ou praticamente nula se nenhum tratamento para superação de dormência física for realizado. Para outras espécies/lotes, apenas uma certa quantidade de sementes da amostra apresenta impermeabilidade do tegumento (sementes duras). Abaixo estão descritos alguns tratamentos específicos que podem ser usados para se obter a germinação máxima do lote de sementes. As formas de lidar com a ocorrência de dormência física estão descritas no subitem 4.8.1.1.
a) Imersão em água
Sementes com tegumento duro podem germinar mais rapidamente após imersão em água, por um período de 24 a 48 horas. O Teste de Germinação deve ser iniciado imediatamente após o período de imersão.
b) Escarificação Mecânica
Para superar a condição de dormência física de sementes, os seguintes tipos de escarificação mecânica podem ser suficientes: perfuração cuidadosa do tegumento; remoção de uma lasca do invólucro; uso de lima ou de lixa de papel no tegumento da semente.
Para evitar danos ao embrião, deve-se tomar bastante cuidado ao escarificar o tegumento, realizando essa escarificação na parte oposta à do eixo do embrião. Os melhores locais são aqueles imediatamente acima das extremidades dos cotilédones ou nas suas laterais. Esse tratamento geralmente é mais efetivo para sementes do gênero Macrotyloma e de Canna indica.
c) Escarificação Química
O tratamento com ácido sulfúrico concentrado (H2S04) é indicado para superar a dormência das unidades de dispersão (sementes, núculas, aquênios, antécios férteis, cariopses etc.) de algumas espécies. Esse procedimento é efetivo para algumas espécies de leguminosas, a exemplo de Desmodium spp. e Macroptilium spp. As unidades de dispersão são colocadas no ácido até a escarificação dos envoltórios e o tempo máximo de permanência no ácido para algumas espécies está indicado no Quadro 4.1. Dependendo do lote, um período menor de tratamento pode ser usado.
Quando houver dúvidas sobre o tempo a ser utilizado ou não houver tempo definido no Quadro 4.1, o tratamento com ácido sulfúrico pode ser realizado, desde que as sementes sejam examinadas periodicamente, após poucos minutos, até que se observe que o envoltório da unidade de dispersão se tornou poroso. A escarificação pode ser rápida ou pode levar até mais de uma hora, dependendo da espécie / lote / cultivar e da condição das sementes do lote.
Para este método, devem ser contadas 400 sementes, ao acaso, da porção “Semente Pura” e colocadas em um béquer ou outro recipiente não corrosível, cobrindo-as com uma quantidade suficiente de ácido sulfúrico concentrado e mexendo-se frequentemente com um bastonete de vidro. Após o período definido para a espécie, despejar o conteúdo do béquer em um outro recipiente de vidro contendo um litro de água, agitando com um bastonete. Verter o conteúdo em uma peneira plástica de malha fina, que não permita a passagem da semente, lavando em água corrente até eliminar completamente os resíduos do ácido. Antes de proceder a semeadura, colocam-se as sementes, em temperatura ambiente, sobre folhas de papel absorvente para secagem da água superficial. Esta secagem facilita a semeadura e, geralmente, possibilita uma condição mais favorável no Teste de Germinação.
¶ 4.8.1.1 Formas de lidar com a dormência física (sementes duras)
Há diversas formas de lidar com a dormência física. A escolha depende da espécie em análise, do histórico do lote, da experiência do laboratório e do interesse do requerente. Em qualquer um dos casos, as sementes deverão ser retiradas da fração “Semente Pura”:
a) Para espécies em que o laboratório tenha conhecimento de que na maioria dos lotes ocorre alta porcentagem de sementes duras, o laboratório pode, primeiramente, montar um ou mais testes de germinação após o(s) tratamento(s) para superar a dureza das sementes da espécie descritos no Quadro 4.1, podendo ser outro tratamento descrito acima. Também é possível fazer uma combinação de tratamentos. Caso, ao final do teste, haja suspeita de que o tratamento não era necessário e que o(s) tratamento(s) pode(m) ter provocado danos nas sementes, um novo Teste de Germinação, com sementes não tratadas deve ser realizado. Outros testes com variações de tratamentos menos agressivos também podem ser realizados (por exemplo, com menor tempo de uso do ácido sulfúrico ou de embebição ou, ainda, uma escarificação mecânica menos profunda).
Nota 14: Alguns lotes de sementes de espécies que geralmente têm sementes duras podem ter as sementes escarificadas antes de serem comercializadas e, nesse caso, então, não precisam ser tratadas antes do Teste de Germinação. Por exemplo, podem ser encontradas no mercado sementes de Canna indica escarificadas por luz laser.
b) Quando houver suspeita de ocorrência deste tipo de dormência no lote em análise, o laboratório poderá realizar um ou mais testes usando os tratamentos específicos para superar a dureza das sementes da espécie descritos Quadro 4.1 ou outro tratamento descrito no subitem 4.8.1. Pode ser feita uma combinação de tratamentos. Nessa situação, é aconselhável que este(s) teste(s) seja(m) conduzido(s) em paralelo com um Teste de Germinação sem superação de dormência das sementes, especialmente se o período do teste for longo. Outra possibilidade é, se ao final do teste houver suspeita de que o(s) tratamento(s) foram prejudiciais às sementes, um novo Teste de Germinação, com sementes não tratadas deve ser realizado. Outros testes com variações de tratamentos menos agressivos também podem ser realizados.
c) Quando, ao final do Teste de Germinação realizado sem superação de dormência física, se verificar a presença significativa de sementes duras, o laboratório poderá realizar o tratamento de superação de dormência nessas sementes duras ao final do período prescrito para o teste. Outra possibilidade é realizar outros testes (um ou mais testes) usando pré-tratamento(s) específico(s) para superar a dureza das sementes da espécie descritos no Quadro 4.1 ou outro tratamento descrito no subitem 4.8.1. Quando houver alguma suspeita de que o tratamento pode afetar negativamente as sementes não duras, deve ser executado apenas nas sementes duras remanescentes após o período prescrito para o teste.
Nota 15: Os danos às sementes são mais comuns quando é utilizada a escarificação química com ácido sulfúrico, mas podem ocorrer também com outros métodos de superação de dureza descritos no Quadro 4.1 ou no subitem 4.8.1.
Em qualquer dos casos acima, o maior resultado dos testes de germinação realizados deve ser informado nos campos destinados aos resultados de germinação do Boletim de Análise de Sementes, devendo-se informar, também, o tratamento especial utilizado. Resultados de outros testes válidos podem ser informados no campo “Observações” dos Boletim de Análise de Sementes.
¶ 4.8.2 MÉTODOS PARA SUPERAR A DORMÊNCIA FISIOLÓGICA E OUTROS TIPOS
A possibilidade de dormência pode ser ou não ser conhecida antes da realização do Teste de Germinação. Para muitas espécies que apresentam sementes não germinadas devido à dormência fisiológica e outras causas, é possível não aplicar procedimentos de superação de dormência antes do Teste de Germinação. Nesse caso, após a conclusão do Teste de Germinação, a porcentagem de sementes dormentes encontrada deve ser reportada.
Em outros casos, quando for exigida uma avaliação mais completa da germinação pelo laboratório, ou a pedido do requerente, é possível realizar um novo teste utilizando algum procedimento para superação de dormência descrito nestas RAS, conforme detalhado abaixo.
Quando houver suspeita de dormência antes da realização do Teste de Germinação inicial, é possível aplicar procedimentos para superação de dormência antes da realização do primeiro teste.
Como são várias as causas que determinam a dormência, diversos métodos podem ser empregados nos laboratórios para possibilitar a germinação dessas sementes. Alguns métodos são recomendados no Quadro 4.1, porém qualquer outro método descrito neste subitem 4.8.2 também pode ser utilizado, em um ou mais testes, podendo ser realizada uma combinação de tratamentos.
A escolha depende da espécie em análise, do histórico do lote, da experiência do laboratório e do interesse do requerente. Em qualquer um dos casos, as sementes deverão ser retiradas da fração “Semente Pura”:
O laboratório pode escolher como lidar com a dormência, dependendo da espécie e do histórico do lote, à semelhança das opções listadas no subitem 4.8.1.1. Os Testes de Germinação com tratamento para superação de dormência podem ser realizados antes, em paralelo ou após o primeiro Teste de Germinação sem tratamento das sementes.
Em qualquer dos casos acima, o maior resultado dos Testes de Germinação realizados deve ser informado nos campos destinados aos resultados de germinação do Boletim de Análise de Sementes, devendo-se informar, também, o tratamento especial utilizado. Resultados de outros testes válidos podem ser informados no campo “Observações” dos Boletins de Análise de Sementes.
Nota 16: À exceção do tratamento com ácido sulfúrico, os tratamentos para superação de dormência fisiológica ou causada por substâncias inibidoras, geralmente, são menos agressivos, mas, mesmo assim, em alguns casos, podem provocar danos às sementes, principalmente em sementes menos vigorosas.
a) Pré-esfriamento
Sementes de algumas espécies agrícolas, forrageiras temperadas, florestais, hortaliças, ornamentais, condimentares e medicinais são colocadas no substrato umedecido, como no teste regular de germinação, e levadas a uma temperatura entre 5 e 10 ºC, em que permanecem conforme a indicação do Quadro 4.1. Após esse período, as sementes são transferidas para o germinador à temperatura indicada para a espécie em análise, iniciando-se, então, o Teste de Germinação propriamente dito. Em alguns casos, pode ser necessário reumedecer o substrato e estender o período de pré-esfriamento ou repeti-lo.
Para as espécies que requerem um longo período de pré-esfriamento e quando o Teste de Germinação não puder ser concluído dentro de dois meses, são recomendados testes rápidos de viabilidade, como o Teste de Tetrazólio (Capítulo 5 destas RAS).
b) Pré-aquecimento
As sementes secas das repetições do Teste de Germinação são aquecidas a uma temperatura entre 30 e 35 °C com circulação livre de ar por um período de até 7 dias antes de serem colocadas sob as condições prescritas para germinação. Em alguns casos, pode ser necessário estender o período de pré-aquecimento.
Para certas espécies tropicais e subtropicais, temperaturas de pré-aquecimento entre 40 e 50 °C podem ser usadas (ex.: Arachis hypogaea: 40 °C e Oryza sativa: 50 °C). Para algumas espécies, as condições do método para superar a dormência por pré-aquecimento, constam no Quadro 4.1. O uso em outras espécies deve seguir as condições gerais descritas acima.
c) Luz
Nas sementes que exigem a presença da luz e condições de temperaturas alternadas, os Testes de Germinação devem ser iluminados pelo menos por oito horas a cada ciclo de 24 horas, no período da temperatura mais alta. O uso de luz constante em Testes de Germinação com temperatura constante geralmente favorece a germinação.
A qualidade e a intensidade da luz podem ser importantes. A luz pode ser originada de lâmpadas fluorescentes ou de LED que forneçam entre 3.000 K (branco neutro) e 4.000 K (branco frio), podendo chegar a 6.500 K.
A iluminação é recomendada, principalmente, para algumas espécies de gramíneas forrageiras tropicais e subtropicais, como Chloris gayana, Cynodon dactylon e Lolium spp. Sementes muito pequenas, geralmente, são mais exigentes em luz e intensidade luminosa. Por exemplo, a intensidade luminosa deve ser alta em Testes de Germinação de Nicotiana tabacum. De forma semelhante, sementes de alguns lotes de trigo sarraceno (Fagopyrum esculentum) exigem luz constante e de boa intensidade para germinar.
d) Ausência de luz
Em alguns lotes, de certas espécies, a presença de luz pode inibir a germinação e a maioria das sementes não germinam e estão dormentes (conforme definição que consta em 4.2.8.b) ao final do Teste de Germinação conduzido com iluminação. Nestes casos, a condução de Testes de Germinação no escuro pode proporcionar maior porcentagem de plântulas normais. Algumas espécies em que a ausência de luz foi favorável à germinação estão listadas no subitem 4.7.6, mas é possível que tal situação também ocorra em lotes de sementes de outras espécies.
e) Envelopes de Polietileno Lacrado
Envelopes de polietileno bem ajustados e lacrados (ou selados) podem ser usados para envolver os substratos contendo as sementes como um método para superar mais facilmente a dormência, por exemplo, para algumas espécies do gênero Trifolium.
f) Acido Giberélico (GA3)
Este método é recomendado quando houver suspeita de dormência em sementes de cereais de clima temperado como Avena sativa, Hordeum vulgare subsp. vulgare, Secale cereale, xTriticosecale, Triticum aestivum subsp. aestivum e Valerianella locusta. Seu uso também pode ser necessário para alguns lotes de sementes olerícolas, condimentares e ornamentais.
O substrato de germinação é umedecido com uma solução 0,05% de GA3, preparada por meio da dissolução de 500 mg de GA3 em um litro de água. Quando a dormência for menos intensa, pode ser suficiente a utilização de uma solução 0,02% de GA3; quando a dormência for mais intensa, pode ser usada uma concentração de até 0,1%, rotineiramente.
Quando a concentração for maior do que 0,08%, é recomendada a dissolução de GA3 em solução tampão de fosfato. A solução tampão é preparada pela dissolução de 1,7799 g de fosfato monoácido de sódio bihidratado (Na2HPO4.2H2O) e 1,3799 g de fosfato biácido de sódio monohidratado (NaH2PO4.H2O) em um litro de água destilada.
g) Nitrato de Potássio (KNO3)
As sementes devem ser colocadas para germinar no substrato inicialmente umedecido com uma solução 0,2% de nitrato de potássio (2 g de KNO3 dissolvidos em 1.000 mL de água). O substrato deve ser previamente umedecido com essa solução, em lugar de água. Durante o teste, quando necessário, o reumedecimento deve ser feito somente com água.
Nota 17: Se forem observadas queimas de raízes ou outros sintomas de toxidez nas plântulas (ver sintomas no subitem 4.3.1), deve ser realizado um outro Teste de Germinação, desta vez, umedecido apenas com água. Os testes também podem ser conduzidos em paralelo para otimização do tempo de análise.
No caso de sementes revestidas, dependendo da composição do revestimento, o uso do KNO3 pode inibir a germinação de alguns lotes, devendo, portanto, ser utilizado com cuidado ou até mesmo ser evitado. Uma forma de lidar com essa situação é conduzir Testes de Germinação em paralelo, com e sem o tratamento com KNO3.
h) Escarificação com ácido
As sementes são embebidas em ácido sulfúrico concentrado (H2SO4) até que o tegumento se torne poroso. A escarificação pode ser rápida ou levar mais de uma hora, mas as sementes devem ser examinadas periodicamente, em poucos minutos. Após a escarificiação com ácido sulfúrico, as sementes devem ser bem lavadas em água corrente antes do início do Teste de Germinação, conforme descrito no subitem 4.8.1.c. Esse método também pode ser utilizado em sementes que possuem impermeabilidade a gases, por exemplo, em sementes de Urochloa spp.
No caso de arroz (Oryza sativa), a escarificação pode ser feita embebendo as sementes em uma solução 1 M de ácido nítrico (HNO3) por 24 horas (após pré-aquecimento a 50 ± 2 °C).
i) Pré-armazenamento
Para algumas espécies de gramíneas forrageiras de clima temperado, as sementes são armazenadas a temperatura de 15 a 25 °C, com livre circulação de ar antes de serem analisadas. Um período de pré-armazenamento de até um ano pode ser utilizado. Esse método é importante para produtores de sementes, porém não é realmente aplicável em análise de sementes de rotina. Se não houver outra forma de superar esse tipo dormência em um lote de sementes, recomenda-se utilizar um Teste de Tetrazólio para determinar a porcentagem de sementes viáveis.
j) Armazenamento em locais secos
Para as espécies nas quais a dormência é de curta duração, muitas vezes para superá-la, é suficiente armazenar a amostra em local seco por um curto período. Esse método é importante para produtores de sementes, mas seu uso em análises de rotinas é raro. Se o armazenamento for longo e não houver outra forma de superar esse tipo de dormência em um lote de sementes, recomenda-se utilizar um Teste de Tetrazólio para determinar a porcentagem de sementes viáveis.
k) Retirada de substâncias inibidoras
Substâncias que ocorrem naturalmente no pericarpo ou no tegumento e que atuam como inibidores da germinação podem ser removidas por imersão ou lavagem das sementes:
Imersão: Imergir as sementes em quantidade suficiente de água por 2 h. No caso de sementes de beterraba (Beta vulgaris) ou de tamanho semelhante, usar 250 mL de água por 100 sementes. Enxaguar as sementes em água corrente e secar a superfície. A temperatura da água utilizada na imersão e no enxágue deve estar entre 20 e 25 °C. Sementes pelotizadas não devem ser embebidas.
Pré-lavagem: Lavar as sementes em água corrente a uma temperatura de 25 ±2 °C antes da realização do teste de germinação. Após a lavagem, as sementes devem ser secadas a uma temperatura entre 20 e 25 °C (ex.: Beta vulgaris). As sementes pelotizadas não devem ser pré-lavadas.
l) Remoção de Estruturas que Envolvem as Unidades de Dispersão
A germinação de algumas espécies pode ser promovida pela remoção de estruturas externas, tais como o invólucro de cerdas ou a lema e a pálea de certas Poaceae.
¶ 4.8.3 TRATAMENTO PARA EVITAR DANOS POR EMBEBIÇÃO
Quando houver suspeita de que as sementes podem sofrer ou sofreram danos por sensibilidade à embebição, pode-se realizar um pré-condicionamento das sementes, em “gerbox” com tela (do tipo utilizado nos testes de envelhecimento acelerado), contendo 40 mL de água, pelo período de 16 a 24 horas, a 25 °C.
O manuseio e a transferência do “gerbox” com água e sementes para o germinador deve ser realizado com cuidado, sem fazer movimentos bruscos, pois as sementes não podem ter contato direto com a água. Pelo mesmo motivo, não deve ocorrer condensação de água na tampa do gerbox durante o pré-condicionamento.
Após o pré-condicionamento, deve-se proceder imediatamente a montagem do Teste de Germinação, obedecendo as condições prescritas no Quadro 4.1.
O dano por embebição rápida ocorre frequentemente em sementes de soja (Glycine max), que tem alto teor de proteína em sua composição, especialmente em sementes com menos de 12% de umidade, podendo variar conforme a cultivar. Ocorre, também, em outras leguminosas como Phaseolus vulgaris, Vigna unguiculata e em sementes de outras espécies, notadamente após sua produção ou armazenamento em ambiente seco. Também pode ocorrer em testes conduzidos em temperatura alternada, quando a embebição se inicia na temperatura mais baixa prescrita para o Teste de Germinação.
Nota 18: Em testes de germinação de soja, os danos por embebição rápida podem provocar alta porcentagem de plântulas anormais por danos no sistema radicular, em que a raiz primária se torna muito curta e grossa ou até inexistente e não há raízes secundárias suficientemente desenvolvidas para compensar (Figura 4.3) e mortalidade de sementes. Para outras espécies, são indícios da ocorrência destes danos: grau de umidade menor que 12%, plântulas com esse tipo de anormalidade no sistema radicular ou resultados de testes de envelhecimento acelerado melhores do que os obtidos em Testes de Germinação.
Nota 19: Quando não houver recomendação de temperatura para pré-condicionamento no Quadro 4.1, este pode ser realizado em temperaturas maiores do que 25 °C, desde que seja alguma temperatura prescrita para o Teste de Germinação da espécie em análise ou existam indicações na literatura de que essas temperaturas são mais efetivas do que 25 °C. Nesses casos, as condições do pré-condicionamento devem ser informadas no Boletim de Análise de Sementes.
FIGURA 4.3 Exemplo de plântulas de soja cv Tucunaré com danos por embebição rápida.
Fotos: Dr. José Barros França Neto, pesquisador da Embrapa Soja.
¶ 4.8.4 DESINFESTAÇÃO DAS SEMENTES
Atualmente, somente amostras de sementes de amendoim (Arachis hypogaea) e de beterraba (Beta vulgaris) podem ser tratadas com fungicida no laboratório para realização de Testes de Germinação. Esse tratamento só pode ser realizado se as sementes não tiverem sido originalmente tratadas. Apenas para essas duas espécies, os resultados do Teste de Germinação de sementes tratadas no laboratório podem ser reportados nos campos disponíveis para lançamento dos resultados de germinação do Boletim de Análise de Sementes. Para amostras de outras espécies, os tratamentos com fungicidas no laboratório não são cobertos por essas Regras para Análise de Sementes - RAS.
Excepcionalmente, os resultados dos testes de germinação para sementes de outras espécies tratadas com fungicidas no laboratório podem ser reportados no campo “Observações” dos Boletins de Análise de Sementes, seguidos da seguinte expressão “Este método de germinação não está coberto pelas Regras para Análise de Sementes - RAS”. Em tal situação, é obrigatório que o laboratório realize também um Teste de Germinação com sementes não tratadas com fungicida, reportando os resultados obtidos neste teste nos campos destinados à germinação do Boletim de Análise de Sementes.
Se for realizado um pré-tratamento de sementes com fungicidas, o nome do produto comercial e a dose utilizada, devem ser informados no campo “Observações” do Boletim de Análise de Sementes.
¶ 4.8.4.1 Instruções para tratamento com fungicidas
O fungicida a ser utilizado no tratamento de sementes, obrigatoriamente, tem que estar registrado no Ministério da Agricultura e Pecuária - MAPA para uso em sementes da espécie em questão.
A manipulação do fungicida no laboratório deverá obedecer às normas existentes para este tipo de produto, atentando para a segurança do operador e para os cuidados específicos de prevenção e poluição do ambiente.
As sementes devem ser manipuladas, preferencialmente, em ambientes mais apropriados, como câmaras de exaustão ou capelas, devendo o material utilizado ser lavado em separado. O uso de luvas e máscaras protetoras é altamente recomendado nesta operação.
Apenas as sementes que serão utilizadas no Teste de Germinação devem ser tratadas.
a) Mistura das sementes ao produto
Uma forma adequada de tratar sementes com fungicidas líquidos está descrita abaixo:
- Obter a porção de sementes que será utilizada no Teste de Germinação, conforme instruções do subitem 4.7.1.
- Pesar as sementes obtidas e preparar a calda de acordo com os cálculos apresentados no item b.
- Colocar as sementes em saco plástico de gramatura grossa e adicionar o fungicida já diluído na proporção indicada pelo fabricante.
- Fechar a abertura do saco plástico e agitar as sementes até se se obter uma adesão uniforme do produto.
b) Cálculo da diluição do produto
A dose que consta na bula do produto deve ser utilizada proporcionalmente nas sementes. O cálculo pode ser feito através de regra de três. Para o preparo da calda, pode ser utilizada a proporção 1:3, ou seja, uma porção da fórmula comercial do fungicida com três do diluente (água ou outro diluente).
Por exemplo, quando a recomendação da bula for de 250 mL p.c./i.a por 100 kg de sementes e o tratamento precisar ser feito em 200 g (0,2 kg) de sementes:
250 mL ---------- 100 kg
X ------------------- 0,2 kg
Então, X = 0,5 mL, ou seja, deve-se utilizar 0,5 mL para tratar 200 g de sementes. Diluindo-se o produto em 3 vezes esse volume do diluente (0,5 mL x 3 =1,5 mL).
c) Secagem da umidade superficial
Após o tratamento, as sementes devem ser dispostas sobre folhas de papel de germinação (germitest) ou outro papel absorvente, no ambiente do laboratório, por um período de 4 a 24 h, para possibilitar a ação do fungicida e secagem da umidade superficial.
Em sementes de amendoim (Arachis hypogaea), a secagem por 24 h tem se mostrado adequada. Se a bula do produto indicar outras condições, estas devem ser seguidas.
d) Montagem do teste de germinação
Logo depois da secagem, o Teste de Germinação deve ser montado, utilizando-se um dos métodos prescritos no Quadro 4.1. As sementes tratadas e não utilizadas no Teste de Germinação devem ser descartadas, considerando-se os cuidados com contaminação ambiental.
¶ 4.9 PRIMEIRA CONTAGEM E CONTAGENS INTERMEDIÁRIAS
Os períodos indicados no Quadro 4.1 para a primeira contagem, referem-se à utilização da temperatura mais alta recomendada. Se for utilizada uma temperatura mais baixa, a contagem poderá ser adiada. Trata-se de um tempo aproximado também porque a primeira contagem deve ser realizada quando as plântulas tiverem alcançado um estádio de desenvolvimento que permita uma avaliação mais precisa (subitem 4.11.a). É relativamente frequente existir um desvio de três a quatro dias na data prevista para a primeira contagem e, quando necessário, o número de dias do desvio poderá ser maior.
Para testes em areia ou em substratos orgânicos com duração de até 14 dias, a primeira contagem pode ser omitida. No entanto, é recomendável monitorar a umidade do substrato durante esse período.
Tratando-se de sementes com longo período de germinação ou no caso de amostras contendo sementes infeccionadas, o analista poderá fazer contagens intermediárias. A finalidade dessas contagens é remover plântulas que estejam suficientemente desenvolvidas, a fim de facilitar as contagens subsequentes, e evitar que elas afetem o desenvolvimento de outras plântulas.
O número de contagens intermediárias deve ser o mínimo possível para reduzir o risco de danos às estruturas das plântulas que ainda não estejam bem desenvolvidas, a perda de umidade do substrato e a contaminação do teste.
Quando as sementes estiverem muito infestadas, pode ser necessário trocar o substrato na primeira contagem ou em outras contagens intermediárias.
Na primeira contagem e nas contagens intermediárias, devem ser avaliadas e retiradas do substrato, após anotação na ficha de análise, as plântulas normais e, se necessário, as plântulas infeccionadas e as sementes mortas. Somente são mantidas as sementes ainda não germinadas ou em estágio inicial de germinação, as plântulas desenvolvimento ainda insuficiente para serem avaliadas e as que apresentam algum defeito/dano que possa ser revertido ao longo do teste.
¶ 4.10 DURAÇÃO DO TESTE
A duração do teste para cada espécie é indicada no Quadro 4.1 pelo número de dias da contagem final. Nesta duração, não está incluído o período de pré-tratamento utilizado para promover a germinação das sementes.
Se o Teste de Germinação terminar em um final de semana ou feriado, a contagem final poderá ser realizada no dia útil anterior ou posterior a essa data. O teste pode ser encerrado antes do tempo indicado, quando a germinação máxima já tiver sido obtida.
No final do período do teste, quando, por exemplo, algumas sementes tiverem apenas iniciado a germinação, a duração do Teste de Germinação poderá ser estendida:
a. Por 7 dias, para espécies com leitura final menor ou igual a 14 dias.
b. Por até a metade do período prescrito, para espécies com leitura final maior que 14 dias.
c. Por até 21 dias para Lolium spp.
d. Por até 32 dias para Festuca spp. (exceto F. arundinacea e F. pratensis).
e. Por até 42 dias para Poa spp. (exceto P. bulbosa).
f. Por até 54 dias para Poa bulbosa.
¶ 4.11 AVALIAÇÃO DOS TESTES
a) Plântulas
As plântulas devem ser avaliadas de acordo com as definições destas RAS (subitens 4.2.3 a 4.2.7) e as particularidades que constam no Anexo “Critérios de Avaliação de Plântulas. Para orientar este trabalho, os principais tipos de anormalidades estão relacionados no subitem 4.2.6.1 “Anormalidades de plântulas”.
O estádio de desenvolvimento das estruturas essenciais das plântulas deve ser suficiente para permitir a avaliação adequada das mesmas e a diferenciação entre plântulas normais e anormais. Por isso, às vezes, é oportuno adiar a primeira contagem para que as plântulas atinjam o desenvolvimento adequado. Por esse mesmo motivo, a data da primeira contagem pode ser antecipada (ver detalhes no subitem 4.9).
Plântulas que alcançaram o estádio em que todas as estruturas essenciais já podem ser precisamente verificadas, devem ser contadas e removidas do teste na primeira ou em qualquer outra contagem. Recomenda-se que plântulas seriamente deterioradas sejam removidas para reduzir os riscos de infecções secundárias. Plântulas duvidosas com outros defeitos devem ser deixadas no substrato até a contagem final, a menos que seja óbvio que elas jamais irão produzir plântulas normais, como por exemplo, plântulas quebradas e albinas.
Os Testes de Germinação em substratos de papel geralmente permitem uma fácil avaliação das plântulas. Em caso de dúvidas quanto a anormalidades de plântulas, um novo teste deve ser realizado em areia ou substrato orgânico, nas condições indicadas nestas RAS. Outra amostra da mesma cultivar, que tenha germinado de modo satisfatório, pode ser simultaneamente semeada para servir de testemunha ao novo teste.
b) Unidade-Semente Múltipla
Quando uma unidade-semente produzir mais de uma plântula normal, somente uma será contada para determinar a porcentagem de germinação (ver mais informações no subitem 4.2.7). Quando solicitado pelo requerente, o número de plântulas normais produzidas por 100 unidades ou o número de unidades as quais tenham produzido uma, duas ou mais plântulas normais poderá ser determinado.
c) Sementes não germinadas
- Sementes duras: são sementes que não absorveram água ao final do Teste de Germinação, incluído o período adicional, e que são contadas e informadas no Boletim de Análise de Sementes. No entanto, quando for necessário superar a dormência das sementes, as medidas descritas no subitem 4.8.1 deverão ser tomadas.
- Sementes dormentes: são sementes que absorveram água e não estão obviamente mortas (ver definição no subitem 4.2.8.b). Quando forem encontradas em uma proporção igual ou maior do que 5%, deve-se verificar se possuem potencial para produzir plântulas normais. Isto pode ser feito com o Teste de Tetrazólio, mesmo que não haja método prescrito nestas RAS ou por outro método, como a dissecação, desde que seja apropriado para a espécie em análise. Após essa verificação, se ainda houver dúvidas se a semente está dormente ou morta, ela deve ser considerada como morta. As sementes que estiverem viáveis serão mantidas como dormentes e as não viáveis serão somadas às sementes já classificadas anteriormente como mortas. Quando for necessário obter uma avaliação mais completa, especialmente se uma grande porcentagem de sementes dormentes for observada, os tratamentos para promover a germinação descritos no subitem 4.8.2 podem ser utilizados em um ou mais Testes de Germinação.
- Sementes mortas: sementes obviamente mortas (moles, mofadas) são contadas e informadas no Boletim de Análise de Sementes, juntamente com as classificadas como mortas durante a verificação da viabilidade das sementes dormentes.
Nota 20: Quando for possível observar que uma semente produziu qualquer parte de uma plântula (ex.: a extremidade de uma raiz primária), mesmo que esteja deteriorada no momento da avaliação, é contada como plântula anormal e não como semente morta.
- Outras categorias de sementes vazias ou não germinadas: por solicitação do requerente, a porcentagem de sementes vazias, sem embrião ou danificadas por insetos podem ser determinadas e informadas em “Observações” no Boletim de Análise de Sementes. Para determinar estas categorias de sementes, os seguintes métodos podem ser usados:
- Antes do Teste de Germinação:
- Teste do raio X, conduzido nas repetições que serão usadas no Teste de Germinação, possibilita a detecção de sementes cheias, vazias/sem embrião ou danificadas por insetos (ver Capítulo 11 “Teste de Raios X”).
- Teste do corte, o qual é executado em duas ou quatro repetições de 100 sementes (a critério do laboratório ou conforme solicitado pelo requerente). As sementes primeiramente são examinadas sobre a presença de orifícios de insetos. Em seguida, são embebidas em água por até 24 horas em temperatura ambiente. Cada semente é cortada no sentido longitudinal, depois observada e classificada como cheia, vazia, sem embrião ou danificada por insetos.
- Após o Teste de Germinação:
- Teste do corte ou raio X nas sementes aparentemente dormentes, não germinadas, para classificação como cheias, vazias/ sem embrião ou danificadas por insetos (ver Capítulo 11 “Teste de Raios X”).
- Quando for executado o Teste de Tetrazólio, a porcentagem de sementes vazias e danificadas por insetos também pode ser determinada durante a preparação e avaliação.
¶ 4.12 REPETIÇÃO DO TESTE DE GERMINAÇÃO (RETESTE)
¶ 4.12.1 RETESTE OBRIGATÓRIO
O resultado de um Teste de Germinação deve ser considerado insatisfatório, não podendo ser reportado:
a) Quando houver evidências de erros ou problemas nas condições do teste, na avaliação ou na contagem de plântulas, deve-se realizar um reteste utilizando o mesmo método ou algum método alternativo descrito na Quadro 4.1 e o resultado do reteste e o método utilizado deverá ser reportado no Boletim de Análise de Sementes;
b) Quando o resultado do Teste de Germinação não é confiável devido à fitotoxidez (ver sintomas no subitem 4.3.1.b) ou contaminação por fungos ou bactérias, retestes devem ser executados usando um ou mais métodos alternativos indicados no Quadro 4.1 ou em areia ou em substrato orgânico. Se necessário, a distância entre as sementes pode ser aumentada. O melhor resultado e o método utilizado devem ser reportados no Boletim de Análise de Sementes;
c) Quando for difícil avaliar corretamente certas plântulas, deve ser feito outro teste usando-se um ou mais métodos alternativos indicados no Quadro 4.1, ou em areia ou em substrato orgânico. O melhor resultado e o método utilizado devem ser reportados no Boletim de Análise de Sementes;
d) Quando houver suspeita da ocorrência de dano por embebição, um segundo teste deve ser realizado com sementes pré-condicionadas conforme descrito no subitem 4.8.3. Ou, em caso de temperatura alternada, se o dano tiver sido provocado pelo início da embebição na temperatura mais baixa, montar o teste no período de maior temperatura. O melhor resultado e o método utilizado devem ser reportados no Boletim de Análise de Sementes;
e) Quando a variação entre as repetições de 100 sementes exceder a tolerância máxima permitida na Tabela de Tolerância 4.1 (coluna C), um reteste deve ser feito usando-se o mesmo método ou um método alternativo. Se o resultado do reteste com o mesmo método for compatível com o primeiro, isto é, a diferença não exceder à tolerância indicada na Tabela de Tolerância 4.2, a média dos dois testes deve ser informada no Boletim de Análise de Sementes. Se o segundo resultado, usando o mesmo método, não for compatível com o primeiro, realizar outros testes, com o mesmo método, até que pelo menos um par de testes apresentem resultados compatíveis. A média dos resultados compatíveis deve ser informada no Boletim de Análise de Sementes. Se for usado um método alternativo, o maior resultado deve ser reportado no Boletim de Análise de Sementes, não sendo necessário calcular a média com os resultados anteriores;
f) Se a amostra não responder satisfatoriamente ao método selecionado, será necessário realizar um reteste com um ou mais métodos alternativos, podendo ser utilizados métodos prescritos no Quadro 4.1 ou no subitem 4.8, testes em areia ou em substrato orgânico. Nesse, caso um teste paralelo de outra amostra da espécie, preferencialmente da mesma cultivar, com germinação satisfatória, pode ser utilizado como referência para a avaliação deste reteste. O melhor resultado alcançado e o método utilizado devem ser reportados no Boletim de Análise de Sementes.
Quando houver suspeita, antes ou durante o Teste de Germinação, da ocorrência de qualquer um dos casos acima, Testes de Germinação simultâneos podem ser realizados utilizando-se os métodos alternativos indicados no Quadro 4.1 ou que constem nos subitens 4.8.1, 4.8.2 e 4.8.3 e, se permitido para a espécie, no subitem 4.8.4.
¶ 4.12.2 RETESTE OPCIONAL
A critério do laboratório ou a pedido do requerente, quando houver suspeita ou evidência da ocorrência de dormência (física ou de outro tipo), quaisquer dos métodos indicados no Quadro 4.1 ou nos subitens 4.8.1 ou 4.8.2 podem ser utilizados em um ou mais testes adicionais. O melhor resultado e o método utilizado devem ser reportados no Boletim de Análise de Sementes. Resultados de outros testes podem ser informados no campo “Observações” deste boletim.
¶ 4.13 CÁLCULO E INFORMAÇÃO DOS RESULTADOS
Os resultados dos Testes de Germinação de sementes não revestidas, revestidas e de misturas são calculados e arredondados de acordo com o descrito abaixo, nos subitens 4.13.1 e 4.13.2.
O informe de resultados de sementes revestidas deve ser realizado de acordo com as instruções do subitem 8.6.7 do Capítulo 8 “Análise de Sementes Revestidas” e os informes de misturas de sementes, conforme as instruções do subitem 10.9 do Capítulo 10 “Análise de Mistura de Sementes” destas RAS.
Para as sementes de algumas espécies para as quais for permitido, o Teste de Germinação é realizado no peso das quatro repetições pesadas (como em sementes de Chloris gayana), o cálculo e o relato de resultados são realizados conforme as instruções do Capítulo 12 “Teste por Repetições Pesadas” destas RAS, sendo utilizada a Tabela de Tolerância entre as repetições que consta neste mesmo capítulo.
¶ 4.13.1 TOLERÂNCIA ENTRE AS REPETIÇÕES DE 100 SEMENTES
O resultado do Teste de Germinação é a média das quatro repetições de 100 sementes (sub-repetições de 50 ou 25 sementes são combinadas em repetições de 100).
Para que o resultado de um Teste de Germinação possa ser considerado satisfatório e válido para emissão do resultado, é preciso que a variação entre as porcentagens de germinação das repetições de 100 sementes esteja dentro das tolerâncias máximas permitidas. A tolerância deve ser aplicada para a categoria de plântulas normais.
Para se fazer essa verificação, determina-se a média das quatro repetições, em seguida localiza-se esse valor na coluna A ou B, da Tabela de Tolerância 4.1, obtendo-se na coluna C a respectiva tolerância máxima permitida.
Se a variação entre as porcentagens de germinação das quatro repetições for inferior ou igual a essa tolerância, a média representará o resultado do Teste de Germinação. Se essa variação for superior à tolerância permitida, pode-se desprezar a repetição cuja porcentagem de germinação for a mais baixa das quatro e, após calcular a média das outras três repetições, procurar nas colunas e da Tabela de Tolerância 4.1 a nova tolerância máxima permitida. Se a diferença entre as porcentagens de germinação dessas três repetições for inferior ou igual à nova tolerância, essa média é considerada válida para a emissão do resultado no Boletim de Análise de Sementes. Se a variação for maior do que a tolerância indicada, o resultado deste teste não deve ser informado no Boletim de Análise de Sementes e um novo teste deve ser realizado.
¶ 4.13.2 ARRENDONDAMENTO DOS RESULTADOS
As porcentagens de plântulas normais, plântulas anormais, sementes duras, sementes dormentes e sementes mortas obtidas no teste devem ser arredondadas para o número inteiro mais próximo.
A soma das porcentagens de plântulas normais, plântulas anormais, sementes duras, sementes dormentes e sementes mortas deve totalizar 100%. Quando isto não ocorrer, manter a aproximação do número inteiro para a porcentagem de plântulas normais. Selecionar, dentre os outros valores apenas aquele com a maior parte fracionária e fazer a aproximação do mesmo. Utilizar apenas o número inteiro dos outros três valores e refazer a soma. Se fechar em 100%, informar esses resultados. Se não, aproximar também o valor com a segunda maior parte fracionária e repetir o cálculo. Quando houver partes fracionárias iguais, a prioridade é: plântulas anormais, sementes duras, dormentes e mortas. Um outra opção para realizar os cálculos de arredondamento é utilizar a planilha “rounding” da ISTA.

¶ 4.13.3 INFORMAÇÕES OBRIGATÓRIAS NO BOLETIM DE ANÁLISE DE SEMENTES
Os seguintes itens devem ser preenchidos nos campos apropriados do Boletim de Análise de Sementes:
- Duração do teste.
- Data da conclusão do teste.
- Porcentagem de plântulas normais, anormais, sementes duras, dormentes e mortas. Se o resultado de qualquer uma destas categorias for zero, este deve ser expresso como “0”. Para sementes revestidas, nos campos “Sementes Dormentes” e “Sementes Duras”, informar “-N-” ou "N", exceto se as pelotas não germinadas forem quebradas e a classificação das sementes em mortas, dormentes e mortas for realizada. Ver mais informações no subitem 8.6.7 do Capítulo 8 “Análise de sementes revestidas”.
- Substrato utilizado.
- Temperatura de condução do teste.
- Qualquer tratamento especial ou método utilizado para promover a germinação (Quadro 4.1 ou subitem 4.8).
- Método utilizado para confirmar a viabilidade das sementes dormentes nos testes em que o percentual de sementes dormentes foi igual ou superior a 5% (informar no campo “Observações”).
- Para misturas de sementes revestidas e misturas de sementes há outra informações obrigatórias e as instruções completas encontram-se no subitem 8.6.7 do Capítulo 8 “Análise de Sementes Revestidas” e no subitem 10.9 do Capítulo 10 "Análise de Misturas de Sementes".
¶ 4.13.4 INFORMAÇÕES OPCIONAIS NO BOLETIM DE ANÁLISE DE SEMENTES
Podem ser relatados nos campos “Observações” do Boletim de Análise de Sementes:
- O resultado de quaisquer testes adicionais realizados e considerados válidos de acordo com estas RAS.
- Resultados de testes de germinação realizados com sementes tratadas com fungicidas quando o tratamento não estiver previsto nestas RAS, seguidos das informações sobre o tratamento utilizado e da seguinte expressão “Este método não está coberto pelas Regras para Análise de Sementes - RAS”.
- Quando solicitado pelo requerente: Outras categorias de sementes não germinadas e o método utilizado para determiná-las;
- Quando solicitado pelo requerente: em amostras com unidades-sementes múltiplas: número de plântulas normais produzidas por 100 unidades; proporção de unidades produzindo uma, duas ou mais do que duas plântulas normais
¶ 4.14 APLICAÇÃO DAS TABELAS DE TOLERÂNCIA
Para que o resultado de um Teste de Germinação possa ser considerado satisfatório e válido para emissão do resultado, é preciso que a variação entre as porcentagens de germinação das repetições de 100 sementes esteja dentro das tolerâncias máximas permitidas. A tolerância deve ser aplicada para a categoria de plântulas normais, e comparado com a utilização da Tabela de Tolerância 4.1, conforme descrito no subitem 4.13.1.
Para os testes por repetições pesadas, as tolerâncias entre repetições de peso determinado encontram-se na Tabela 12.1 do Capítulo 12 “Teste de Sementes por Repetições Pesadas”.
Tabelas para comparação de resultados entre dois testes encontram-se no na Tabelas de Tolerância 4.2, 4.3 e 4.4 deste Capítulo.
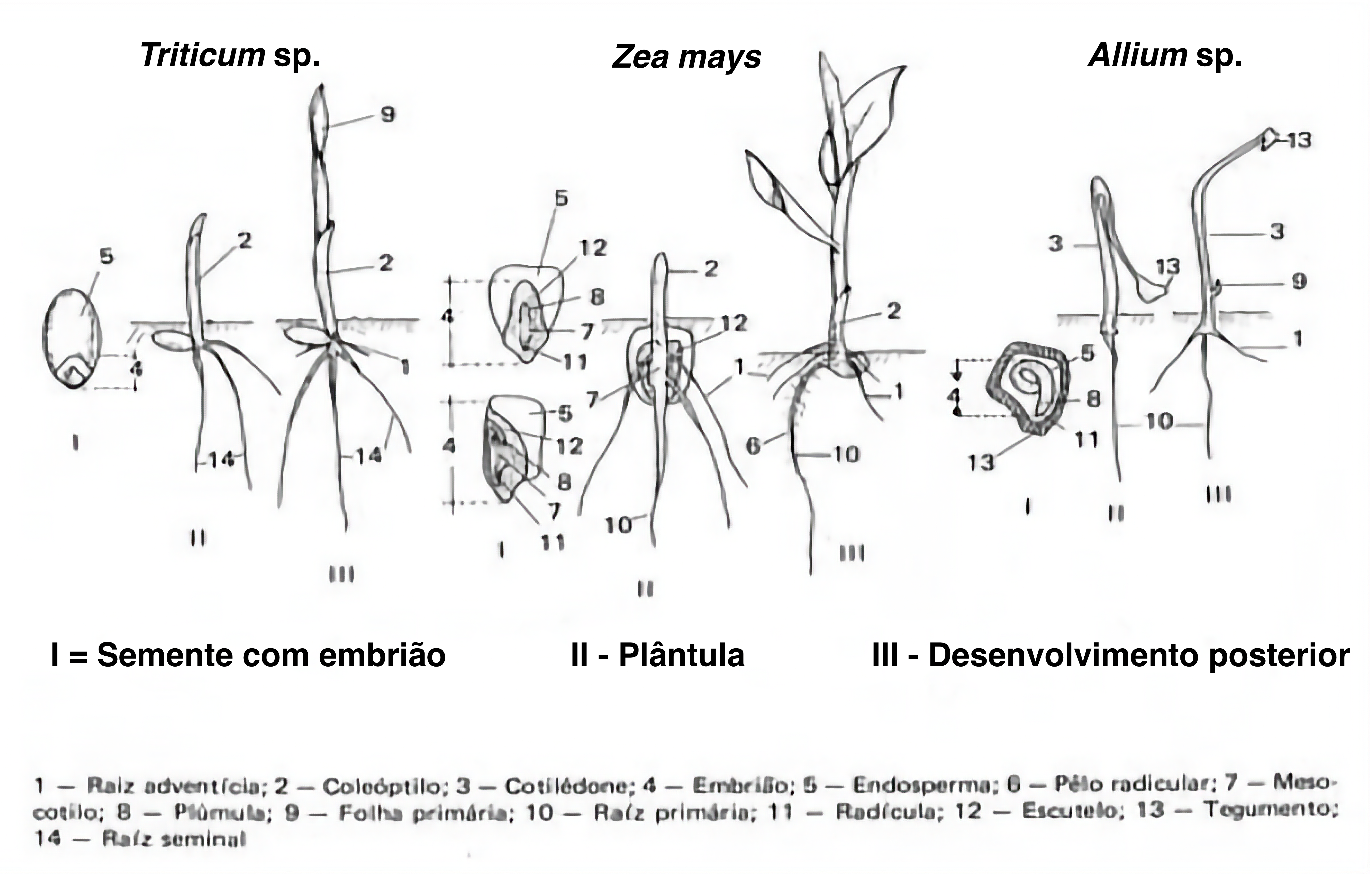
FIGURA 4.4: Germinação hipógea de Triticum sp. e Zea mays e germinação epígea de Allium sp. (Monocotiledôneas).
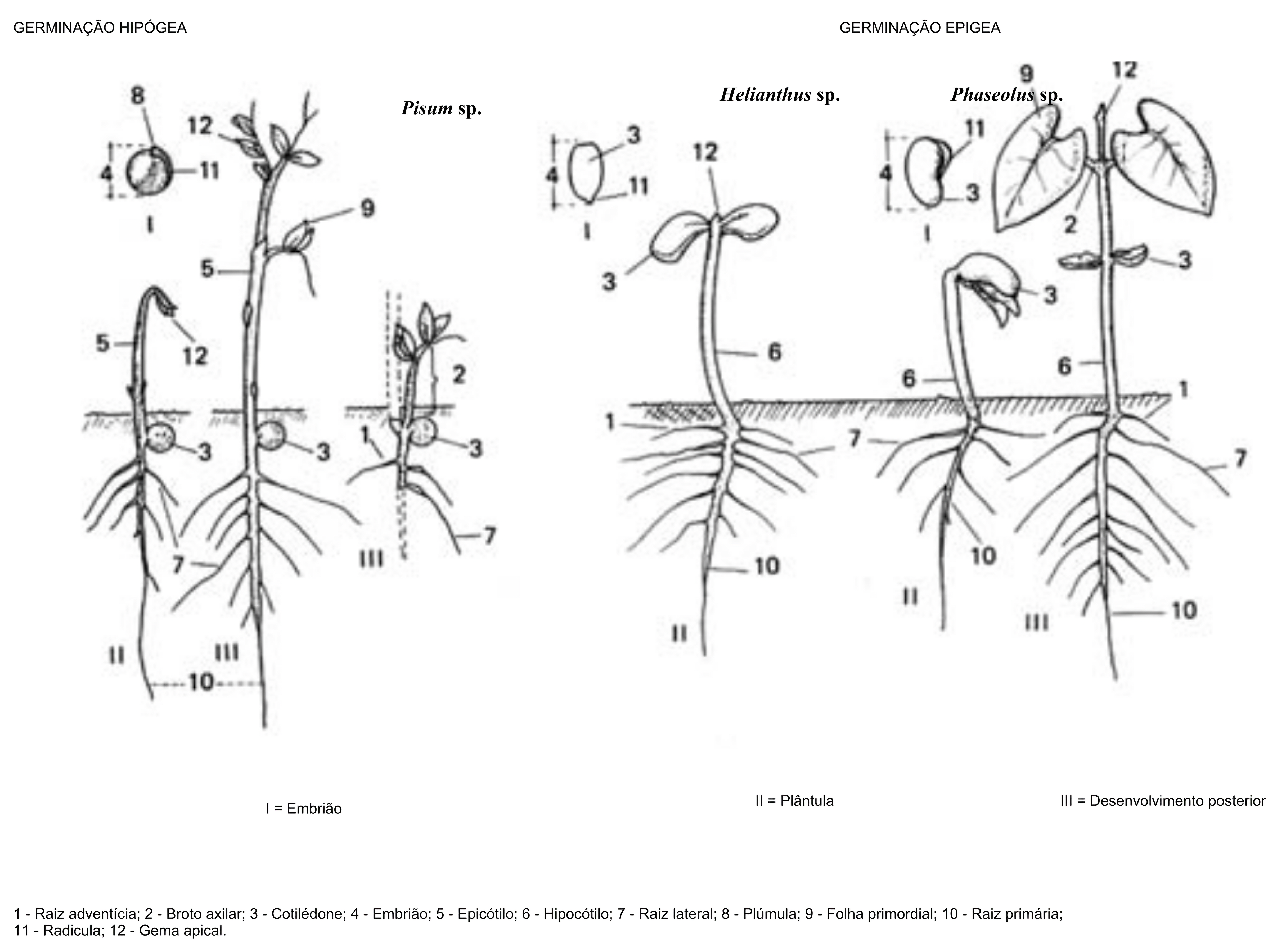
FIGURA 4.5: Germinação hipógea de Pisum sp. e germinação epígea de Helianthus sp. e Phaseolus sp. (Dicotiledôneas).
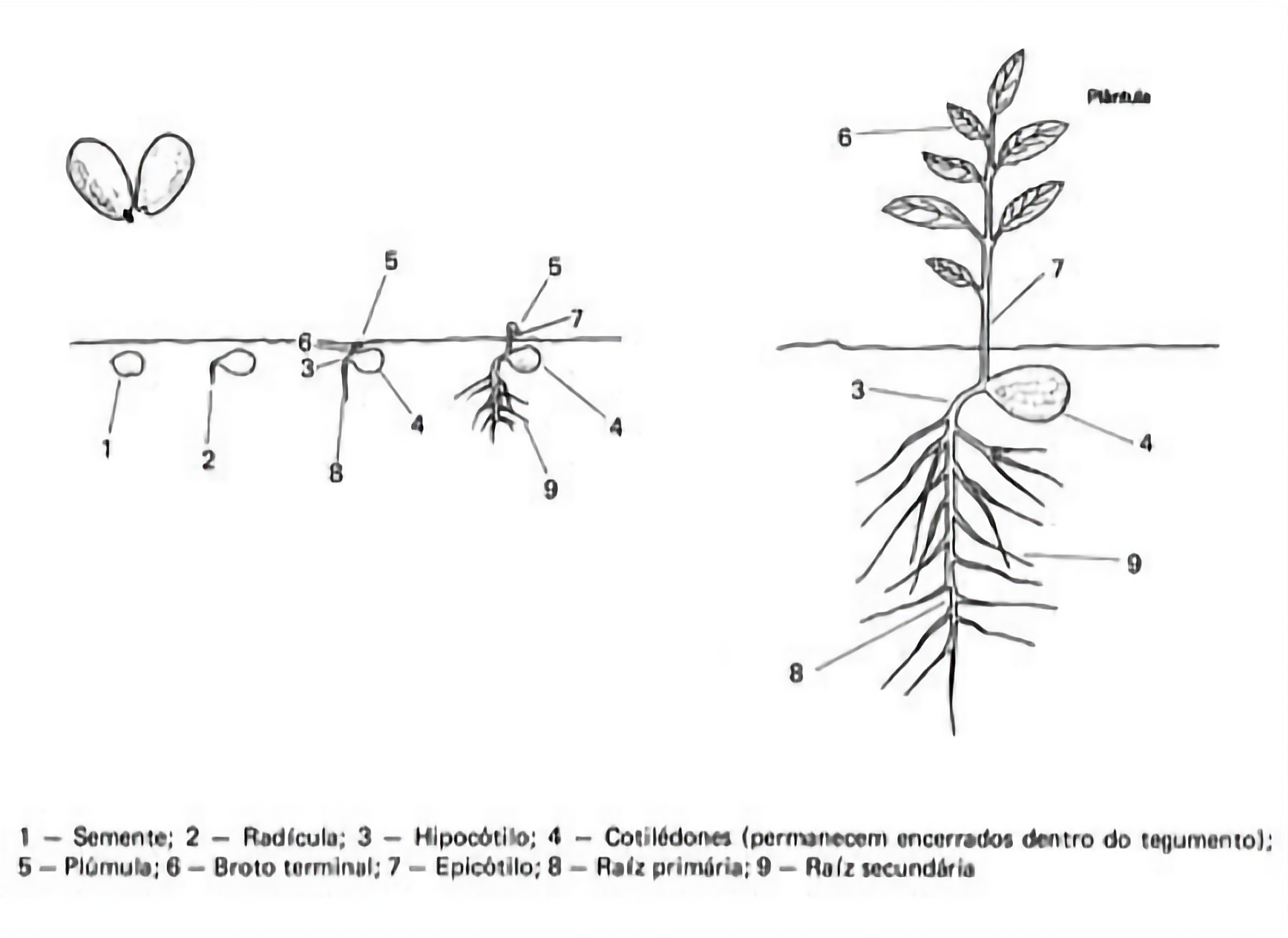
FIGURA 4.6 – Germinação hipógea da semente de pêssego (Dicotiledônea).
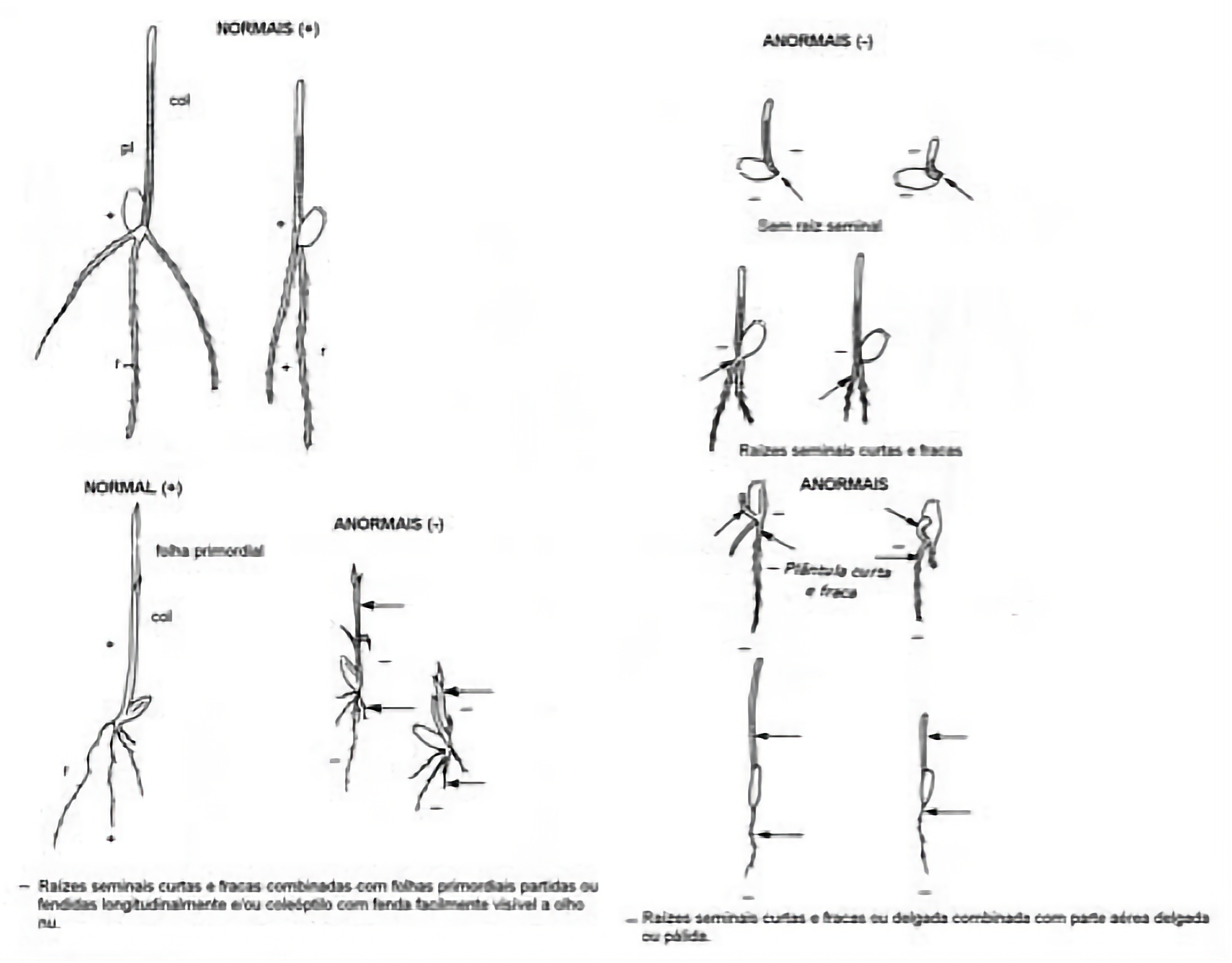
FIGURA 4.7: Categorias de anormalidades em Monocotiledôneas
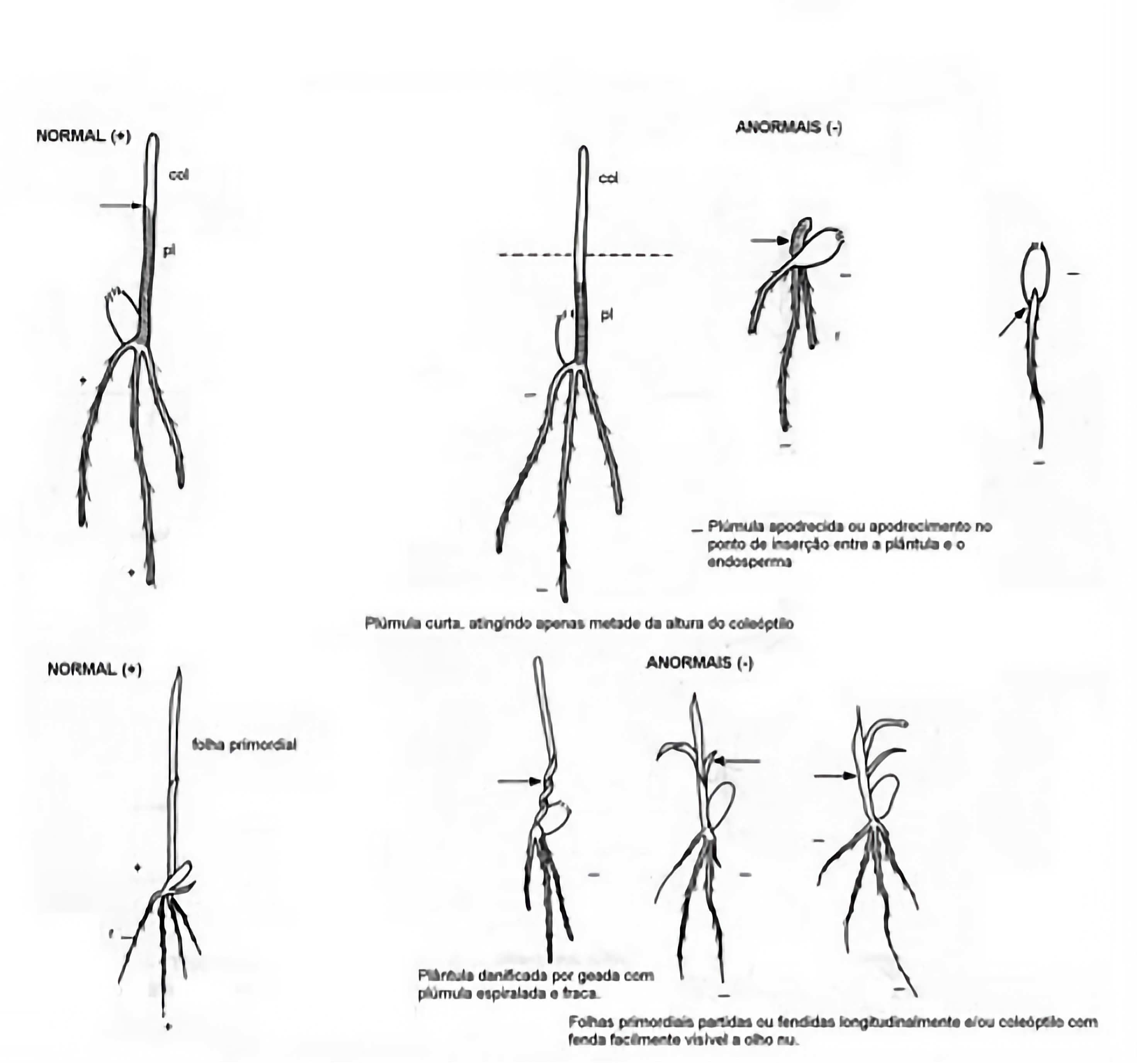
FIGURA 4.8: Categorias de anormalidades em Monocotiledôneas
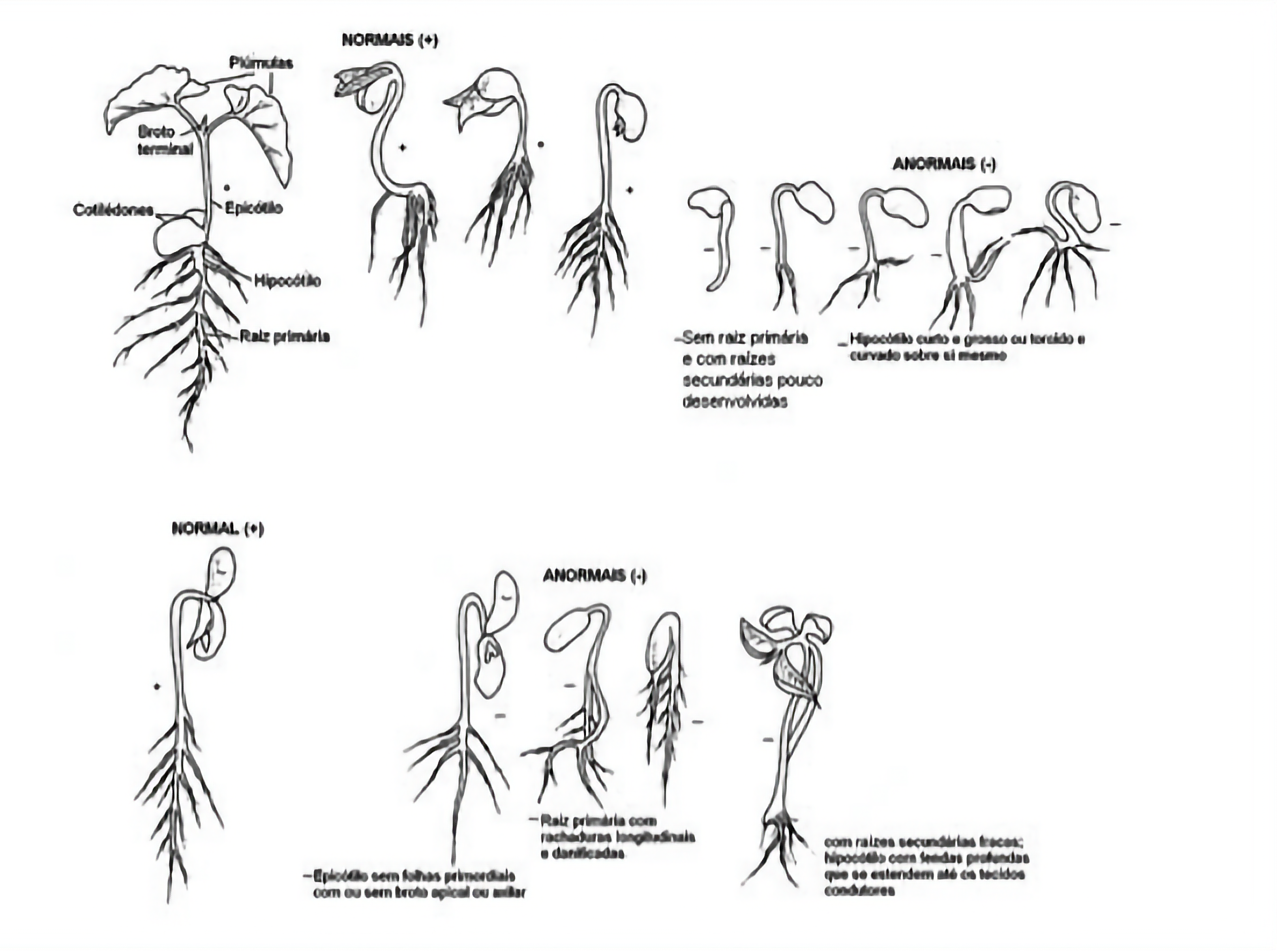
FIGURA 4.9: Categorias de anormalidades em Dicotiledôneas
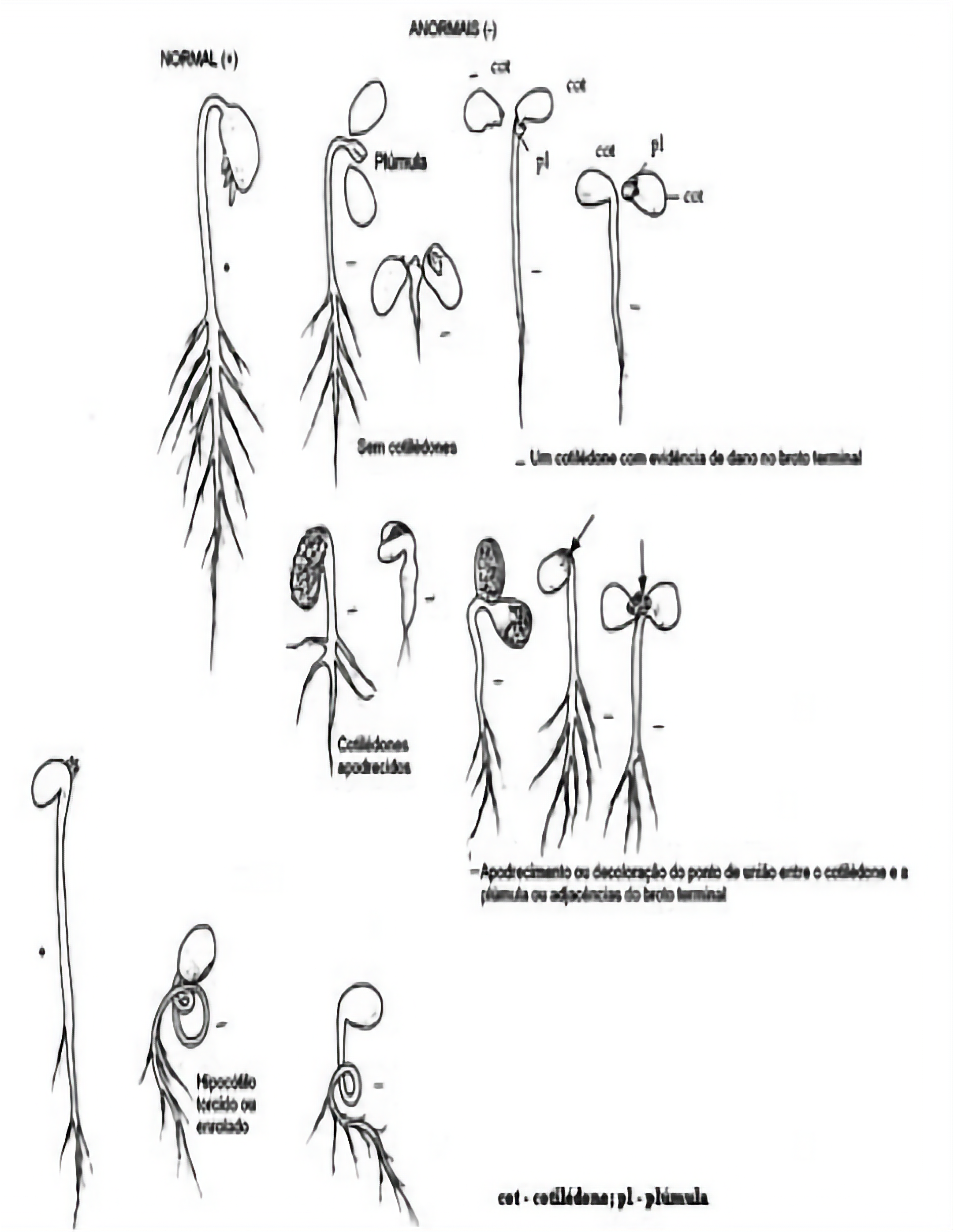
FIGURA 4.10: Categorias de anormalidades em Dicotiledôneas
¶ 4.15 BIBLIOGRAFIA CONSULTADA
ISTA - INTERNATIONAL SEED TESTING ASSOCIATION. List of stabilized plant names. 7.ed. Bassersdorf: Nomenclature Committee, 2021. 73p. Disponível em: https://www.seedtest.org/en/services-header/tools/nomenclature-committee.html. Acesso em: 30 Ago 2024.
ISTA - INTERNATIONAL SEED TESTING ASSOCIATION. The germination test. In: International rules for seed testing. ed. 2025. Wallisellen, Switzerland, 2025. ch.5, p. 5.1-5.60.
MILES, S.R. Handbook of tolerances and of measures of precision for seed testing. Proceedings of the International Seed Testing Association, Bassersdorf, v.28, p.525-686, 1963.
REFLORA. Flora e Funga do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: http://floradobrasil.jbrj.gov.br/. Acesso em: 30 Ago 2024
USDA GRIN-Global U.S. National Plant Germplasm System. Acesso em 21/06/2024. https://npgsweb.ars-grin.gov/gringlobal/taxon/taxonomysearch. Acesso em: 30 Ago 2024
¶ 4.16 HISTÓRICO DE REVISÕES
|
Versão |
Conteúdo alterado |
Data |
Motivo |
|---|---|---|---|
|
1 |
- |
28/03/2025 |
Criação do documento |
|
1.1 |
Alterações pontuais |
25/04/2025 |
Correções pontuais |
|
1.2 |
Alterações pontuais |
26/06/2025 |
Novas correções pontuais e entrada em vigor |
|
1.3 |
Link do Quadro 1.5 |
01/07/2025 |
Atualização do link do Quadro 1.5 da rev. 1.2 para a rev. 1.3 |
¶ Anexos
ANEXO “CRITÉRIOS PARA AVALIAÇÃO DE PLÂNTULAS"
Quadro 4.1: INSTRUÇÕES PARA REALIZAR TESTES DE GERMINAÇÃO DE SEMENTES AGRÍCOLAS POR ESPÉCIE BOTÂNICA
Quadro 4.2: GRUPOS DE AVALIAÇÃO DE PLÂNTULAS DE ESPÉCIES AGRÍCOLAS
TABELA DE TOLERÂNCIA 4.1 (rev. 1): Tolerâncias máximas admitidas entre os resultados das repetições do mesmo teste.
TABELA DE TOLERÂNCIA 4.2 (rev. 1): Tolerâncias máximas admitidas para comparação de resultados de amostras de trabalho obtidas da mesma ou de diferentes amostras médias do mesmo lote, analisadas no mesmo laboratório, a 2,5% de probabilidade.
TABELA DE TOLERÂNCIA 4.3 (rev. 1): Tolerâncias máximas admitidas para comparação de resultados de amostras de trabalho obtidas da mesma ou de diferentes amostras médias do mesmo lote, em diferentes laboratórios, a 5% de probabilidade.
TABELA DE TOLERÂNCIA 4.4 (rev. 1): Tolerâncias máximas admitidas para comparação de resultados de dois Testes de Germinação realizados a partir de diferentes amostras médias do mesmo lote, quando o resultado da segunda análise é pior do que o resultado da primeira análise, realizada no mesmo laboratório ou em diferentes laboratórios, a 5% de probabilidade.