¶ Folha de rosto
© 2024 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Ano 2024
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Esplanada dos Ministérios, Bloco D, Anexo, Ala B, 4º andar, sala 433
CEP: 70043-900, Brasília - DF
www.agricultura.gov.br
e- mail: cgal@agro.gov.br
Central de Relacionamento: 0800 704 1995
Equipe Técnica:
- Ana Cristina Gonçalves Pinto da Rocha
- Ana Carolina de Oliveira Nascimento
- Anapolino Macedo de Oliveira
- Aerlem Cynara Silva
- Ana Karina Cunha Callado
- Andrea Padilha de Alencar
- Anselmo Vasconcelos Rivetti Júnior
- Antônio Augusto Fonseca Júnior
- Cid Aristóteles de Siqueira Alencar
- Dilmara Reischak
- Fernanda Gomes Cardoso
- Isabela Ciarlini de Azevedo
- João Marcos Nacif da Costa
- Juliana Nabuco Pereira Otaka
- Luanda Bispo Santos do Nascimento Maués
- Luciana Amaral Pinto
- Luciana Rabello Ferreira
- Luciana Taborda Corrêa
- Marcelo Fernandes Camargos
- Marco Antônio de Carvalho Marques Serqueira
- Paulo Martins Soares Filho
- Patrícia Gomes de Souza
- Rene Ribeiro da Silva
- Sheila de Matos Xavier
- Silvio Orlan de Castro Chaves
- Soraya Cecilia Albieri Camillo
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Realizar a padronização, harmonização, atualização e a unificação dos procedimentos para execução de ensaios laboratoriais da área de Diagnóstico Animal |
|||
|
Processo: Análises Laboratoriais |
||||
|
Entrega: Segurança e saúde dos rebanhos animais |
Público alvo e demais interessados: Laboratórios oficiais ou credenciados do Ministério da Agricultura e Pecuária (Mapa) |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos é responsável pela elaboração, atualização e envio para aprovação deste manual, tendo responsabilidade quanto aos procedimentos descritos no documento. |
||||
¶ 1. Definições e conceitos
Não aplicável
¶ 2. Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário, no mínimo anualmente, pela Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos (CGAL/DTEC).
A gestão desse manual está sob a responsabilidade da CGAL/DTEC que prestará auxílio ao público alvo leitor dúvidas e/ou sugestões quanto à aplicação deste manual devem ser submetidas ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da SDA para acesso pelo público alvo será de responsabilidade da Secretaria representada pelo DTEC.
¶ 3. Objetivo
O objetivo do Manual é reunir os métodos analíticos a serem empregados na execução de ensaios laboratoriais da área de Diagnóstico Animal da Rede Nacional de Laboratórios Agropecuários (Rede LFDA e Laboratórios credenciados junto ao Ministério da Agricultura e Pecuária).
¶ 4. Procedimentos
¶ 4.1. Influenza Aviária - IA
4.1.1. Amostras
São consideradas amostras para o diagnóstico de influenza aviária:
4.1.1.1.Detecção da Resposta Imune
Soro sanguíneo.
4.1.1.2.Identificação do Agente
a) Aves Vivas
- Suabe de Cloaca;
- Suabe de Traqueia;
- Suabe de fundo de caixa; e
- Fezes frescas.
b) Aves Mortas, sacrificadas e Ovos com embriões mortos.
- Pulmão;
- Traqueia;
- Cérebro;
- Cerebelo;
- Intestino delgado com pâncreas; e
- Ceco com tonsilas cecais.
Nota: Somente serão recebidas Aves mortas decorrentes de colheitas realizadas pelo VIGIAGRO
c) Líquido Alantoide
4.1.2 Recebimento das Amostras
4.1.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.1.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
4.1.2.3. As amostras deverão ser encaminhadas ao laboratório, individualmente e obedecendo a critérios de biossegurança.
4.1.3 Técnicas de Diagnóstico
4.1.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo Legislação em vigor;
4.1.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.1.3.3. O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos.
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente.
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18 e 25 °C.
4.1.3.4. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios de interpretação dos resultados;
4.1.3.5. O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.1.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.1.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
¶ A. Ensaio Imunoenzimático (ELISA)
Material
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Selador ou tampa para placas de ELISA;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
Equipamentos e instrumentos
- Geladeira;
- Freezer -20ºC;
- Estufa;
- Termômetros;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional);
- Lavadora de microplacas (opcional); e
- Autoclave.
Insumos
- Kits de ELISA para a detecção de anticorpos para o vírus influenza A.
Soluções
- No preparo das soluções deve ser utilizado somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução; e
- Diluir a soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar bem.
Realização do ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
- Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente; e
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
Critérios de aceitação do ensaio
O resultado do ensaio será considerado válido somente se as Densidades Óticas (DOs) dos soros controles e os demais parâmetros calculados a partir delas estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
Interpretação dos resultados
- De acordo com as DOs obtidas, consideram-se as amostras como POSITIVAS ou NEGATIVAS ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico);
- Amostras positivas ao ELISA para detecção de anticorpos para influenza A deverão ser submetidas a ensaios confirmatórios; e
- Caso o laboratório não realize os ensaios confirmatórios, as amostras positivas deverão ser encaminhadas com a maior brevidade possível ao LFDA indicado pela CGAL para confirmação.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO” ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico).
- Expressar a quantidade de alíquotas positivas dentre o total de analisadas.
Descarte de Amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Soro sanguíneo
- Amostras podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras com resultado diferente de NEGATIVO deverão ser encaminhadas ao LFDA-SP para realização de ensaios complementares.
¶ B. Inibição da hemaglutinação para tipificação de anticorpos para o Vírus Influenza A
Materiais
- Luvas para procedimentos;
- Ponteiras descartáveis;
- Pipetas de 5, 10 e 20 mL;
- Reservatórios para pipetagem de líquidos;
- Ponteiras descartáveis;
- Microtubos;
- Microplacas com fundo em “V” ou em “U”;
- Papel absorvente;
- Filme adesivo ou tampa para microplacas; e
- Canetas para escrita em plástico/vidro.
Equipamentos e instrumentos
- Refrigerador;
- Freezer -20 °C;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou bulbo de segurança;
- Balança analítica ou semi-analítica;
- Microcentrífuga; e
- Autoclave.
Insumos
- Soros de referência para os 16 subtipos do vírus influenza A (H1 ao H16);
- Antígenos inativados de referência para os 16 subtipos do vírus influenza A (H1 ao H16); e
- Soro NEGATIVO para influenza A.
Soluções
- Suspensão de hemácias de Gallus gallus, preferencialmente machos, SPF (Specific Pathogen Free) ou SAN (Specific Antibody Negative) a 1%;
- Suspensão de hemácias de Gallus gallus, preferencialmente machos, SPF ou SAN a 10%;
- Solução de PBS 0,01 M pH 7,0 – 7,2 ou solução salina 0,85% a 0,90%; e
- Solução de PBS com 0,4% BSA-AS.
Realização do ensaio
Preparo dos antígenos – teste da hemaglutinação
- Para realização do ensaio de HI, é necessário que todos os antígenos padrões estejam com o título de quatro unidades hemaglutinantes (UHA) em 25 µL;
- Para isso, os antígenos devem ser titulados da seguinte forma:
- Adicione 25 µL de PBS ou solução salina a todos os poços de uma microplaca de fundo V;
- Adicione 25 µL do antígeno no primeiro poço e realize diluições seriadas na base 2, transferindo-se 25 µL do poço inicial ao segundo orifício e assim, sucessivamente, até o último orifício da linha, descartando-se os 25 µL finais;
- Adicione 25 µL de suspensão de hemácias 1%;
- Agitar levemente a placa, cobrir com adesivo ou tampa para evitar evaporação e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora a 4ºC;
- Ao final do período de incubação, realizar a leitura da prova para determinação do título do antígeno em unidades hemaglutinantes (UHA). O título deve ser lido como a maior diluição em que houve hemaglutinação completa;
- A partir dos resultados obtidos na etapa anterior, os antígenos devem ser diluídos em PBS com 0,4% BSA-AS de forma a se obter uma concentração de 4 UHA/25 µL. Após a diluição, os antígenos devem ser novamente titulados a fim de se verificar se a diluição realizada realmente resulta em 4 UHA/25 µL.
Preparo dos soros de referência
- Etapa facultativa. Os soros de referência podem ser diluídos a fim de otimizar o uso destes reagentes;
- Diluir os soros a um título entre 1:16 e 1:64 com solução PBS ou solução salina; e
- Utilizar o soro de referência como controle POSITIVO para seu respectivo antígeno no ensaio de HI.
Preparo das amostras de soro
- Verificar se as amostras de soro não apresentam hemaglutinação inespecífica. Para isso, adicionar a um poço de uma microplaca de fundo V ou U 25 μL de PBS ou solução salina, 25 μL da amostra, e 25 μL da suspensão de hemácia 1%;
- Agitar levemente a placa, cobrir com adesivo ou tampa para evitar evaporação e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora a 4ºC;
- Realizar a leitura da placa inclinando-a. Se houver a presença de “lágrima” escorrendo, indica que não houve auto aglutinação;
- Realizar o tratamento prévio das amostras autoaglutinantes conforme protocolo a seguir:
- Adicionar 100 μL de PBS ou solução salina a um microtubo ou a um orifício de uma microplaca;
- Adicionar 50 μL da amostra de soro a ser tratada;
- Adicionar 50 μL de uma suspensão de hemácias a 10%;
- Homogeneizar a cada 10 minutos, durante 30 minutos, a fim de manter as hemácias em suspensão; e
- Centrifugar por 4 minutos a 4000 RPM.
5. Utilizar o sobrenadante para realização da técnica de HI; e
6. Considerar que a diluição inicial da amostra é 1:4.
Técnica da inibição da hemaglutinação
- Dispensar 25 μL de PBS ou solução salina em cada orifício da microplaca a ser utilizada, com exceção dos orifícios de controle da hemácia que devem conter 50 μL;
- Colocar, com auxílio de micropipeta monocanal, 25 μL de cada amostra de soro a ser testada no primeiro orifício de cada linha da placa (FIGURA 1);
- Realizar diluições seriadas na base 2 de cada amostra com micropipeta multicanal, sempre homogeneizando várias vezes com a própria pipeta antes de passar para o próximo poço;
- Diluir até o sexto poço (p.e. até A6) para amostras de soro sem tratamento prévio ou diluição a 1:4; ou até o terceiro poço (p.e. até A3) para amostras previamente diluídas (1:4);
- Dispensar 25 μL de soro referência específico para o antígeno do ensaio (controle POSITIVO) em uma das linhas preenchidas com PBS ou solução salina, e realizar as diluições seriadas na base 2 da mesma forma que foi feito para as amostras. Para amostras pré-diluídas, realizar a mesma diluição para os soros referência;
- Dispensar 25 μL de soro controle NEGATIVO em uma das linhas preenchidas com PBS ou solução salina, realizar as diluições seriadas na base 2 da mesma forma que foi feito para as amostras;
- Reservar os orifícios da última linha para o controle das hemácias;
- Adicionar 25 μL do antígeno com quatro UHA em todos os orifícios da microplaca destinados àquele subtipo (exceto nos orifícios do controle das hemácias) e homogeneizar a placa suavemente;
- Cobrir a microplaca com adesivo ou tampa para evitar evaporação e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 ºC a 8ºC);
- Adicionar, em cada orifício, 25 μL de suspensão de hemácias a 1% e homogeneizar suavemente com leves batidinhas;
- Incubar a microplaca por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 ºC a 8ºC); e
- Realizar a leitura da placa inclinando-a e observando a presença ou ausência de “lágrima” escorrendo.
Critérios de aceitação do ensaio
- O teste será válido se:
- Os controles das amostras de soro não apresentarem hemaglutinação inespecífica;
- O controle de hemácias apresentar “lágrima” escorrendo;
- O antígeno utilizado possuir quatro UHA (determinado pelo ensaio de hemaglutinação);
- O controle NEGATIVO apresentar título inferior a 22 (1:4) e
- O controle POSITIVO apresentar título ≥ 24 (1:16).
2. Anotar os resultados em formulário próprio; e
3. Para as amostras pré-diluídas (1:4), as diluições na base 2 correspondem à diluição 1:8, 1:16 e 1:32.
Interpretação dos resultados
- Registrar os resultados em formulário próprio;
- Os poços com inibição completa devem formar uma "lágrima" semelhante àquela observada nos poços de controle POSITIVO. Os poços que apresentam “lágrima" com escoamento retardado em comparação com o controle POSITIVO devem ser interpretados como incompleto;
- O título de HI é a maior diluição do soro capaz de inibir completamente a hemaglutinação das 4 UHA do antígeno;
- São consideradas positivas aquelas amostras que apresentarem título ≥1:16; e
- São consideradas negativas as amostras que apresentarem título < 1:16.
FIGURA 1. Exemplo de marcação das placas para realização do teste de HI para subtipificação de anticorpos para o vírus influenza A.
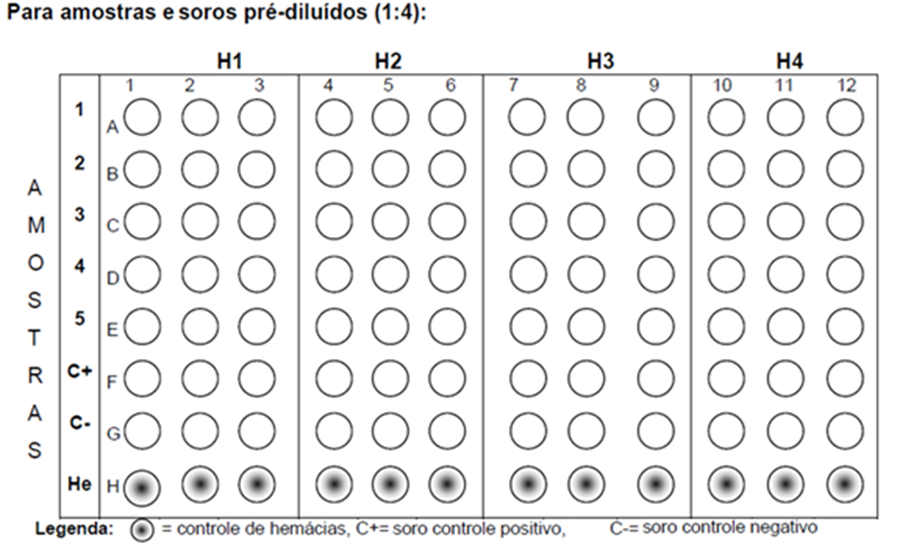
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”;
- Expressar a quantidade de soros “POSITIVOS” dentre o total analisado; e
- Em caso de positividade, indicar para qual subtipo do vírus influenza A a amostra foi positiva.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Soro sanguíneo
Amostras podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ C. Técnica da imunodifusão em gel-ágar (IDGA) para pesquisa de anticorpos para influenza A
Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Balão volumétrico;
- Ponteiras descartáveis;
- Placa de Petri de poliestireno de 100 mm de diâmetro;
- Descartador de ponteiras;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
Equipamentos
- Geladeira;
- Freezer;
- Micro-ondas;
- Micropipetas monocanal de volumes reguláveis;
- Pipetador automático ou manual;
- Balança analítica;
- Medidor de pH;
- Destilador ou deonizador de água;
- Centrifuga;
- Autoclave;
- Cortador de gel padrão;
- Câmara Úmida;
- Fonte de luz;
- Bomba de vácuo (opcional); e
- Autoclave.
Insumos
- Antígeno do vírus influenza A para prova de imunodifusão em ágar-gel - IDGA;
- Soro controle POSITIVO para vírus influenza A; e
- Soros controle forte- POSITIVO, fraco- POSITIVO e NEGATIVO para vírus influenza A.
Soluções
- Gel de ágar a 1% em PBS pH 7.2.
Realização do ensaio
Preparo dos reagentes
- Preparar o gel a 1% p/v de agarose ou ágar tipo II purificado, 8% p/v NaCl em 0,01 M PBS em pH 7.2, ou conforme orientação do fabricante dos insumos utilizados;
- Aquecer o gel no micro-ondas por tempo necessário para fusão completa, evitando o borbulhamento e extravasamento. Não efetuar sucessivas fusões do gel;
- Verter 16 ml a 17 ml do gel fundido e ainda quente em placa de Petri até uma espessura de, aproximadamente, 3 mm;
- Deixar o gel solidificando em superfície plana, em local livre de poeira e em temperatura 22°C ± 2°C por no máximo 30 minutos, para que a concentração eletrolítica não seja alterada;
- Após o gel solidificar, utilizando cortador de padrão hexagonal com as dimensões recomendadas pelo fabricante dos insumos, perfurar os poços de aproximadamente 5 mm de diâmetro no gel. As partes cortadas podem ser removidas da placa utilizando uma cânula conectada a uma bomba de vácuo através de uma mangueira;
- Identificar os poços de acordo com a amostra de soro que será adicionada a cada um deles utilizando caneta para vidro ou plástico;
- Se as placas de Petri contendo ágar não forem utilizadas imediatamente, armazená-las vedadas ou embaladas em plástico em câmara úmida ou geladeira para evitar o ressecamento do gel; e
- Não utilizar placa que apresente umidade nos poços da roseta. Desprezá-las ou remover a umidade. Caso apresentem ressecamento devem ser descartadas.
Preparo das amostras
- Identificar as amostras de soro de aves não-aquáticas a serem analisadas; e
- Caso seja recomendado pelo fabricante do antígeno, inativar amostras a 56 ± 1 °C por 30 minutos ou conforme instruções do fabricante.
Técnica do IDGA
- Preencher o formulário de acompanhamento do ensaio de IDGA;
- Distribuir aproximadamente 50 µL de cada amostra de soro em posições alternadas na periferia do hexágono. Nos poços adjacentes, acrescentar soro controle POSITIVO e ao poço central adicionar o antígeno;
- O volume adicionado deve ser suficiente para preencher o poço, coincidindo a parte superior do menisco com o nível do gel, tendo o cuidado de não derramar. Caso o fabricante do antígeno especifique o volume a ser utilizado, seguir suas recomendações adequando o tamanho do poço ou profundidade do gel ao volume indicado;
- Para cada grupo de amostras a ser testado, deve ser incluída uma roseta contemplando os soros controle fraco - POSITIVO, forte - POSITIVO e NEGATIVO;
- Incubar as placas em câmara úmida à temperatura de 22°C ± 2°C por 24 horas. Recomenda-se colocar um chumaço de algodão ou papel toalha molhado dentro da câmara para manter o ambiente úmido; e
- Após a incubação, proceder a leitura das placas abertas sobre uma fonte de luz contra um fundo escuro.
Critérios de aceitação
- As linhas de precipitação que indicam a interação antígeno-anticorpo devem se formar entre os poços em que foram adicionados os soros controle sabidamente “POSITIVOS” e o antígeno;
- Os soros controles fraco - POSITIVO e forte - POSITIVO devem apresentar linhas de precipitação dentro do esperado;
- O soro controle NEGATIVO não deve apresentar linha de precipitação; e
- Caso as linhas estejam fracas para serem visualizadas, incubar por mais 24 horas e realizar a leitura novamente.
Interpretação dos resultados
- NEGATIVO: as linhas formadas entre o antígeno e o soro controle POSITIVO prolongam-se até a cavidade onde se encontra a amostra testada, sem encurvar-se (FIGURA 2 – Posição B);
- POSITIVO: as linhas formadas entre o antígeno e o soro controle POSITIVO se fundem com aquela formada pela amostra testada, formando uma linha contínua de identidade total (FIGURA 2 – Posição F);
- Variações de reações positivas: fraco POSITIVO: a linha de precipitação tende a se formar mais próximo à cavidade onde se encontra a amostra testada, visualizando-se somente uma convergência das duas linhas do controle na direção da cavidade onde se encontra a amostra (FIGURA 2 – Posição D); e
- Reações inespecíficas: caso se formem linhas de precipitação entre o poço do soro analisado e o controle POSITIVO (FIGURA 3 – Posições F e B), essas devem ser desconsideradas, pois são inespecíficas. Caso as linhas de precipitação de um controle POSITIVO e uma amostra se cruzem, indo de encontro ao poço adjacente (FIGURA 3 – Posição D), isso também indica reação inespecífica e deve ser desconsiderada.
FIGURA 2. Padrão de disposição de amostras em placa de imunodifusão.
Nas posições A, C e E, foi adicionado soro controle POSITIVO. Na posição F, soro teste POSITIVO. Em B, soro teste NEGATIVO. Em D, soro teste fraco POSITIVO.
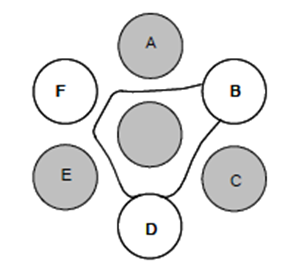
FIGURA 3. Placa de imunodifusão com exemplos de linhas de precipitação inespecíficas formadas a partir dos poços contendo soro teste em F, B e D.
Elas podem ser desconsideradas, desde que as linhas de precipitação específicas formadas a partir dos controles “POSITIVOS” em A, C e E possam ser visualizadas.
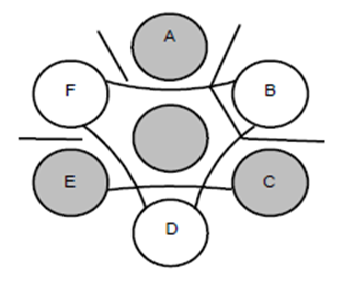
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de amostras positivas dentre o total de amostras analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Soro sanguíneo
- Amostras podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras com resultado diferente de NEGATIVO deverão ser encaminhadas ao LFDA-SP para realização de ensaios complementares.
¶ D. Isolamento viral
Materiais
- Luvas de procedimento;
- Algodão hidrófilo embebido em álcool 70º INPM;
- Micropipetas mono e multicanal de capacidade mínima de 25 µL;
- Ponteiras para micropipeta capacidade mínima de 25 µL;
- Seringas descartáveis de 1 mL, com precisão de 0,1 mL com agulhas 27 G ½” ou similares;
- Filtro descartável de 22 µm de porosidade para seringas;
- Microplacas em poliestireno de 96 orifícios com fundo em “V” ou em “U”;
- Tubos de centrífuga com tampa rosqueável;
- Tesouras e pinças dente-de-rato estéreis;
- Frascos de plástico com tampas perfuráveis;
- Gaze;
- Toalhas absorventes descartáveis;
- Filme adesivo para microplacas;
- Sacos de autoclave;
- Cuba de plástico autoclavável;
- Caneta para escrita em plástico/vidro; e
- Etiquetas autoadesivas.
Equipamentos e instrumentos
- Cabine de segurança biológica, classe II A2;
- Autoclave de fronteira;
- Estufa;
- Geladeira;
- Freezer;
- Ultrafreezer;
- Triturador de tecidos com sondas;
- Furador de ovos;
- Ovoscópio;
- Incubadora de ovos;
- Centrífuga refrigerada;
- Agitador tipo vórtex; e
- Autoclave.
Insumos
- Ovos embrionados SPF com 9 a 11 dias de incubação;
- Caldo BHI ou MEM com solução de antibióticos 10X;
- Caldo BHI; e
- Placas de ágar sangue ou ágar BHI.
Soluções
- Suspensão de hemácias de Gallus gallus, preferencialmente machos, SPF ou SAN a 1%.
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado ou hipoclorito de sódio 2-2,5% ou outro produto com ação viricida comprovada; e
- Solução de álcool 70° INPM.
Realização do ensaio
Processamento dos itens de ensaio
- As amostras colhidas de aves mortas podem ser coletadas e processadas separadamente ou em “pools” de um mesmo sistema orgânico (respiratório, digestório ou nervoso); e
- Quando o processamento não for imediatamente possível, estocar as amostras entre 2ºC e 8ºC por até 4 dias. Para estocagem prolongada, as amostras devem ser mantidas à temperatura de -70ºC a -80ºC.
Processamento de suabes traqueais, cloacais, de fundo de gaiola e fezes
- Os suabes colhidos e acondicionados individualmente podem ser agrupados em “pools” de cinco a sete por tipo de suabe e espécie;
- Caso não haja volume suficiente de material para inoculação, pode ser preparado um “pool” com suabes de traqueia e cloaca;
- Os frascos contendo fezes em meio de transporte devem ser centrifugados a 1000 g por 10 minutos e o sobrenadante recolhido em frasco contendo 1,5 ml de caldo BHI contendo antibióticos;
- Os frascos contendo os inóculos devem ser identificados de forma a permitir a rastreabilidade da amostra; e
- Caso o material não seja utilizado no mesmo dia, os frascos deverão ser armazenados sob refrigeração (2 ºC a 8ºC) por até 24 horas. Para estocagem prolongada, as amostras devem ser mantidas à temperatura de -70ºC a -80ºC.
Processamento de amostras provenientes de órgãos
- Picotar os tecidos finamente, triturá-los e preparar suspensões em caldo BHI ou meio MEM contendo solução de antibióticos 10X em tubos de centrífuga;
- Centrifugar as suspensões a 1000 g por 10 minutos, recolher o sobrenadante e armazená-lo em um frasco devidamente identificado de forma a manter a rastreabilidade da amostra; e
- Aguardar um período maior ou igual a quatro horas para a inoculação (para a ação da solução de antibióticos). Caso não seja utilizado no mesmo dia, conservá-lo entre 2ºC e 8ºC por até 24 horas. Para estocagem prolongada, as amostras devem ser mantidas à temperatura de -70ºC a -80ºC.
Isolamento viral
- Antes da inoculação realizar ovoscopia nos ovos embrionados que serão inoculados a fim de se detectar embriões mortos ou fracos para que sejam descartados;
- Devem ser feitos os seguintes controles de prova: controle do meio com antibióticos utilizado no preparo dos inóculos, controle dos ovos SPF utilizados para inoculação e controle de esterilidade dos inóculos;
- Em cabine de segurança biológica, com auxílio de uma seringa estéril descartável de 1 ou 3 mL com agulha 27 G ½” ou similar, inocular via cavidade alantoide 0,3 mL da amostra em, no mínimo, 4 ovos embrionados SPF com idade entre 9 e 11 dias devidamente identificados de forma a manter a rastreabilidade das amostras;
- Selar o orifício de inoculação, aguardar a secagem do selante e borrifar álcool 70° INPM antes da retirada dos ovos inoculados da cabine de segurança biológica;
- Incubar os ovos inoculados a 37 ± 2°C por 4 a 7 dias, realizando-se ovoscopia diariamente. Descartar ovos com embriões mortos nas primeiras 24 horas. Registrar o número de ovos mortos de cada um dos inóculos em formulários próprios e armazená-los à temperatura de 2 a 8°C até o término do teste, identificando-os com a data da ovoscopia;
- Sacrificar os ovos viáveis no final do teste, submetendo-os à temperatura de refrigeração overnight (2 a 8°C) ou 1,5 h em ultrafreezer (-70ºC a -80ºC);
- Coletar 1 a 2 mL do líquido alantoide dos ovos de cada inóculo em tubo de centrifugação, centrifugando-se a 1000 g por 10 minutos;
- Verificar a atividade hemaglutinante do “pool” do líquido alantoide por meio da técnica de hemaglutinação (HA) em microplaca;
- Verter aproximadamente 5 mL do “pool” de cada material que apresentar reação negativa na hemaglutinação em frasco estéril contendo 1,5 mL de caldo BHI ou MEM contendo solução de antibióticos 10X e identificar como 1ª passagem;
- Inocular o líquido alantoide referente à 1ª passagem em, no mínimo, 04 ovos embrionados SPF para realização da segunda passagem;
- Ao final da segunda passagem, se os ovos ainda apresentarem-se NEGATIVOS na técnica de HA, preparar um “pool” de cada material e encaminhá-lo para realização de RT-PCR ou RT-qPCR a fim de confirmar a negatividade do mesmo;
- Caso o material seja POSITIVO no RT-PCR ou RT-qPCR, nova passagem pode ser realizada a fim de aumentar o título viral;
- Se o “pool” do material apresentar reação positiva no teste de HA em qualquer uma das passagens, o líquido alantoide dos ovos deve ser coletado, centrifugado à 1000 g por 10 minutos e dividido em duas alíquotas, uma com e outra sem caldo BHI ou MEM contendo solução de antibióticos 10X; e
- Utilizar a alíquota sem antibióticos nas provas de identificação viral (HI) e caracterização viral através do Índice de patogenicidade intravenosa (IVPI).
Critérios de aceitação do ensaio
O teste será válido se:
- Os ovos destinados ao controle do meio não apresentarem mortalidade e atividade hemaglutinante;
- Os ovos SPF não inoculados, destinados ao controle, não apresentarem mortalidade e atividade hemaglutinante; e
- O controle de esterilidade dos inóculos for NEGATIVO.
Interpretação dos resultados
- O material será considerado POSITIVO no isolamento viral quando houver detecção de atividade hemaglutinante no líquido alantoide dos ovos inoculados ou detecção do RNA viral por RT-PCR ou RT-qPCR; e
- O material será considerado NEGATIVO quando, após duas passagens consecutivas em ovos embrionados SPF, não houver detecção de atividade hemaglutinante e detecção do RNA viral por RT-PCR ou RT-qPCR.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Descarte de Amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Líquido alantoide
- Todas as alíquotas (passagens) das amostras que resultarem positivas no isolamento viral e/ou no RT-PCR ou RT-qPCR deverão ser mantidas pelo laboratório e armazenadas à -70°C ou temperaturas inferiores por tempo indeterminado. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário; e
- Alíquotas negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ E. Inibição da hemaglutinação para identificação viral (HI)
Materiais
- Luvas para procedimentos;
- Algodão hidrófilo;
- Ponteiras descartáveis;
- Pipetas de 5, 10 e 20 mL;
- Microplacas em poliestireno de 96 orifícios com fundo em “V” ou em “U”;
- Tubos de centrífuga com tampa rosqueável;
- Reservatórios para pipetagem de líquidos;
- Papel absorvente;
- Cuba de plástico autoclavável;
- Filme adesivo para microplacas; e
- Caneta para escrita em plástico/vidro.
Equipamentos e instrumentos
- Cabine de segurança biológica, classe II A2;
- Refrigerador;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou bulbo de segurança;
- Agitador tipo vórtex; e
- Autoclave.
Insumos
- Líquido alantoide coletado dos ovos referentes ao material com atividade hemaglutinante verificado anteriormente;
- Soros controles de referência para os 16 subtipos do vírus influenza A (H1 ao H16); e
- Antígenos inativados de referência para os 16 subtipos do vírus influenza A (H1 a H16).
Soluções
- Suspensão de hemácias de Gallus gallus, preferencialmente machos, SPF ou SAN a 1%;
- Solução de PBS pH 7,2 ± 0,2 ou solução salina 0,85% a 0,90%;
- Solução de PBS com 0,4% BSA-AS;
- Solução de álcool 70º INPM; e
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado, hipoclorito de sódio 2-2,5% ou outro produto com ação virucida.
Realização do ensaio
Determinação do título do antígeno em unidades hemaglutinantes (UHA)
- Realizar a titulação do líquido alantoide infectado, coletado dos ovos referentes ao material com atividade hemaglutinante;
- Para realização da prova de HI para identificação viral, é necessário que o antígeno (líquido alantoide infectado) esteja com quatro unidades hemaglutinantes (UHA) em 25 µL;
- Para obtenção dessas quatro UHA, diluir o antígeno em solução de PBS com 0,4% BSA-AS, conforme a Nota;
- De acordo com o exemplo, diluir o antígeno a 1:64 (1 mL de antígeno para 63 mL de solução de PBS com 0,4% BSA-AS, ou dividir esta proporção por 10, utilizando-se 100 µL de antígeno para 6,3 mL de PBS com 0,4% BSA-AS) para se obter as quatro UHA;
- Fazer outras duas diluições do antígeno para se ter uma margem de segurança maior. Nesse caso, preparar duas novas diluições contendo, respectivamente, 50% a mais e 50% a menos do volume inicial de antígeno utilizado no preparo da primeira diluição; e
- Após o preparo das diluições, realizar uma nova titulação (retrotitulação) a fim de determinar em qual das três diluições encontram-se as quatro UHA. Essa é, então, a diluição a ser empregada como antígeno na prova de HI.5. Registrar em formulário próprio.
Nota: Título no HA = 28 (256 UHA), sendo que o título é a maior diluição do antígeno capaz de produzir aglutinação completa (“endpoint”) e equivale a uma UHA. Portanto, encontraremos quatro UHA dividindo o valor do “endpoint” por quatro. Exemplo: 256 ÷ 4 = 64.
Descrição da técnica de HI
- O controle da reação de inibição da hemaglutinação será feito pela utilização de antígenos inativados de referência para os 16 subtipos do vírus influenza A (H1 a H16) e seus respectivos antissoros;
- Dispensar 25 µL de PBS pH 7,2 ± 0,2 ou solução salina 0,85% a 0,90% em cada orifício da microplaca a ser utilizada;
- Colocar, com auxílio de micropipeta monocanal, 25 µL de cada antissoro de referência no primeiro orifício de cada fileira da placa, reservando-se as colunas 9, 10 e 11 para o controle POSITIVO e a última coluna para o controle das hemácias (FIGURA 4 e FIGURA 5);
- Realizar diluições seriadas na base 2 com micropipeta multicanal, e para isso:
- Aspirar 25 µL do primeiro orifício da linha (p.e., orifício A1);
- Dispensar os 25 µL no segundo orifício da mesma linha (p.e., A2);
- Homogeneizar três vezes com auxílio da micropipeta; e
- Aspirar 25 µL e dispensar no próximo orifício da mesma linha (p.e., A3);
5. Repetir os passos “c” e “d” por quatro vezes (p.e. até A8);
6. Dispensar 25 μL de cada antissoro de referência na coluna 9 (p.e. até A9) e realizar a diluição na base 2 até a coluna 11 (p.e. até A11);
7. Dispensar 25 μL de antígeno de referência (com 4 UHA) homólogo para cada antissoro de referência nos orifícios das colunas 9, 10 e 11;
8. Adicionar 25 µL do antígeno/vírus com quatro UHA em cada orifício da microplaca até a coluna 8 e homogeneizar suavemente;
9. Cobrir a microplaca com adesivo para evitar evaporação e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8°C);
10. Adicionar, em cada orifício, 25 μL de suspensão de hemácias de galinha a 1% (completamente suspendida) e homogeneizar suavemente;
11. Incubar a microplaca por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8°C); e
12. Realizar a leitura da placa inclinando-a e observando a presença ou ausência de “lágrima” escorrendo e registrar os resultados em formulário próprio.
FIGURA 4. Disposição dos antissoros hemaglutinantes para subtipos IA e do controle de hemácias (HE) na microplaca para realização do teste de HI para identificação viral. As colunas 9, 10 e 11 são dedicadas aos controles “POSITIVOS” de cada subtipo viral.
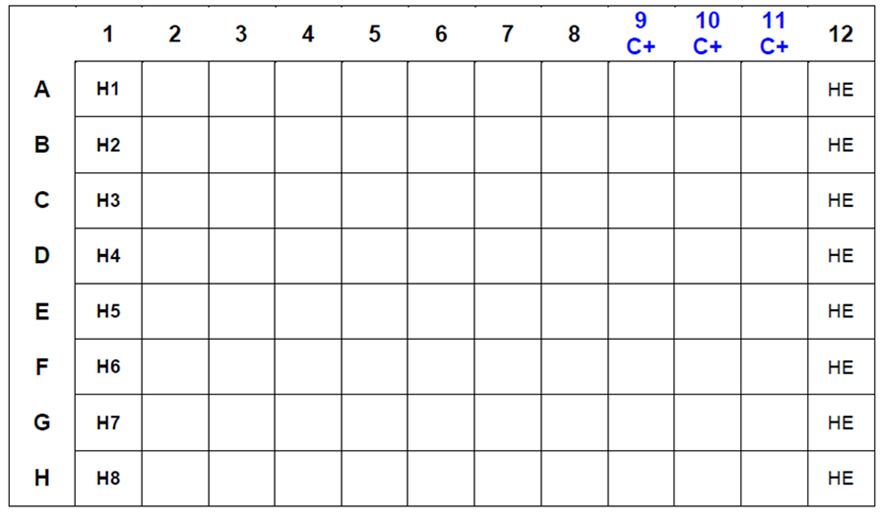
FIGURA 5. Disposição dos antissoros hemaglutinantes para subtipos IA e do controle de hemácias (HE) na microplaca para realização do teste de HI para identificação viral. As colunas 9, 10 e 11 são dedicadas aos controles “POSITIVOS” de cada subtipo viral.
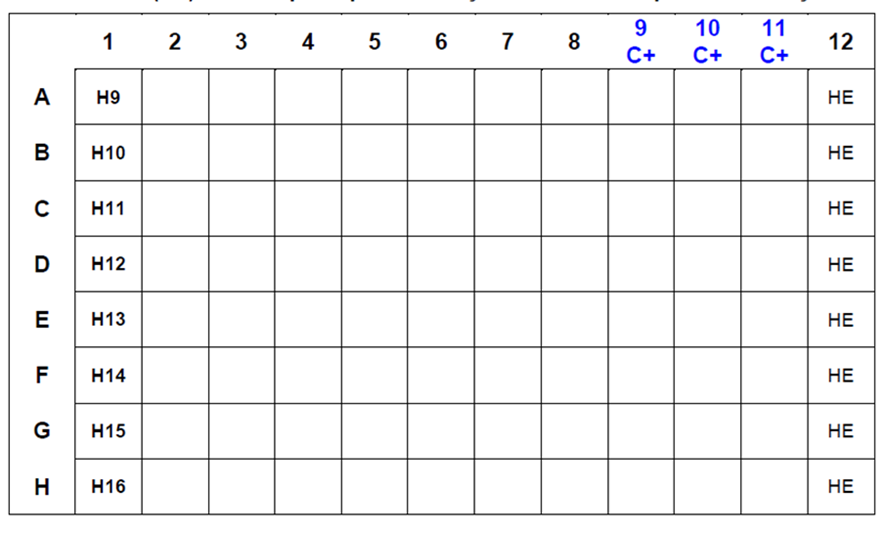
Critérios de aceitação do Ensaio
O teste será válido se:
- O vírus a ser identificado possuir, pelo menos, 4 UHA (determinado pelo ensaio de hemaglutinação);
- O controle de hemácias não apresentar aglutinação (apresentar “lágrima” escorrendo); e
- Os antissoros de referência para cada subtipo do vírus influenza A inibirem a hemaglutinação dos respectivos antígenos.
Interpretação dos resultados
- Os poços com presença de “lágrima” são registrados como “+” (POSITIVO para HI); poços com ausência de “lágrima”, isso é com completa hemaglutinação, são registrados como “-” (NEGATIVO para HI); poços com formação de “lágrima” incompleta são registrados como “I” (HI incompleto);
- Os poços com inibição completa devem formar uma "lágrima" na mesma taxa de velocidade dos poços de controle POSITIVO. Os poços que apresentam “lágrima" com escoamento retardado em comparação com o controle POSITIVO devem ser interpretados como incompleto;
- O título de HI é dado como a maior diluição do soro capaz de causar inibição completa das quatro UHA do vírus em teste. Considerar somente as cavidades que apresentarem botão de hemácias igual ao das cavidades controle, anotando no formulário próprio; e
- O material será considerado POSITIVO quando a sua atividade hemaglutinante for inibida por antissoro específico para um determinado subtipo do vírus influenza A.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” para vírus influenza A subtipo (especificar o subtipo)” ou “NEGATIVO para vírus influenza A”; e
- Indicar a alíquota que apresentou positividade.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”.
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Líquido alantoide
- Todas as alíquotas (passagens) das amostras que resultarem positivas no isolamento viral e/ou no RT-PCR ou RT-qPCR deverão ser mantidas pelo laboratório e armazenadas à -70 °C ou temperaturas inferiores por tempo indeterminado. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário; e
- Alíquotas negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ G. Índice de patogenicidade intravenosa (IVPI)
Materiais
- Luvas para procedimentos;
- Seringas descartáveis de 1 mL, com precisão de 0,1 mL com agulhas de 27 G ½” ou similares;
- Pipetas de 5 mL;
- Frascos de vidro de 5 mL com tampas perfuráveis;
- Algodão hidrófilo;
- Gaze;
- Papel absorvente; e
- Cubas autoclaváveis.
Equipamentos e instrumentos
- Cabine de segurança biológica classe II A2;
- Isolador para aves;
- Estufa; e
- Autoclave.
Insumos
- Aves Gallus gallus SPF de 6 semanas de idade;
- Placas de ágar sangue ou ágar BHI;
- Líquido alantoide infectado (antígeno), com título em HA ≥ 24 (16);
- Anestésicos (cloridrato de quetamina e de xilasina); e
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado, hipoclorito de sódio 2-2,5% ou outro produto com ação virucida.
Soluções
- Solução de PBS pH 7.2 ± 0,2 estéril ou solução salina isotônica; e
- Solução de álcool 70º INPM.
Realização do ensaio
- Diluir o líquido alantoide a 1:10 em solução de PBS pH 7.2 ± 0,2, ou solução salina isotônica. Por exemplo: 0,5 em 4,5 mL de PBS;
- Inocular por via intravenosa, no interior do isolador, 10 aves de 6 semanas de idade com 0,1 mL do líquido alantoide diluído;
- Utilizar mais 4 aves como controle do teste, sendo que duas serão inoculadas por via intravenosa com 0,1 mL de PBS e as outras duas não serão inoculadas;
- Semear o inóculo utilizado em caldo BHI e/ou placa de ágar sangue ou ágar BHI e incubar a 37ºC ± 2 °C por 48 horas (ágar sangue) ou 24 horas (BHI);
- Realizar leituras diárias das aves, por um período de 10 dias, registrando-se o número de aves saudáveis, doentes, paralíticas e mortas em formulário próprio; e
- Caso seja verificada contaminação do inóculo no decorrer do período de teste, o mesmo será invalidado. Filtrar e/ou tratar o antígeno (material POSITIVO para influenza A) com antibióticos e realizar nova inoculação em aves.
Critérios de aceitação do ensaio
O teste será válido se:
- As aves inoculadas com PBS se mantiverem saudáveis;
- As aves não inoculadas se mantiverem saudáveis; e
- Não houver crescimento microbiano no caldo ou placa utilizados para o controle de esterilidade do inóculo.
Interpretação dos resultados
Somar, ao final do teste, o número de aves saudáveis, doentes, paralíticas e mortas e multiplicar pela seguinte pontuação:
- 0 = aves saudáveis;
- 1 = aves doentes;
- 2 = aves paralíticas; e
- 3 = aves mortas.
A seguir, somar todos os pontos e dividir por 100 (pois são 100 observações: 10 aves observadas por 10 dias) para obtenção do IVPI. Serão considerados de alta patogenicidade aqueles isolados de vírus da influenza aviária com IVPI ≥ 1,2. Isolados com IVPI < 1,2 serão considerados como de baixa patogenicidade.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “vírus da influenza aviária de alta patogenicidade” ou “vírus da influenza aviária de baixa patogenicidade”; e
- Indicar o valor do IVPI nos resultados.
Descarte das amostras e resíduos
- Após a finalização do teste, as aves sobreviventes devem ser eutanasiadas dentro das unidades isoladoras, mediante anestesia prévia;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido aos processos de desinfecção e autoclavação apropriados. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de Itens de ensaio
Após a finalização do ensaio as aves devem ser eutanasiadas e descartadas.
¶ H. Técnica de RT-qPCR para detecção de influenza A
Nota: O laboratório pode optar por realizar a técnica de PCR em tempo real com um kit comercial ou protocolo “in house”. Ambos necessitam de comprovação de desempenho.
Materiais
- Luvas de procedimento nitrílicas ou de látex isentas de pó;
- Microtubos de volumes variados ou microplacas;
- Microplacas ou microtubos para leitura óptica de RT-qPCR;
- Tampas adesivas para microplacas para leitura óptica de RT-qPCR;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
Equipamentos e instrumentos
- Cabine de segurança biológica com filtro HEPA classe II ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Termociclador para PCR em tempo real;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Microcomputador; e
- Equipamento para extração automatizada de ácidos nucleicos (opcional).
Insumos
- Água livre de nucleases;
- Controle interno de extração
- Controle POSITIVO para influenza A;
- Kit para extração de RNA e
- Kit comercial para detecção de influenza A por RT-qPCR em um único passo; ou
- Iniciadores (primers) e sondas específicos para a detecção do vírus influenza A (sugestão de iniciadores apresentada no Quadro 1).
QUADRO 1: Sugestão de oligonucleotídeos para detecção do vírus influenza A por PCR em tempo real.
|
Alvo |
Primer forward |
Primer reverse |
Sondas |
Referência |
| Gene M | M+25 5’ aga tga gtc ttc taa ccg agg tcg 3’ | M-124 5’ tgc aaa aac atc ttc aag tct ctg 3’ | M+64 5’ FAM - tca ggc ccc ctc aaa gcc ga - BHQ1 3’ | Spackman, 2002 |
Soluções
- Solução de álcool 70º INPM;
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses; e
- Solução de hipoclorito de sódio 0,5%.
Realização do ensaio
Extração de ácidos nucleicos
- Realizar a extração de ácidos nucleicos das amostras, de forma automatizada ou manual, através de kits de extração de RNA específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Adicionar a cada procedimento de extração: controle NEGATIVO de extração (meio de cultura MEM ou BHI contendo ou não suabes de aves SPF) e controle interno de extração; e
- O laboratório pode optar pelo uso de outro método de extração que não use kit, desde que apresente verificação de desempenho comprovada pelo próprio laboratório.
Reação de amplificação de ácido nucleico por RT-qPCR
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR) isenta de material genético e amplicons, e outra para a transferência de RNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com Solução descontaminante de moléculas residuais de RNAs/ DNAs/amplicons/resíduos de proteínas de superfícies, entre as quais DNAses/RNAses;
- Álcool 70º INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
Preparo do mix de reação
- Preparar o mix de reação de acordo com protocolos validados e específicos para o agente pesquisado, em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Após o preparo do mix, adicionar o RNA nos poços da placa ou em microtubos para leitura óptica;
- A adição de RNA e das amostras controle deve ser realizada em uma área distinta do preparo do mix (sala de PCR);
- Devem ser incluídos nas análises:
- Controle POSITIVO para influenza A;
- Controle NÃO DETECTADO da extração;
- Branco (água livre de nucleases); e
- Controle DETECTADO e NÃO DETECTADO do kit utilizado (se houver).
Reação de RT-qPCR
- Selar a placa com adesivo óptico ou fechar a tampa dos microtubos. Verificar se há bolhas no fundo do poço e/ou gotículas na parede dos poços da placa ou tubo. Caso isto ocorra, centrifugar brevemente para reduzir as bolhas e para que o conteúdo se posicione na parte inferior da placa ou tubo;
- Iniciar e entrar com os dados no software do termociclador (identificação das amostras e seleção dos fluoróforos, conforme especificações do fabricante;
- Inserir a placa ou os tubos no termociclador, salvar o arquivo e iniciar a corrida; e
- Ao finalizar, salvar os dados e interpretar os resultados.
Critérios de aceitação do ensaio
- Para a validação do ensaio, o controle POSITIVO do kit e o controle interno devem apresentar uma curva sigmoide (em forma de S) e um Cq satisfatório (conforme especificações do fabricante); e
- O controle NEGATIVO deve ter Cq indeterminado ou maior que o limite do kit. O gráfico do controle NEGATIVO deve apresentar traços de fluorescência na linha de base durante todo o ensaio. Esses traços não devem apresentar curva sigmoide ou um aumento gradual na fluorescência.
Interpretação dos resultados
- Ao analisar os resultados da corrida, o operador deve avaliar os seguintes componentes: controle POSITIVO, controle NEGATIVO, controle da extração, background de fluorescência e gráficos de amplificação de cada amostra individualmente. Após a validação do ensaio, interpretar os resultados conforme especificações do fabricante;
- Qualquer amostra questionável deverá ser retestada; e
- Amostras com resultado diferente de NEGATIVO deverão ser encaminhadas ao LFDA-SP para realização de ensaios complementares.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”, ou de acordo com o preconizado pelo fabricante; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Nota: Os RT-qPCR subtipo-específicos serão realizados exclusivamente no laboratório de referência de acordo com os protocolos vigentes.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos “Retenção de itens de ensaio”;
- Todo o material utilizado na realização do ensaio deve ser submetido aos processos de desinfecção e autoclavação apropriados. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de Itens de ensaio
- Amostras negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras com resultado diferente de NEGATIVO no RT-qPCR para detecção de influenza A deverão ser encaminhadas ao LFDA-SP para a realização de ensaios complementares.
¶ 4.2 Doença de Newcastle - DNC
4.2.1. Amostras
São consideradas amostras para o diagnóstico de influenza aviária:
4.2.1.1.Detecção da Resposta Imune
Soro sanguíneo.
4.2.1.2.Identificação do Agente
a) Aves Vivas
- Suabe de Cloaca;
- Suabe de Traqueia;
- Suabe de fundo de caixa; e
- Fezes frescas.
b) Aves Mortas, sacrificadas e Ovos com embriões mortos.
- Pulmão;
- Traqueia;
- Cérebro;
- Cerebelo;
- Intestino delgado com pâncreas; e
- Ceco com tonsilas cecais.
Nota: Somente serão recebidas Aves mortas decorrentes de colheitas realizadas pelo VIGIAGRO
c) Líquido Alantoide
4.2.2 Recebimento das Amostras
4.2.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.2.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
4.2.2.3. As amostras deverão ser encaminhadas ao laboratório, individualmente e obedecendo a critérios de biossegurança.
4.2.3 Técnicas de Diagnóstico
4.2.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo Legislação em vigor;
4.2.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.2.3.3. O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos.
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente.
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18 e 25 °C.
4.2.3.4. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios de interpretação dos resultados;
4.2.3.5. O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.2.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.2.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
¶ A. Ensaio Imunoenzimático (ELISA)
Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Reservatório para soluções (cubetas);
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Selador ou tampa para placas de ELISA;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
Equipamentos e instrumentos
- Geladeira;
- Freezer -20ºC;
- Estufa;
- Termômetros;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional);
- Lavadora de microplacas (opcional); e
- Autoclave.
Insumos
- Kits de ELISA para a detecção de anticorpos para o vírus da doença de Newcastle.
Soluções
- No preparo das soluções devem ser utilizados somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução; e
- Diluir as soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar bem.
Realização do ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
- Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente; e
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
Critérios de aceitação do ensaio
O resultado do ensaio será considerado válido somente se as Densidades Óticas (DOs) dos soros controles e os demais parâmetros calculados a partir delas estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
Interpretação dos resultados
- De acordo com as DOs obtidas, consideram-se as amostras como POSITIVAS ou NEGATIVAS ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico); e
- Amostras com DO entre os dois pontos de corte estabelecidos serão consideradas inconclusivas e deverão ser novamente ensaiadas.
Emissão de resultados
- Os resultados deverão ser emitidos e expresso como POSITIVO ou NEGATIVO ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico); e
- Expressar a quantidade de alíquotas positivas dentre o total de analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo o resíduo biológico do ensaio deve ser submetido aos processos de desinfecção e autoclavação apropriados. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Soro sanguíneo
- Amostras negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras com resultado diferente de NEGATIVO deverão ser encaminhadas ao LFDA-SP para realização de ensaios complementares.
¶ B. Inibição da hemaglutinação para detecção de anticorpos para o vírus da doença de Newcastle
Materiais
- Luvas para procedimentos;
- Ponteiras descartáveis;
- Pipetas de 5, 10 e 20 mL;
- Reservatórios para pipetagem de líquidos;
- Ponteiras descartáveis;
- Microtubos;
- Microplacas com fundo em “V” ou em “U”;
- Papel absorvente;
- Filme adesivo ou tampa para microplacas; e
- Canetas para escrita em plástico/vidro.
Equipamentos e instrumentos
- Refrigerador;
- Freezer -20 °C;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou bulbo de segurança;
- Autoclave;
- Balança analítica ou semi-analítica;
- Microcentrífuga; e
- Autoclave.
Insumos
- Soro de referência para AOaV-1;
- Antígeno inativado para AOaV-1; e
- Soro NEGATIVO para AOaV-1.
Soluções
- Suspensão de hemácias de Gallus gallus (preferencialmente machos) SPF ou SAN a 1%;
- Suspensão de hemácias de Gallus gallus (preferencialmente machos) SPF ou SAN a 10%;
- Solução de PBS, pH 7,2 ± 0,2 ou solução salina 0,85% a 0,90%; e
- Solução de PBS com 0,4% BSA-AS.
Realização dos ensaios
Preparo do antígeno – teste da hemaglutinação
- Para realização do ensaio de HI, é necessário que o antígeno padrão esteja com o título de quatro unidades hemaglutinantes (UHA) em 25 µL;
- Para isso, o antígeno deve ser titulado da seguinte forma:
- Adicione 25 µL de PBS ou solução salina a todos os poços de uma microplaca de fundo V;
- Adicione 25 µL do antígeno no primeiro poço e realize diluições seriadas na base 2, transferindo-se 25 µl do poço inicial ao segundo orifício e assim, sucessivamente, até o último orifício da linha, descartando-se os 25 µl finais;
- Adicione 25 µL de suspensão de hemácias a 1%;
- Agite e placa dando leves batidinhas, cobrir a microplaca e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora a 4ºC;
- Ao final do período de incubação, realizar a leitura da prova para determinação do título do antígeno em unidades hemaglutinantes (UHA). O título deve ser lido como a maior diluição em que houve hemaglutinação completa; e
- A partir dos resultados obtidos na etapa anterior, o antígeno deve ser diluído em PBS com 0,4% BSA-AS de forma a se obter uma concentração de 4 UHA/25 l. Após a diluição, o antígeno deve ser novamente titulado a fim de se verificar se a diluição realizada realmente resulta em 4 UHA/25 l.
Preparo do soro de referência
- Etapa facultativa: o antissoro pode ser diluído a fim de otimizar o uso deste reagente;
- Diluir o soro a um título entre 1:16 e 1:64 com solução de PBS (solução salina fosfatada tamponada) pH 7.2 ± 0.2 ou solução salina 0,85%; e
- Determinar o título pelo ensaio de HI (inibição da hemaglutinação) com 4 UHA do antígeno homólogo.
Preparo das amostras de soro
- Verificar se as amostras de soro não apresentam hemaglutinação inespecífica, e para isso, adicionar a um poço de uma microplaca de fundo V ou U 25 μL de PBS ou solução salina, 25 μL da amostra, e 25 μL da suspensão de hemácia 1%;
- Agitar a placa levemente, cobrir a microplaca e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8 °C);
- Realizar a leitura da placa inclinando-a. Se houver a presença de “lágrima” escorrendo, indica que não houve autoaglutinação;
- Realizar o tratamento prévio das amostras autoaglutinantes conforme protocolo a seguir:
- Adicionar 100 μL de PBS pH 7.2 ± 0.2 ou solução salina 0,85% a um microtubo ou a um orifício de uma microplaca;
- Adicionar 50 μL da amostra de soro a ser tratada;
- Adicionar 50 μL de uma suspensão de hemácias a 10%;
- Homogeneizar a cada 10 minutos, durante 30 minutos, a fim de manter as hemácias em suspensão; e
- Centrifugar por 4 minutos a 4000 RPM;
5. Utilizar o sobrenadante para realização da técnica de HI; e
6. Considerar que a diluição inicial da amostra é 1:4.
Técnica da inibição da hemaglutinação
- Dispensar 25 μL de PBS ou solução salina em cada orifício da microplaca a ser utilizado, com exceção dos orifícios de controle da hemácia que devem conter 50 μL;
- Colocar, com auxílio de micropipeta monocanal, 25 μL de cada amostra de soro a ser testada no primeiro orifício de cada linha da placa (FIGURA 1);
- Realizar diluições seriadas na base 2 de cada amostra com micropipeta multicanal, sempre homogeneizando várias vezes com a própria pipeta antes de passar para o próximo poço;
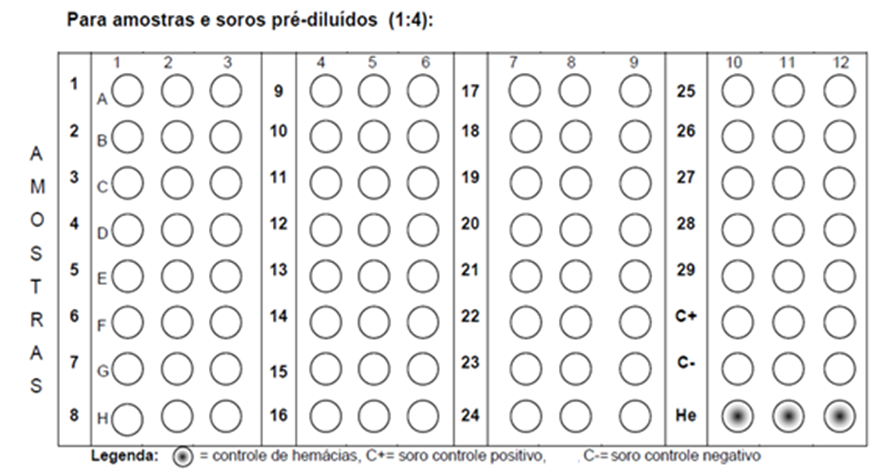
- Diluir até o sexto poço (p.e. até A6) para amostras de soro sem tratamento prévio ou diluição a 1:4; ou até o terceiro poço (p.e. até A3) para amostras previamente diluídas (1:4) (FIGURA 2);
- Dispensar 25 μL de soro referência em uma das linhas preenchidas com PBS ou solução salina, e realizar as diluições seriadas na base 2 da mesma forma que foi feito para as amostras. Para amostras pré-diluídas, realizar a mesma diluição para o soro referência;
- Dispensar 25 μL de soro controle NEGATIVO em uma das linhas preenchidas com PBS ou solução salina, realizar as diluições seriadas na base 2 da mesma forma que foi feito para as amostras;
- Reservar os orifícios da última linha para o controle das hemácias;
- Adicionar 25 μL do antígeno com quatro UHA em cada orifício da microplaca (exceto nos orifícios do controle das hemácias) e homogeneizar suavemente com leve batidinhas;
- Cobrir a microplaca com adesivo ou tampa para evitar evaporação e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8 °C);
- Adicionar, em cada orifício, 25 μL de suspensão de hemácias de galinha a 1% e homogeneizar suavemente com leves batidinhas;
- Incubar a microplaca por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8 °C); e
- Realizar a leitura da placa inclinando-a e observando a presença ou ausência de “lágrima” escorrendo.
FIGURA 1. Exemplo de marcação das placas de amostras não diluídas para realização do teste de HI para detecção de anticorpos para o vírus da doença de Newcastle
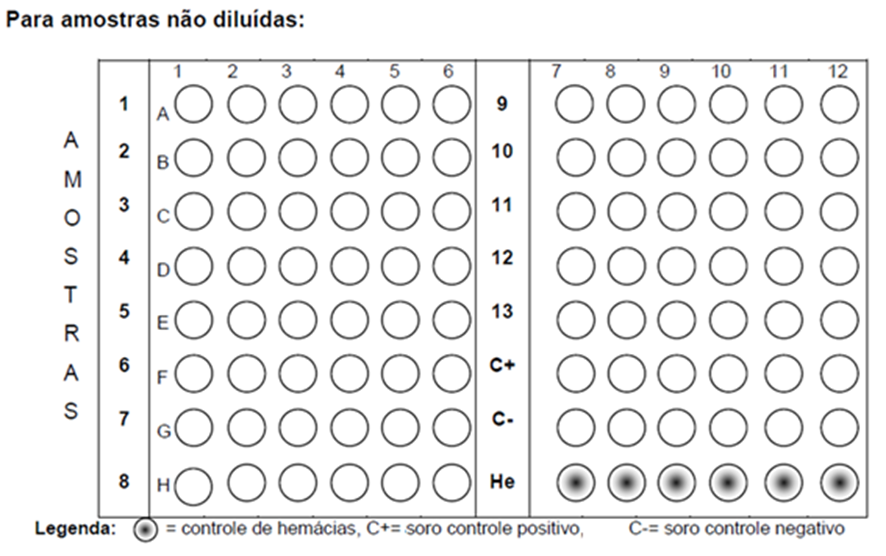
FIGURA 2. Exemplo de marcação das placas para amostras e soros referência pré-diluídos (1:4) para realização do teste de HI para detecção de anticorpos para o vírus da doença de Newcastle
Critérios de aceitação do ensaio
- O teste será válido se:
- Os controles das amostras de soro não apresentarem hemaglutinação inespecífica;
- O controle de hemácias não apresentar aglutinação (apresentar “lágrima” escorrendo);
- O antígeno utilizado possuir quatro UHA (determinado pelo ensaio de hemaglutinação);
- O controle NEGATIVO apresentar título inferior a 22 (1:4); e
- O controle POSITIVO apresentar título ≥ 1:16;
- Anotar os resultados em formulário próprio; e
- Para as amostras pré-diluídas (1:4), as diluições na base 2 correspondem à diluição 1:8, 1:16 e 1:32.
Interpretação dos resultados
- Os poços com inibição completa devem formar uma "lágrima" semelhante àquela observada nos poços de controle POSITIVO. Os poços que apresentam “lágrima" com escoamento retardado em comparação com o controle POSITIVO devem ser interpretados como incompleto;
- O título de HI é a maior diluição do soro capaz de inibir completamente a hemaglutinação das 4 UHA do antígeno;
- São consideradas POSITIVAS aquelas amostras que apresentarem título ≥ 24 (1:16); e
- São consideradas NEGATIVAS as amostras que apresentarem título < 24 (1:16).
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de amostras positivas ou negativas dentre o total de amostras analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio;”
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Soro sanguíneo
Amostras podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ C. Isolamento viral
Materiais
- Luvas de procedimento;
- Algodão hidrófilo embebido em álcool 70º INPM;
- Micropipetas mono e multicanal de capacidade mínima de 25 µL;
- Ponteiras para micropipeta capacidade mínima de 25 µL;
- Seringas descartáveis de 1 mL, com precisão de 0,1 mL com agulhas 27 G ½” ou similares;
- Filtro descartável de 22 µm de porosidade para seringas;
- Microplacas em poliestireno de 96 orifícios com fundo em “V” ou em “U”;
- Tubos de centrífuga com tampa rosqueável;
- Tesouras e pinças dente-de-rato estéreis;
- Frascos de plástico com tampas perfuráveis;
- Gaze;
- Toalhas absorventes descartáveis;
- Filme adesivo para microplacas;
- Sacos de autoclave;
- Cuba de plástico autoclavável;
- Caneta para escrita em plástico/vidro; e
- Etiquetas autoadesivas.
Equipamentos e instrumentos
- Cabine de segurança biológica, classe II A2;
- Autoclave de fronteira;
- Estufa;
- Geladeira;
- Freezer;
- Ultrafreezer;
- Triturador de tecidos com sondas;
- Furador de ovos;
- Ovoscópio;
- Incubadora de ovos;
- Centrífuga refrigerada;
- Agitador tipo vórtex; e
- Autoclave.
Insumos
- Ovos embrionados SPF com 9 a 11 dias de idade;
- Caldo BHI ou MEM com solução de antibióticos 10X;
- Caldo BHI; e
- Placas de ágar sangue ou ágar BHI.
Soluções
- Suspensão de hemácias de Gallus gallus (preferencialmente machos) SPF ou SAN a 1%;
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado, hipoclorito de sódio 2-2,5% ou outro produto com ação virucida; e
- Solução de álcool 70° INPM.
Realização do ensaio
Processamento dos itens de ensaio
- As amostras colhidas de aves mortas podem ser processadas separadamente ou em “pools” de um mesmo sistema orgânico (respiratório, digestório e nervoso);
- As amostras devem chegar ao laboratório acondicionadas em um dos meios de transporte preconizados pelo MAPA (caldo BHI pH 7,0 - 7,4 contendo antibióticos; meio MEM acrescido de antibióticos e soro fetal bovino/soro bovino ou soroalbumina bovina; caldo TPB acrescido de antibióticos ou meio de transporte universal para vírus); e
- Quando o processamento não for imediatamente possível, estocar as amostras entre 2ºC e 8ºC por até 4 dias. Para estocagem prolongada, as amostras devem ser mantidas à temperatura de -70ºC a -80ºC.
Processamento de suabes traqueais, cloacais, de fundo de gaiola e fezes
- Os suabes colhidos e acondicionados individualmente podem ser agrupados em “pools” de cinco a sete por tipo de suabe e espécie;
- Caso não haja volume suficiente de material para inoculação, pode ser preparado um “pool” com suabes de traqueia e cloaca;
- Os frascos contendo fezes em meio de transporte devem ser centrifugados a 1000 g por 10 minutos e o sobrenadante recolhido em frasco contendo 1,5 ml de caldo BHI contendo antibióticos;
- Caso o material não seja utilizado no mesmo dia, os frascos deverão ser armazenados entre 2°C e 8°C por até 24 horas. Para estocagem prolongada, as amostras devem ser mantidas à temperatura de -70ºC a -80ºC; e
- Após o processamento destas amostras, será preparado o material para extração de ácidos nucleicos totais para realização de RT- PCR ou RT-qPCR.
Processamento de amostras provenientes de órgãos
- Picotar os tecidos finamente triturá-los e preparar suspensões em caldo BHI ou meio MEM contendo solução de antibióticos 10X em tubos de centrífuga;
- Centrifugar as suspensões a 1000 g por 10 minutos, recolher o sobrenadante e armazená-lo em um frasco devidamente identificado de forma a manter a rastreabilidade da amostra;
- Aguardar um período ≥ quatro horas para a inoculação (para a ação da solução de antibióticos). Caso não seja utilizado no mesmo dia, conservá-lo entre 2ºC e 8ºC por até 24 horas. Para estocagem prolongada, as amostras devem ser mantidas à temperatura de -70ºC a -80ºC; e
- Após o processamento destas amostras, o material será preparado para extração de ácidos nucleicos totais para realização de RT- PCR ou RT-qPCR.
Isolamento viral
- Antes da inoculação realizar ovoscopia nos ovos embrionados que serão inoculados a fim de se detectar embriões mortos ou fracos para que sejam descartados;
- Devem ser feitos os seguintes controles de prova: controle do meio com antibióticos utilizado no preparo dos inóculos, controle dos ovos SPF utilizados para inoculação e controle de esterilidade dos inóculos;
- Em cabine de segurança biológica, com auxílio de uma seringa estéril descartável de 1 ou 3 mL com agulha 27 G ½” ou similar, inocular via cavidade alantoide 0,3 mL da amostra em, no mínimo, 4 ovos embrionados SPF com idade entre 9 e 11 dias devidamente identificados de forma a manter a rastreabilidade das amostras;
- Selar o orifício de inoculação, aguardar a secagem do selante e borrifar álcool 70° INPM antes da retirada dos ovos inoculados da cabine de segurança biológica;
- Incubar os ovos inoculados a 37 ± 2°C por 4 a 7 dias, realizando-se ovoscopia diariamente. Descartar ovos mortos nas primeiras 24 horas. Registrar o número de ovos mortos de cada um dos inóculos em formulários próprios e armazená-los à temperatura de 2 a 8°C até o término do teste, identificando-os com a data da ovoscopia;
- Sacrificar os ovos viáveis no final do teste, submetendo-os à temperatura de refrigeração overnight (2 a 8 °C) ou 1,5 h em ultrafreezer (-70 a –80 °C);
- Coletar 1 a 2 mL do líquido alantoide dos ovos de cada inóculo em tubo de centrifugação, centrifugando-se a 1000 g por 10 minutos;
- Verificar a atividade hemaglutinante do “pool” do líquido alantoide por meio da técnica de hemaglutinação (HA) em microplaca;
- Verter aproximadamente 5 mL do “pool” de cada material que apresentar reação negativa na hemaglutinação em frasco estéril contendo 1,5 mL de caldo BHI ou MEM contendo solução de antibióticos 10X e identificar como 1ª passagem;
- Inocular o líquido alantoide referente à 1ª passagem, no mínimo, 04 ovos embrionados SPF para realização da segunda passagem;
- Ao final da 2a passagem, se os ovos ainda apresentarem-se NEGATIVOs na técnica de HA, preparar um “pool” de cada material e encaminhá-lo para realização de RT-PCR ou RT-qPCR a fim de confirmar a negatividade do mesmo;
- Caso o material seja POSITIVO no RT-PCR ou RT-qPCR, nova passagem pode ser realizada a fim de aumentar o título do vírus;
- Se o “pool” do material apresentar reação positiva no teste de HA em qualquer uma das passagens, o líquido alantoide dos ovos deve ser coletado, centrifugado à 1000 g por 10 minutos e dividido em duas alíquotas, uma com e outra sem caldo BHI ou MEM contendo solução de antibióticos 10X; e
- Utilizar a alíquota sem antibióticos nas provas de identificação viral (HI) e caracterização viral (ICPI).
Critérios de aceitação do Ensaio
O teste será válido se:
- Os ovos destinados ao controle do meio não apresentarem mortalidade e atividade hemaglutinante;
- Os ovos SPF não inoculados, destinados ao controle, não apresentarem mortalidade e atividade hemaglutinante; e
- O controle de esterilidade dos inóculos for NEGATIVO.
Interpretação dos resultados
- O material será considerado POSITIVO no isolamento viral quando houver detecção de atividade hemaglutinante no líquido alantoide dos ovos inoculados ou detecção do RNA viral por RT-PCR ou RT-qPCR; e
- O material será considerado NEGATIVO quando, após duas passagens consecutivas em ovos embrionados SPF, não houver detecção de atividade hemaglutinante e detecção do RNA viral por RT-PCR ou RT-qPCR.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Líquido alantoide
- Todas as alíquotas (passagens) das amostras que resultarem positivas no isolamento viral e/ou no RT-PCR ou RT-qPCR deverão ser mantidas pelo laboratório e armazenadas à -70 °C ou temperaturas inferiores por tempo indeterminado. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário; e
- Alíquotas negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ D. Inibição da hemaglutinação para identificação viral (HI)
Materiais
- Luvas para procedimentos;
- Algodão hidrófilo;
- Ponteiras descartáveis;
- Pipetas de 5, 10 e 20 mL;
- Microplacas em poliestireno de 96 orifícios com fundo em “V” ou em “U”;
- Tubos de centrífuga com tampa rosqueável;
- Reservatórios para pipetagem de líquidos;
- Papel absorvente;
- Cuba de plástico autoclavável
- Filme adesivo para microplacas; e
- Caneta para escrita em plástico/vidro.
Equipamentos e instrumentos
- Cabine de segurança biológica, classe II A2;
- Refrigerador;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou bulbo de segurança;
- Agitador tipo vórtex; e
- Autoclave.
Insumos
- Líquido alantoide coletado dos ovos referentes ao material com atividade hemaglutinante verificado anteriormente;
- Soros controles de referência para os oito AOaVs hemaglutinantes (AOaV-1, AOaV-2, AOaV-3, AOaV-4, AOaV-6, AOaV-7, AOaV-8 e AOaV-9);
- Anticorpos monoclonais para diferenciação de cepas de AOaV -1(opcional); e
- Antígenos inativados de referência para os oito APMVs hemaglutinantes (AOaV-1, AOaV-2, AOaV-3, AOaV-4, AOaV-6, AOaV-7, AOaV-7 e AOaV-9).
Soluções
- Solução de hemácias de Gallus gallus (preferencialmente machos) SPF ou SAN a 1%;
- Solução de PBS com 0,4% BSA-AS;
- Solução de PBS pH 7,2 ± 0,2 ou solução salina 0,85% a 0,90%;
- Solução de álcool 70º INPM; e
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado, hipoclorito de sódio 2-2,5% ou outro produto com ação virucida.
Realização do ensaio
Determinação do título do antígeno em unidades hemaglutinantes (UHA)
- Realizar a titulação do líquido alantoide coletado dos ovos referentes ao material com atividade hemaglutinante;
- Para realização da prova de HI para identificação viral, é necessário que o antígeno (líquido alantoide) esteja com quatro unidades hemaglutinantes (UHA) em 25 µL;
- Para obtenção dessas quatro UHA, diluir o antígeno em solução de PBS com 0,4% BSA-AS, conforme o exemplo da Nota.
- De acordo com o exemplo, diluir o antígeno a 1:64 (1 mL de antígeno para 63 mL de Solução de PBS com 0,4% BSA-AS, ou dividir esta proporção por 10, utilizando-se 100 µL de antígeno para 6,3 mL de PBS com 0,4% BSA-AS) para se obter as quatro UHA;
- Fazer outras duas diluições do antígeno para se ter uma margem de segurança maior. Nesse caso, preparar duas novas diluições contendo, respectivamente, 50% a mais e 50% a menos do volume inicial de antígeno utilizado no preparo da primeira diluição;
- Após o preparo das diluições, realizar uma nova titulação (retrotitulação) a fim de determinar em qual das três diluições encontram-se as quatro UHA. Essa é, então, a diluição a ser empregada como antígeno na prova de HI. Registrar em formulário próprio.
Nota: Título no HA = 28 (256 UHA), sendo que o título é a maior diluição do antígeno capaz de produzir aglutinação completa (“endpoint”) e equivale a uma UHA. Portanto, encontraremos quatro UHA dividindo o valor do “endpoint” por quatro. Exemplo: 256 ÷ 4 = 64.
Inibição da hemaglutinação para identificação viral (HI)
- O controle da reação de inibição da hemaglutinação será feito pela utilização de antígenos inativados de referência para os oito AOaVs hemaglutinantes (AOaV-1, AOaV-2, AOaV-3, AOaV-4, AOaV-6, AOaV-7, AOaV-8 e AOaV-9) e seus respectivos antissoros;
- Dispensar 25 µL de PBS pH 7,2 ± 0,2 ou solução salina 0,85% a 0,90% em cada orifício da microplaca a ser utilizada;
- Colocar, com auxílio de micropipeta monocanal, 25 µL de cada antissoro de referência no primeiro orifício de cada fileira da placa, reservando-se as colunas 9, 10 e 11 para o controle POSITIVO e a última coluna para o controle das hemácias (FIGURA 3);
- Realizar diluições seriadas na base 2 com micropipeta multicanal. Para isso:
- Aspirar 25 µL do primeiro orifício da linha (p.e., orifício A1);
- Dispensar os 25 µL no segundo orifício da mesma linha (p.e., A2);
- Homogeneizar três vezes com auxílio da micropipeta;
- Aspirar 25 µL e dispensar no próximo orifício da mesma linha (p.e., A3);
5. Repetir os passos “c” e “d” por quatro vezes (p.e. até A8);
6. Dispensar 25 μL de cada antissoro de referência na coluna 9 (p.e. até A9) e realizar a diluição na base 2 até a coluna 11 (p.e. até A11);
7. Dispensar 25 μL de antígeno de referência (com 4 UHA) homólogo para cada antissoro de referência nos orifícios das colunas 9, 10 e 11;
8. Adicionar 25 µL do antígeno/vírus com quatro UHA em cada orifício da microplaca até a coluna 8 e homogeneizar suavemente;
9. Cobrir a microplaca com adesivo para evitar evaporação e incubar por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8°C). Adicionar, em cada orifício, 25 μL de suspensão de hemácias de galinha a 1% (completamente suspendida) e homogeneizar suavemente;
10. Incubar a microplaca por 30 minutos a 22°C ± 2°C ou por 1 hora sob refrigeração (2 a 8°C);
11. Realizar a leitura da placa inclinando-a e observando a presença ou ausência de “lágrima” escorrendo e registrar os resultados em formulário próprio.
Critérios de aceitação do ensaio
O teste será válido se:
- O vírus a ser identificado possuir, pelo menos, 4 UHA (determinado pelo ensaio de hemaglutinação);
- O controle de hemácias não apresentar aglutinação (apresentar “lágrima” escorrendo); e
- Os antissoros de referência para cada AOaV inibirem a hemaglutinação dos respectivos antígenos.
Interpretação dos resultados
- Os poços com presença de “lágrima” são registrados como “+” (POSITIVO para HI); poços com ausência de “lágrima”, isso é com completa hemaglutinação, são registrados como “-” (NEGATIVO para HI); poços com formação de “lágrima” incompleta são registrados como “I” (HI incompleto);
- Os poços com inibição completa devem formar uma "lágrima" na mesma taxa de velocidade dos poços de controle POSITIVO. Os poços que apresentam “lágrima" com escoamento retardado em comparação com o controle POSITIVO devem ser interpretados como incompleto;
- O título de HI é dado como a maior diluição do soro capaz de causar inibição completa das quatro UHA do vírus em teste. Considerar somente as cavidades que apresentarem botão de hemácias igual ao das cavidades controle, anotando no formulário próprio;
- O material será considerado POSITIVO para vírus de doença de Newcastle quando a sua atividade hemaglutinante for inibida por antissoro específico para AOaV-1.
FIGURA 3. Disposição dos antissoros para AOaV e do controle de hemácias (HE) na microplaca para realização do teste de HI para identificação viral.
As colunas 9, 10 e 11 são dedicadas aos controles “POSITIVOS” de cada AOaV.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO para vírus da Doença de Newcastle” ou “POSITIVO para paramyxovírus aviário sorotipo X”; e
- Indicar a alíquota que apresentou positividade.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Líquido alantoide
- Todas as alíquotas (passagens) das amostras que resultarem positivas no isolamento viral e/ou no RT-PCR ou RT-qPCR deverão ser mantidas pelo laboratório e armazenadas à -70 °C ou temperaturas inferiores por tempo indeterminado. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário; e
- Alíquotas negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ E. Índice de patogenicidade intracerebral (ICPI)
Materiais
- Micropipetas e ponteiras com capacidade mínima de 500 µL;
- Seringas descartáveis de 1 mL, com precisão de 0,1 mL com agulhas 32G;
- Pipetas de 5 mL;
- Cuba de plástico autoclavável; e
- Papel absorvente.
Equipamentos e instrumentos
- Cabine de segurança biológica classe II A2;
- Isolador para aves;
- Estufa; e
- Autoclave.
Insumos
- Pintos SPF (Specific Pathogen Free) de um dia (24 a 40 horas de vida);
- Caldo BHI ou placas de ágar sangue ou ágar BHI;
- Líquido alantoide infectado (antígeno), com título em UHA ≥ 24 (16);
- Anestésicos (cloridrato de quetamina e de xilasina); e
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado, hipoclorito de sódio 2-2,5% ou outro produto com ação virucida.
Soluções
- Solução de PBS pH 7,2 ± 0,2 ou solução salina isotônica; e
- Solução de álcool 70° INPM.
Realização do ensaio
- Diluir o líquido alantoide a 1:10 em solução de PBS pH 7.2 ± 0,2, ou solução salina isotônica por exemplo: 0,5 em 4,5 mL de PBS;
- Na cabine de segurança biológica, inocular, por via intracerebral, 10 aves de um dia com 0,05 mL do líquido alantoide diluído, localizando-se a região da fontanela (moleira) utilizando-se agulha descartável de 1mL com agulhas 32G;
- Utilizar mais 4 aves para serem o controle do teste: 2 aves serão inoculadas por via intracerebral somente com 0,05 mL PBS e as outras 2 não serão inoculadas;
- Semear o inóculo utilizado em caldo BHI e/ou placa de ágar sangue ou ágar BHI e incubar a 37 ± 2 ºC por 48 horas (ágar sangue) ou 24 horas (BHI);
- Transportar as aves da cabine de segurança biológica até os isoladores em recipientes herméticos;
- Acomodar as aves no interior do isolador;
- Realizar leituras diárias das aves, por um período de 8 dias, registrando-se o número de aves saudáveis, doentes e mortas em formulário próprio; e
- Caso seja verificada contaminação do inóculo no decorrer do período de teste, cancelar o teste em andamento, filtrar o antígeno (material POSITIVO para NDV) e realizar nova inoculação em aves.
Critérios de aceitação do ensaio
O teste será válido se:
- As aves inoculadas com PBS se mantiverem saudáveis;
- As aves não inoculadas se mantiverem saudáveis; e
- Não houver crescimento microbiano no caldo ou placa utilizados para o controle de esterilidade do inóculo.
Interpretação dos resultados
Somar, ao final do teste, o número de aves saudáveis, doentes e mortas e multiplicar pela seguinte pontuação:
- 0 = pintos saudáveis;
- 1 = pintos doentes; e
- 2 = pintos mortos.
A seguir, somar todos os pontos e dividi-los por 80 (pois são 80 observações: 10 aves observadas por 8 dias) a fim de obter o ICPI.
São considerados isolados de NDV PATOGÊNICOS (ou virulentos) aqueles que apresentarem ICPI ≥ 0,7.
Os isolados com ICPI < 0,7 serão considerados APATOGÊNICOS (ou avirulentos).
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “vírus da doença de Newcastle patogênico (ou virulento)” ou “apatogênico (não virulento)”; e
- Indicar o valor do ICPI nos resultados.
Descarte das amostras e resíduos
- Após a finalização do teste, as aves sobreviventes devem ser eutanasiadas dentro das unidades isoladoras, mediante anestesia prévia;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de Itens de ensaio
Após a finalização do ensaio as aves devem ser eutanasiadas e descartadas.
¶ F. Técnica de RT-qPCR para detecção do vírus da doença de Newcastle
Nota: O laboratório pode optar por realizar a técnica de PCR em tempo real com um kit comercial ou protocolo “in house”. Ambos necessitam de comprovação de desempenho.
Materiais
- Luvas de procedimento nitrílicas ou de látex isentas de pó;
- Microtubos de volumes variados ou microplacas;
- Microplacas ou microtubos para leitura óptica de RT-qPCR;
- Tampas adesivas para microplacas para leitura óptica de RT-qPCR;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
Equipamentos e instrumentos
- Cabine de segurança biológica com filtro HEPA classe II ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Termociclador para PCR em tempo real;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Microcomputador; e
- Equipamento para extração automatizada de ácidos nucleicos (opcional).
Insumos
- Água livre de nucleases;
- Controle interno de extração;
- Controle POSITIVO para o vírus da doença de Newcastle;
- Kit para extração de RNA;
- Kit para amplificação por RT-qPCR em um único passo; ou
- Iniciadores (primers) e sondas específicos para a detecção do vírus da doença de Newcastle (sugestão de iniciadores apresentada no QUADRO 2).
QUADRO 2. Sugestão de oligonucleotídeos para detecção do vírus da doença de Newcastle por RT-qPCR.
|
Alvo |
Primer forward |
Primer reverse |
Sondas |
Referência |
| Gene M | M+4100 5’primer 5’ agt gat gtg ctc gga cct tc 3’ (20) | M-4220 3’primer 5’ cct gag gag agg cat ttg cta 3’ (21) | M+4169 probe 5’ FAM – ttc tct agc agt ggg aca gcc tgc – BHQ1 3’ (24) | Wise, 2004 |
| Gene F | F+ 4829 5’primer velo-meso 5’ ggt gag tct atc cgg arg ata caa g 3’ (25) | F- 4939 3’primer 5’ agc tgt tgc aac ccc aag 3’ (18) | F+ 4894 probe 5’ FAM - aag cgt ttc tgt ctc ctt cct cca - BHQ1 3’ (24) | Wise, 2004 |
Soluções
- Solução de álcool 70º INPM;
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses; e
- Solução de hipoclorito de sódio 0,5%.
Realização do ensaio
Extração de ácidos nucleicos
- Realizar a extração de ácidos nucleicos das amostras, de forma automatizada ou manual, através de kits de extração de RNA específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Adicionar a cada procedimento de extração: controle NEGATIVO de extração (meio de cultura MEM ou BHI contendo ou não suabes de aves SPF) e controle interno de extração; e
- O laboratório pode optar pelo uso de outro método de extração que não use kit, desde que apresente verificação de desempenho comprovada pelo próprio laboratório.
Reação de amplificação de ácido nucleico por RT-qPCR
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR) isenta de material genético e amplicons, e outra para a transferência de RNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou solução de álcool 70º INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
Preparo do mix de reação
- Preparar o mix de reação de acordo com protocolos validados e específicos para o agente pesquisado, em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Após o preparo do mix, adicionar o RNA nos poços da placa ou em microtubos para leitura óptica;
- A adição de RNA e das amostras controle deve ser realizada em uma área distinta do preparo do mix (sala de PCR);
- Devem ser incluídos nas análises:
- Controle POSITIVO para o vírus da doença de Newcastle;
- Controle NÃO DETECTADO da extração;
- Branco (água livre de nucleases); e
- Controle DETECTADO e NÃO DETECTADO do kit utilizado (se houver).
Reação de RT-qPCR
- Selar a placa com adesivo óptico ou fechar a tampa dos microtubos. Verificar se há bolhas no fundo do poço e/ou gotículas na parede dos poços da placa ou tubo. Caso isto ocorra, centrifugar brevemente para reduzir as bolhas e para que o conteúdo se posicione na parte inferior da placa ou tubo;
- Iniciar e entrar com os dados no software do termociclador (identificação das amostras e seleção dos fluoróforos), conforme especificações do fabricante;
- Inserir a placa ou os tubos no termociclador, salvar o arquivo e iniciar a corrida; e
- Ao finalizar, salvar os dados e interpretar os resultados.
Critérios de aceitação do ensaio
- Para a validação do ensaio, o controle POSITIVO do kit e o controle interno devem apresentar uma curva sigmoide (em forma de S) e um Cq satisfatório (conforme especificações do fabricante); e
- O controle NEGATIVO deve ter Cq indeterminado ou maior que o limite do kit. O gráfico do controle NEGATIVO deve apresentar traços de fluorescência na linha de base durante todo o ensaio. Esses traços não devem apresentar curva sigmoide ou um aumento gradual na fluorescência.
Interpretação dos resultados
- Ao analisar os resultados da corrida, o operador deve avaliar os seguintes componentes: controle POSITIVO, controle NEGATIVO, controle da extração, background de fluorescência e gráficos de amplificação de cada amostra individualmente. Após a validação do ensaio, interpretar os resultados conforme especificações do fabricante; e
- Qualquer amostra questionável deverá ser retestada.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como POSITIVO ou “NEGATIVO”, ou de acordo com o preconizado pelo fabricante; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de Itens de Ensaio
- Amostras negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras com resultado diferente de NEGATIVO no RT-qPCR para detecção de influenza A deverão ser encaminhadas ao LFDA-SP para a realização de ensaios complementares.
¶ 4.3 Laringotraqueíte Infecciosa das Aves - LTI
4.3.1 Amostras
São consideradas amostras para o diagnóstico da laringotraqueíte infecciosa das aves:
4.3.1.1. Detecção da Resposta Imune
Soro sanguíneo
4.3.1.2. Identificação do Agente
- Pulmão;
- Traqueia;
- Gânglio trigêmeo; e
- Sistema nervoso central.
4.3.2 Recebimento das Amostras
4.3.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.3.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
4.3.2.3. As amostras deverão ser encaminhadas ao laboratório, individualmente e obedecendo a critérios de biossegurança.
4.3.3 Técnicas de Diagnóstico
4.3.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo Legislação em vigor;
4.3.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.3.3.3.O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos.
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente.
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18 e 25 °C.
4.3.3.4. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios de interpretação dos resultados;
4.3.3.5. O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.3.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.3.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
¶ A. Ensaio Imunoenzimático (ELISA)
Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
Equipamentos e instrumentos
- Geladeira;
- Freezer;
- Estufa;
- Termômetros;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional);
- Lavadora de microplacas (opcional); e
- Autoclave.
Insumos
- Kits de ELISA de detecção de anticorpos para o vírus da laringotraqueíte infecciosa das aves.
Soluções
- No preparo das soluções devem ser utilizados somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução; e
- Diluir a soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar bem.
Realização do ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
- Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente; e
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
Critérios de aceitação do ensaio
O resultado do ensaio será considerado válido somente se as Densidades Óticas (DOs) dos soros controles e os demais parâmetros calculados a partir delas estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
Interpretação dos resultados
De acordo com as DOs obtidas, consideram-se as amostras como POSITIVAS ou NEGATIVAS ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico).
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO”, “NEGATIVO” ou “SUSPEITO”, ou de acordo com o preconizado pelo fabricante; e
- Expressar a quantidade de amostras de soro positivas ou suspeitas dentre o total de amostras analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Amostras de soro podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ B. Técnica da imunodifusão em gel-ágar (IDGA) para pesquisa de anticorpos
Materiais
- Luvas para procedimento;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Balão volumétrico;
- Ponteiras descartáveis;
- Lâmina para microscópio de 25x75mm ou Placa de Petri de 100mm de diâmetro;
- Descartador de ponteiras;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
Equipamentos
- Geladeira;
- Freezer;
- Micro-ondas;
- Micropipetas monocanal de volumes reguláveis;
- Pipetador automático ou manual;
- Balança analítica;
- Medidor de pH;
- Centrifuga;
- Cortador Padrão;
- Câmara Úmida;
- Bomba a vácuo (opcional);
- Fonte de luz; e
- Autoclave.
Insumos
- Antígeno padrão e soro controle POSITIVO; e
- Controle NEGATIVO.
Soluções
- Gel de ágar a 1% em PBS 0,01 M.
Realização do ensaio
Preparo dos reagentes
- Preparar o gel a 1% p/v de agarose ou ágar tipo II purificado, 8% p/v NaCl em 0,01 M PBS em pH 7.2, ou conforme orientação do fabricante dos insumos utilizados;
- Aquecer o gel no micro-ondas por tempo necessário para fusão completa, evitando o borbulhamento e extravasamento. Não efetuar sucessivas fusões do gel;
- Verter o gel fundido e ainda quente em placas de Petri até uma espessura de 2 – 3 mm;
- Deixar o gel solidificando em superfície plana, em local livre de poeira e em temperatura 22 ± 2 °C por no máximo 30 minutos, para que a concentração eletrolítica não seja alterada;
- Após o gel solidificar, utilizando cortador de padrão hexagonal com as dimensões recomendadas pelo fabricante dos insumos, perfurar os poços de aproximadamente 5 mm de diâmetro no gel. As partes cortadas podem ser removidas da placa utilizando uma cânula conectada a uma bomba de vácuo através de uma mangueira;
- Identificar os poços de acordo com a amostra de soro que será adicionada a cada um deles utilizando caneta para vidro ou plástico;
- Armazenar as placas de Petri na câmara úmida se não forem utilizadas imediatamente, para evitar o ressecamento do gel; e
- Não utilizar placa que apresente umidade nos poços da roseta. Desprezá-las ou remover a umidade. Caso apresentem ressecamento devem ser descartadas.
Preparo das amostras
- Identificar as amostras de soro de aves não-aquáticas a serem analisadas; e
- Caso seja recomendado pelo fabricante do antígeno, inativar amostras a 56 ± 1 °C por 30 minutos ou conforme instruções do fabricante.
Etapa de Triagem
- Essa etapa é exclusiva para a pesquisa de anticorpos para ILTV;
- Registrar a posição das amostras, do antígeno e dos soros e formulário de prova;
- Determinar o número de placas a serem utilizadas considerando que em cada 4 rosetas são testadas 23 amostras;
- As rosetas e as placas devem ser numeradas de forma que a identificação fique visível no momento da leitura;
- Com auxílio de uma micropipeta monocanal, adicionar 25 µL de cada amostra de soro a ser testada, previamente homogeneizada por inversão, ao respectivo orifício (1 a 23);
- Com auxílio de uma micropipeta monocanal, adicionar 25 µL de soro controle positivo ao orifício 24 e 25 µL do antígeno ao orifício central de cada roseta;
- Para grupo de placas testadas, deve-se acrescentar uma roseta contendo soro-controle negativo para validação do ensaio;
- Colocar as placas de Petri em câmara úmida por 24h em temperatura ambiente (22°C ± 2°C). Recomenda-se colocar um chumaço de algodão ou papel toalha molhado dentro da câmara para manter o ambiente úmido.
- Examinar as placas, preferencialmente, em sala escura e com fonte de luz indireta após 24 horas, e registrar o resultado final em formulário apropriado;
- Para que o teste seja válido:
a) A linha de precipitação que indica a interação antígeno-anticorpo deve se formar entre o poço em que foi adicionado o soro controle positivo e o antígeno; e
b) Não pode haver linha de precipitação entre o poço do controle negativo e o antígeno.
11. Verificar se existe a presença de qualquer linha de precipitação entre as amostras e o antígeno. A linha indica uma amostra de soro suspeita, e que deverá ser retestada em triplicada seguindo o protocolo de IDGA descrito a seguir.
Técnica do IDGA
- Preencher o formulário de acompanhamento do ensaio de IDGA;
- Distribuir aproximadamente 50 µL de cada amostra de soro em posições alternadas na periferia do hexágono. Nos poços adjacentes, acrescentar soro controle POSITIVO e ao poço central adicionar o antígeno (FIGURA 1);
- O volume adicionado deve ser suficiente para preencher o poço, coincidindo a parte superior do menisco com o nível do gel, tendo o cuidado de não derramar. Caso o fabricante do antígeno especifique o volume a ser utilizado, seguir suas recomendações adequando o tamanho do poço ou profundidade do gel ao volume indicado;
- Incubar as placas em câmara úmida à temperatura de 22°C ± 2°C por 24 horas. Recomenda-se colocar um chumaço de algodão ou papel toalha molhado dentro da câmara para manter o ambiente úmido; e
- Após a incubação, proceder a leitura das placas abertas sobre uma fonte de luz contra um fundo escuro.
Critérios de aceitação
- As linhas de precipitação que indicam a interação antígeno-anticorpo devem se formar entre os poços em que foram adicionados os soros sabidamente “POSITIVOS” e o antígeno; e
- Caso as linhas estejam fracas para serem visualizadas, incubar por mais 24 horas e realizar a leitura novamente.
Interpretação dos resultados
- NEGATIVO: as linhas formadas entre o antígeno e o soro controle POSITIVO prolongam-se até a cavidade onde se encontram a amostra testada, sem encurvar-se (Figura 1 – Posição B);
- POSITIVO: as linhas formadas entre o antígeno e o soro controle POSITIVO se fundem com aquelas formadas com amostra testada, formando uma linha contínua de identidade total (Figura 1 – Posição F);
- Variações de reações positivas: fraco POSITIVO: a linha de precipitação tende a se formar mais próximo à cavidade onde se encontra a amostra testada, visualizando-se somente uma convergência das duas linhas do controle na direção da cavidade onde se encontra a amostra (Figura 1 – Posição D); e
- Reações inespecíficas: Caso se formem linhas de precipitação entre o poço da amostra testada e o controle POSITIVO (FIGURA 2 – Posições F e B), essas devem ser desconsideradas, pois são inespecíficas. Caso as linhas de precipitação de um controle POSITIVO e uma amostra testada se cruzem, indo de encontro ao poço adjacente (FIGURA 2 – Posição D), isso também indica reação inespecífica e deve ser desconsiderada.
FIGURA 1. Padrão de disposição de amostras em placa de imunodifusão: Nas posições A, E e C, foi adicionado soro controle POSITIVO.
Na posição F, soro teste POSITIVO. Em B, soro teste NEGATIVO. Em D, soro teste fraco POSITIVO.

FIGURA 2. Placa de imunodifusão com exemplos de linhas de precipitação inespecíficas formadas a partir dos poços contendo soro teste em F, B e D.
Elas podem ser desconsideradas desde que as linhas de precipitação específicas formadas a partir dos controles “POSITIVOS” em A, C e E possam ser visualizadas.

Emissão dos resultados
- Os resultados deverão ser emitidos e expressos como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de amostras positivas ou negativas dentre o total de amostras analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Soros
Amostras podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ C. Isolamento viral
Materiais
- Luvas para procedimentos;
- Algodão hidrófilo embebido em álcool 70 INPM;
- Tubos de centrífuga com tampa rosqueável;
- Seringas descartáveis de 1 mL e/ou 3 mL;
- Frascos de vidro tipo penicilina com tampa;
- Frascos de plástico com tampas perfuráveis;
- Agulhas 27 G ½” ou similares;
- Filtro descartável de 22 µm de porosidade para seringas;
- Tesouras e pinças dente-de-rato estéreis;
- Recipiente plástico contendo solução viricida;
- Papel absorvente;
- Gaze;
- Cuba de plástico autoclavável;
- Sacos de autoclave;
- Caneta para escrita em plástico/vidro; e
- Etiquetas autoadesivas.
Equipamentos e instrumentos
- Cabine de segurança biológica, classe II;
- Autoclave de fronteira;
- Estufa;
- Geladeira;
- Freezer;
- Ultrafreezer;
- Incubadora de ovos;
- Triturador de tecidos com sondas;
- Furador de ovos;
- Ovoscópio; e
- Centrífuga refrigerada.
Insumos
- Ovos da espécie Gallus gallus SPF embrionados com 9 a 12 dias de incubação;
- Caldo BHI ou MEM;
- Caldo BHI ou MEM com antibióticos com solução de antibióticos 10X; e
- Placas de Ágar sangue ou Ágar BHI.
Soluções
- Desinfetante hospitalar a base de monopersulfato de potássio concentrado ou similar ou hipoclorito de sódio 2-2,5% ou outro produto com ação virucida; e
- Solução de álcool 70ºINPM.
Realização do ensaio
Processamento dos itens de ensaio
- Quando o processamento não for imediatamente possível, estocar os itens de ensaio em geladeira (2 a 8 °C) por, no máximo, 24 horas. Para períodos maiores de 24h, manter em ultrafreezer (-70 °C a –80 °C);
- Os suabes colhidos e acondicionados individualmente são agrupados em “pools” de cinco a sete;
- Acondicionar em frascos contendo solução de BHI com antibióticos e identificados com o número de registro da amostra, a data do processamento, o número da passagem em ovos (0P), a origem do inóculo (como, por exemplo, T para suabe traqueal) seguida por números sequenciais representativos da quantidade de “pools” (exemplo: T1, T2, T3, etc.);
- No caso de órgãos, picotar finamente, triturá-los e preparar suspensões a 20% (peso/volume) em caldo BHI ou meio MEM contendo antibióticos em tubos de centrífuga;
- Centrifugar a 1000 g por 10 minutos, filtrar o sobrenadante e coletá-lo em frascos contendo solução de BHI com antibióticos;
- Acondicionar o sobrenadante em frascos identificados com o número de registro da amostra, data do processamento, número da passagem em ovos (0P), origem do inóculo; e
- Proceder à extração de ácidos nucleicos totais e/ou isolamento viral.
Inoculação das amostras e controles
- Preparar 06 ovos SPF de idade entre 9 e 12 dias com câmaras invertidas e identificá-los com o número de registro, identificação da alíquota e com a passagem em que se encontram;
- Inocular, via membrana corioalantoide – MCA, no mínimo, quatro ovos embrionados SPF de câmara invertida, com idade entre 9 e 12 dias, com 0,2 mL do meio utilizado na preparação dos inóculos utilizando-se agulhas 27 G ½” ou similares e seringa de 1 mL e/ou 3 mL;
- Manter, no mínimo, quatro ovos de câmara invertida não inoculados como controle dos ovos SPF que são utilizados nas inoculações;
- Controle de esterilidade dos inóculos: semear 0,2 mL do meio e dos inóculos em ágar sangue, ágar BHI ou em caldo BHI, utilizando-se alças de inoculação estéril descartáveis, ou na ausência das mesmas, a própria agulha usada na inoculação;
- Realizar a leitura das placas com 24 h para ágar sangue e 48 h para ágar BHI;
- Após inoculação, selar o orifício com esmalte;
- Após a secagem do esmalte, borrifar álcool 70º INPM e retirar da cabine de segurança biológica;
- Incubar os ovos inoculados a 37ºC ± 2ºC por 5 dias, realizando-se ovoscopias diárias;
- Descartar ovos inoculados que apresentarem mortalidade nas primeiras 24 horas;
- Diariamente, registrar o número de ovos mortos em formulário próprio e armazená-los em geladeira até o término do teste; e
- Sacrificar os ovos que permaneceram viáveis até o final do teste, submetendo-os à temperatura de refrigeração (2 a 8°C) por 12 horas ou 1h30 em ultrafreezer (-70°C a -80°C).
Avaliação e colheita da membrana corioalantoide
- Remover a casca dos ovos da região da inoculação com auxílio de uma tesoura e/ou pinça e verificar a existência de lesões na MCA (membrana corioalantoide);
- Coletar as MCAs com auxílio de pinça e/ou tesoura em tubo de centrífuga contendo meio MEM ou caldo BHI com solução de antibióticos e triturar;
- Centrifugar a 1000 g por 10 minutos e coletar o sobrenadante;
- Reinocular em, no mínimo, 04 ovos embrionados SPF para realização da segunda passagem; e
- Encaminhar as amostras coletadas da segunda passagem em ovos para realização de PCR ou qPCR.
Critérios de aceitação
O teste será válido se:
- Os ovos destinados ao controle do meio não apresentarem mortalidade e atividade hemaglutinante;
- Os ovos SPF não inoculados, destinados ao controle, não apresentarem mortalidade; e
- O controle de esterilidade dos inóculos for NEGATIVO.
Interpretação dos resultados
- Controle de esterilidade POSITIVO associado à mortalidade mínima de 50% dos ovos inoculados indicará que o inóculo utilizado na passagem deverá ser filtrado em membrana de 0,22 µm de porosidade e/ou tratado com solução de antibióticos para posterior reinoculação;
- Controle de esterilidade NEGATIVO: prosseguir as passagens;
- Mortalidade acima de 50% nas primeiras 24h pós inoculação, reinocular;
- São consideradas suspeitas de infecção pelo ILTV aquelas membranas que apresentarem lesões tipo “pox” e/ou espessamento; confirmar por PCR ou qPCR;
- Considerar o material POSITIVO quando houver detecção de lesões compatíveis com infecção por ILTV na MCA dos ovos inoculados e resultado de PCR ou qPCR POSITIVO; e
- Considerar o material NEGATIVO após duas passagens consecutivas em ovos embrionados SPF sem detecção de lesões na MCA e confirmação da negatividade por PCR.
Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Descarte de Amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio”;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de itens de ensaio
Armazenamento de inóculos
As alíquotas positivas devem ser mantidas pelo laboratório e armazenadas a -70°C ou temperaturas inferiores por tempo indeterminado. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário. Amostras negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte.
¶ D. Técnica de PCR convencional para detecção do vírus da laringotraqueíte infecciosa das aves
Nota: O laboratório pode optar por realizar a técnica de PCR com kit comercial ou protocolo “in house.” Ambos necessitam de comprovação de desempenho.
Materiais
- Luvas de procedimento nitrílicas ou de látex isentas de pó;
- Microtubos de volumes variados ou microplacas;
- Microplacas ou microtubos para PCR;
- Tampas adesivas para microplacas;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
Equipamentos e instrumentos
- Cabine de segurança biológica com filtro HEPA classe II ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Termociclador;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Microcomputador;
- Fotodocumentador;
- Equipamento para extração automatizada de ácidos nucleicos (opcional); e
- Autoclave.
Insumos
- Água livre de nucleases;
- Solução tampão para PCR;
- Solução de cloreto de magnésio para PCR;
- Mix de dNTP;
- Primers forward e reverse específicos para o vírus ILTV;
- Enzima Taq DNA Polimerase;
- Controle POSITIVO para ILTV;
- Kit para extração de DNA;
- Corante para ácidos nucleicos;
- Marcador de peso molecular;
- Tampão de carregamento;
- Gel de agarose; e
- Iniciadores (primers) específicos para detecção de ILTV (sugestão de iniciadores apresentado no QUADRO 1).
QUADRO 1. Sugestão de oligonucleotídeos para detecção do vírus da laringotraqueíte infecciosa das aves por PCR.
|
Alvo |
Primer forward |
Primer reverse |
Sondas |
Referência |
| Gene gE |
(1o round) gE1s: 5′-cgt ata cca tcc tac aga cgg ca-3′
(2o round) gE3s: 5′-agt cct ctt ata gcc atc ccc a-3′ |
(1o round)- gE2AS: 5′-cgt aca atg gtt cgg tct tgg a-3′
(2o round)- 5′-cac ccc cgc gac gac gaa gt-3′ |
N.A. |
Chacón & Ferreira, 2008 |
Soluções
- Solução de álcool 70º INPM; e
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses.
Realização do ensaio
Extração de ácidos nucleicos
- Realizar a extração de ácidos nucleicos das amostras incubadas, de forma automatizada ou manual, através de kits de extração de DNA específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Adicionar as seguintes amostras controle a cada procedimento de extração: controle NEGATIVO (líquido alantoide ou água) e controle POSITIVO para ILTV; e
- O laboratório pode optar pelo uso de outro método de extração que não use kit, desde que apresente verificação de desempenho comprovada pelo próprio laboratório.
Reação de amplificação de ácido nucleico (PCR)
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR), isenta de material genético e amplicons, e outra para a transferência de DNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou álcool 70° INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
Preparo do mix de reação
- Preparar o mix de reação de acordo com protocolos validados e específicos para o agente pesquisado (ILTV) em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Adicionar o mix de reação a cada poço da microplaca (ou microtubos);
- Devem ser incluídos nas análises:
- Controle POSITIVO para ILTV;
- Controle NÃO DETECTADO da extração;
- Branco (água livre de nucleases); e
- Controle DETECTADO e NÃO DETECTADO do kit utilizado (se houver).
Reação de PCR
- Após o preparo do mix, adicionar o DNA nos poços da placa ou em microtubos identificados com a numeração da amostra a ser testada; e
- Realizar a amplificação em termociclador certificado, conforme as especificações de temperatura do protocolo utilizado.
Eletroforese
- Preparar o gel de agarose em concentração adequada ao protocolo de PCR utilizado. Adicionar um corante para ácidos nucleicos em proporção suficiente para visualização das bandas;
- Para a corrida das amostras, adicionar tampão de carregamento ao produto de PCR;
- Aplicar marcador de peso molecular em um dos poços do gel;
- Realizar a corrida em cuba de eletroforese, utilizando o tempo e a voltagem adequados para o volume do gel e o protocolo de PCR utilizado; e
- Visualizar o gel sob luz ultravioleta, fotografar com o auxílio de um fotodocumentador e analisar o resultado.
Critérios de aceitação do ensaio
- As amostras do controle POSITIVO para ILTV devem apresentar bandas de tamanhos correspondentes aos amplicons do protocolo utilizado; e
- As amostras de controle NEGATIVO (controle NEGATIVO da extração, controle heterólogo e branco) não devem apresentar bandas de amplificação.
Interpretação dos resultados
- As amostras de controle POSITIVO para ILTV devem apresentar bandas de tamanhos correspondentes aos amplicons do protocolo utilizado;
- As amostras de controle NEGATIVO (controle NEGATIVO da extração e branco) não devem apresentar bandas de amplificação;
- Comparar os resultados das amostras testadas ao das amostras controle, a fim de classificá-las como positivas ou negativas;
- A leitura das bandas deve ser clara e livre de amplicons inespecíficos para o teste ser considerado satisfatório; e
- Qualquer amostra questionável deverá ser retestada.
Emissão dos resultados
- Os resultados deverão ser emitidos e expressos como “POSITIVO” ou “NEGATIVO”; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de Itens de Ensaio
- Amostras negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras positivas de qualquer origem devem ser armazenadas a –70 °C ou temperaturas inferiores por tempo indeterminado, incluindo todos os registros e documentação pertinente, devendo as mesmas serem registradas e controladas pelo laboratório responsável pela análise. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário.
¶ E. Técnica de qPCR para detecção do vírus da laringotraqueíte infecciosa das aves
Nota: O laboratório pode optar por realizar a técnica de PCR em tempo real com kit comercial ou protocolo “in house”. Ambos necessitam de comprovação de desempenho.
Materiais
- Luvas de procedimento nitrílicas ou de látex isentas de pó;
- Microtubos de volumes variados ou microplacas;
- Microplacas ou microtubos para leitura óptica de qPCR;
- Tampas adesivas para microplacas para leitura óptica de qPCR;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
Equipamentos e instrumentos
- Cabine de segurança biológica com filtro HEPA classe II ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Termociclador para PCR em tempo real;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Microcomputador; e
- Equipamento para extração automatizada de ácidos nucleicos (opcional).
Insumos
- Água livre de nucleases;
- Controle POSITIVO para ILTV;
- Kit para extração de DNA e
- Kit para amplificação do ILTV por qPCR; ou
- Iniciadores (primers) e sondas específicos para a detecção do ILTV por PCR em tempo real (sugestão de iniciadores apresentado no QUADRO 2).
QUADRO 2. Sugestão de oligonucleotídeos para detecção do DNA do vírus da laringotraqueíte infecciosa das aves por qPCR.
|
Alvo |
Primer forward |
Primer reverse |
Sondas |
Referência |
| Gene gC | gC-f: 5′-cct tgc gtt tga att ttt ctg-3′ | gC-r: 5′-ttc gtg ggt tag agg tct gt-3′ | gC-probe: 5′-d fam-cag ctc ggt gac ccc att cta-bhq-1-3′ |
Callison, 2007. |
Soluções
- Solução de álcool 70º INPM;
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses; e
- Solução de hipoclorito de sódio 0,5%.
Realização do ensaio
Extração de ácidos nucleicos
- Realizar a extração de ácidos nucleicos das amostras incubadas, de forma automatizada ou manual, através de kits de extração de DNA específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Adicionar as seguintes amostras controle a cada procedimento de extração: controle NEGATIVO (líquido alantoide ou água) e controle POSITIVO para ILTV; e
- O laboratório pode optar pelo uso de outro método de extração que não use kit, desde que apresente verificação de desempenho comprovada pelo próprio laboratório.
Reação de amplificação de ácido nucleico por qPCR
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR) isenta de material genético e amplicons, e outra para a transferência de DNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou álcool 70º INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
Preparo do mix de reação
- Preparar o mix de reação de acordo com protocolos validados e específicos para o agente pesquisado (ILTV) em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Após o preparo do mix, adicionar o DNA nos poços da placa ou em microtubos para leitura óptica;
- A adição de DNA e das amostras controle deve ser realizada em uma área distinta do preparo do mix (sala de PCR);
- Devem ser incluídos nas análises:
- Controle POSITIVO para ILTV;
- Controle NEGATIVO da extração;
- Branco (água livre de nucleases); e
- Controle POSITIVO e NEGATIVO do kit utilizado (se houver).
Reação de qPCR
- Selar a placa com adesivo óptico ou fechar a tampa dos microtubos. Verificar se há bolhas no fundo do poço e/ou gotículas na parede dos poços da placa ou tubo. Caso isto ocorra, centrifugar brevemente para reduzir as bolhas e para que o conteúdo se posicione na parte inferior da placa ou tubo;
- Iniciar e entrar com os dados no software do termociclador (identificação das amostras e seleção dos fluoróforos), conforme especificações do fabricante;
- Inserir a placa ou os tubos no termociclador, salvar o arquivo e iniciar a corrida; e
- Ao finalizar, salvar os dados e interpretar os resultados.
Critérios de aceitação do ensaio
- Para a validação do ensaio, o controle POSITIVO do kit e o controle interno devem apresentar uma curva sigmoide (em forma de S) e um Cq satisfatório (conforme especificações do fabricante); e
- O controle NEGATIVO deve ter Cq indeterminado ou maior que o limite do kit. O gráfico do controle NEGATIVO deve apresentar traços de fluorescência na linha de base durante todo o ensaio. Esses traços não devem apresentar curva sigmoide ou um aumento gradual na fluorescência.
Interpretação dos resultados
- Ao analisar os resultados da corrida, o operador deve avaliar os seguintes componentes: controle POSITIVO, controle NEGATIVO, controle da extração, background de fluorescência e gráficos de amplificação de cada amostra individualmente. Após a validação do ensaio, interpretar os resultados conforme especificações do fabricante; e
- Qualquer amostra questionável deverá ser retestada.
Emissão dos resultados
- Os resultados deverão ser emitidos e expressos como “POSITIVO” ou “NEGATIVO”, ou de acordo com o preconizado pelo fabricante; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
Descarte das amostras e resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de itens de ensaio;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo resíduo biológico do ensaio deve ser submetido ao processo de autoclavação apropriado. A efetividade da esterilização deve estar comprovada em procedimentos próprios do laboratório e devem ser utilizados controles físicos, químicos e biológicos para o monitoramento do processo; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
Retenção de Itens de Ensaio
- Amostras negativas podem ser descartadas após um período mínimo de 30 dias da realização das análises, registrando-se em formulários próprios e conferidas antes do descarte; e
- Amostras positivas de qualquer origem devem ser armazenadas a –70 °C ou temperaturas inferiores por tempo indeterminado, incluindo todos os registros e documentação pertinente, devendo as mesmas serem registradas e controladas pelo laboratório responsável pela análise. As alíquotas armazenadas, assim como suas quantidades, devem ser registradas em formulário próprio para fins de inventário.
¶ 5. Base legal e documentos de referência
¶ Influenza Aviária
- ANDREATTI, R. L; BERCHIERI, A; SILVA, E. N; BACK, A; FÁBIO, J; ZUANAZE, M. A. F. Doença das Aves. 2020. 3ª. Ed. FACTA. ISBN 978-65-991079-0-0.
- Avian influenza (including infection with high pathogenicity avian influenza viruses). CHAPTER 3.3.4. Version (NB: version adopted in May 2021). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2021, versão online. Disponível em: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/. Acesso em: 11 jan. 2024.
- BRASIL Ministério da Ciência, Tecnologia e Inovação. Conselho Nacional de Controle de Experimentação Animal. Resolução Normativa nº 13, de 20 de setembro de 2013. “Baixa as Diretrizes da Prática de Eutanasiado Conselho Nacional de Controle de Experimentação Animal – CONCEA”. Publicado no D. O. U. em: 26/09/2013.
- BRASIL. Lei nº 11.794, de 8 de outubro de 2008. “Regulamenta o inciso VII do § 1o do art. 225 da Constituição Federal, estabelecendo procedimentos para o uso científico de animais; revoga a Lei no 6.638, de 8 de maio de 1979; e dá outras providências”. Publicado no D. O. U. em: 09/10/2008.
- Conselho Federal de Medicina Veterinária. Resolução (CFMV). Guia Brasileiro de Boas Práticas em Eutanásia em Animais - Conceitos e Procedimentos Recomendados. Brasília, 2012. 1v, 62p.
- MASSONE, F. Anestesiologia Veterinária – Farmacologia e Técnicas. Guanabara Koogan, 7ª ed. 400p. 2019.
- SPACKMAN E, SENNE DA, MYERS TJ, BULAGA LL, GARBER LP, PERDUE ML, LOHMAN K, DAUM LT, SUAREZ DL. 2002. “Development of a real-time reverse transcriptase PCR Assay for type A influenza virus and the avian H5 and H7 hemagglutinin subtypes”. Journal of Clinical Microbiology, 40 (9): 3256-3260.
¶ Doença de NewCastle
- ANDREATTI, R. L; BERCHIERI, A; SILVA, E. N; BACK, A; FÁBIO, J; ZUANAZE, M. A. F. Doença das Aves. 2020. 3ª. Ed. FACTA. ISBN 978-65-991079-0-0.
- BRASIL Ministério da Ciência, Tecnologia e Inovação. Conselho Nacional de Controle de Experimentação Animal. Resolução Normativa nº 13, de 20 de setembro de 2013. “Baixa as Diretrizes da Prática de Eutanasiado Conselho Nacional de Controle de Experimentação Animal – CONCEA”. Publicado no D. O. U. em: 26/09/2013.
- BRASIL. Lei nº 11.794, de 8 de outubro de 2008. “Regulamenta o inciso VII do § 1o do art. 225 da Constituição Federal, estabelecendo procedimentos para o uso científico de animais; revoga a Lei no 6.638, de 8 de maio de 1979; e dá outras providências”. Publicado no D. O. U. em: 09/10/2008.
- Conselho Federal de Medicina Veterinária. Resolução (CFMV). Guia Brasileiro de Boas Práticas em Eutanásia em Animais - Conceitos e Procedimentos Recomendados. Brasília, 2012. 1v, 62p.
- MASSONE, F. Anestesiologia Veterinária – Farmacologia e Técnicas. Guanabara Koogan, 7ª ed. 400p. 2019.
- WISE M.G., SUAREZ D.L., SEAL B.S., PEDERSEN J.C., SENNE D.A., KING D.J., KAPCZYNSKI D. & SPACKMAN E. (2004). “Development of a real -time reverse-transcription PCR for detection of Newcastle disease virus RNA in clinical samples”. J. Clin. Microbiol., 42, 329–338
- Newcastle disease (infection with Newcastle disease virus) . CHAPTER 3.3.14. Version (NB: version adopted in May 2021). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2021, versão online. Disponível em: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ Acesso em: 11 jan 2024.
¶ Laringotraqueíte Infecciosa das Aves - LTI
- CALLISON, S.A., RIBLET, S.M., OLDONI, I., SUN, S., ZAVALA, G., WILLIAMS, S., RESURRECCION, R.S., SPACKMAN E. E GARCIA, M. “Development and validation of a real-time Taqman® PCR assay for the detection and quantitation of infectious laryngotracheitis virus in poultry”. Journal of Virological Methods, 139: 31-38. 2007.
- CHACÓN J.L. E FERREIRA A.J.P. “Development and validation of nested-PCR for the diagnosis of clinical and subclinical infectious laryngotracheitis”. Journal of Virology Methods, 151(2):188-193. 2008.
- Avian infectious laryngotracheitis. CHAPTER 3.3.3 (NB: Version adopted in May 2021). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2021, versão online. Disponível em: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/. Acesso em: 11 set. 2024.
¶ 6. Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ 7. Histórico de revisões
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1 | - | 13.01.2025 | Elaboração do documento |
| 2 | Laringotraqueite | 31.01.2025 | Inclusão da triagem para ILTV, no metodo de IDGA |