¶ Folha de rosto
© 2024 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Ano 2024
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Esplanada dos Ministérios, Bloco D, Anexo, Ala B, 4º andar, sala 433
CEP: 70043-900, Brasília - DF
www.agricultura.gov.br
e- mail: cgal@agro.gov.br
Central de Relacionamento: 0800 704 1995
Equipe Técnica:
Ana Cristina Gonçalves Pinto da Rocha
Ana Carolina de Oliveira Nascimento
Anapolino Macedo de Oliveira
Aerlem Cynara Silva
Ana Karina Cunha Callado
Andrea Padilha de Alencar
Anselmo Vasconcelos Rivetti Júnior
Antônio Augusto Fonseca Júnior
Cid Aristóteles de Siqueira Alencar
Dilmara Reischak
Fernanda Gomes Cardoso
Isabela Ciarlini de Azevedo
João Marcos Nacif da Costa
Juliana Nabuco Pereira Otaka
Luanda Bispo Santos do Nascimento Maués
Luciana Amaral Pinto
Luciana Rabello Ferreira
Luciana Taborda Corrêa
Marcelo Fernandes Camargos
Marco Antônio de Carvalho Marques Serqueira
Paulo Martins Soares Filho
Patrícia Gomes de Souza
Rene Ribeiro da Silva
Sheila de Matos Xavier
Silvio Orlan de Castro Chaves
Soraya Cecilia Albieri Camillo
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Realizar a padronização, harmonização, atualização e a unificação dos procedimentos para execução de ensaios laboratoriais da área de Diagnóstico Animal |
|||
|
Processo: Análises Laboratoriais |
||||
|
Entrega: Segurança e saúde dos rebanhos animais |
Público alvo e demais interessados: Laboratórios oficiais ou credenciados do Ministério da Agricultura e Pecuária (Mapa) |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos é responsável pela elaboração, atualização e envio para aprovação deste manual, tendo responsabilidade quanto aos procedimentos descritos no documento. |
||||
¶ 1. Definições e conceitos
Não aplicável.
¶ 2. Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário, no mínimo anualmente, pela Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos (CGAL/DTEC).
A gestão desse manual está sob a responsabilidade da CGAL/DTEC que prestará auxílio ao público alvo leitor dúvidas e/ou sugestões quanto à aplicação deste manual devem ser submetidas ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da SDA para acesso pelo público alvo será de responsabilidade da Secretaria representada pelo DTEC.
¶ 3. Objetivo
O objetivo do Manual é reunir os métodos analíticos a serem empregados na execução de ensaios laboratoriais da área de Diagnóstico Animal da Rede Nacional de Laboratórios Agropecuários (Rede LFDA e Laboratórios credenciados junto ao Ministério da Agricultura e Pecuária).
¶ 4. Procedimentos - Bovinos
¶ 4.1 Encefalopatia Espongiforme Bovina - EEB
¶ 4.1.1. Amostras
São consideradas amostras para o diagnóstico da EEB:
Identificação do Agente
ELISA
- Tronco encefálico incluindo o óbex (matriz de eleição);
- Em caso de impossibilidade do envio da matriz de eleição, é possível o ensaio em outro fragmento do Sistema Nervoso Central: medula espinhal, preferencialmente
IMUNOHISTOQUÍMICA
- Tronco encefálico incluindo o óbex (matriz de eleição);
- Em caso de impossibilidade do envio da matriz de eleição, é possível o ensaio em outro fragmento do Sistema Nervoso Central.
Nota 1: Coletar no mínimo 5g de tecido
¶ 4.1.2. Recebimento das Amostras
4.1.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.1.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
4.1.2.3. As amostras deverão ser encaminhadas ao laboratório, individualmente e obedecendo a critérios de biossegurança.
¶ 4.1.3. Técnicas de Diagnóstico
4.1. 3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA ou segundo legislação em vigor;
4.1. 3.2. Todos os insumos utilizados na análise devem ser controlados, previamente testados e aprovados;
4.1. 3.3. O laboratório deverá realizar os ensaios obedecendo as temperaturas preconizadas pelo fabricante dos insumos:
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente.
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente (TA), valores de temperatura entre 18 e 26ºC.
4.1.3.4. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios interpretação dos resultados;
4.1.3.5. O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.1.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.1.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório.
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
4.1.3.8. Os analistas devem receber treinamento adequado sobre os riscos relacionados à EEB e Scrapie e os procedimentos de biossegurança são seguidos;
4.1.3.9. Preferencialmente, área de trabalho e equipamentos dedicados; e
4.1.3.10. Substituir vidro por plásticos, sempre que possível.
¶ A. Ensaio Imunoenzimático (ELISA)
¶ Materiais
- Provetas graduadas;
- Pipetas graduadas;
- Ponteiras descartáveis;
- Placas 96 cavidades;
- Tubos de disrupção de amostra;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Caneta para identificação;
- Cubas para descarte de materiais resistente à autoclavação;
- Recipientes para descarte de resíduo químico;
- Coberturas adesivas e coberturas em plástico rígido para placas 96 poços;
- Tubos para diluição de reagentes;
- Microtubos 1.0 a 2.0 mL, compatíveis com bloco de aquecimento seco 70 ºC (opcional);
- Instrumentos descartáveis para dissecção de amostra (exemplo: facas plásticas);
- Material descartável para pesagem e acondicionamento (exemplo: saco plástico, placa de Petri, prato)
- Sacos plásticos para autoclave, resistentes a temperatura superior a 134OC;
- Caneta permanente ou similar para identificação dos tubos; e
- Equipamentos de proteção, tais como: luvas de nitrila, sapatos e óculos de proteção.
¶ Equipamentos e Instrumentos
- Cabine de Segurança Biológica (CSB) II;
- Balança;
- Micropipetas mono e multicanais
- Homogeneizador de amostras;
- Leitora de ELISA - placas para 96 cavidades
- Computador;
- Lavadora de microplacas (opcional);
- Agitador de placas tipo thermoshaker;
- Bloco de aquecimento seco 70 ºC, para tubos de microcentrifuga de 1.0 a 2.0 mL (opcional);
- Freezer/Ultrafreezer;
- Refrigerador;
- Timer de contagem regressiva; e
- Termômetros.
¶ Insumos
- Kit de ELISA para detecção de proteína priônica PrPsc em tecido sistema nervoso de ruminantes;
¶ Soluções
- No preparo das soluções devem ser utilizados somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução concentrada;
- Diluir as soluções utilizando água ultrapura ou deionizada conforme instruções do fabricante e homogeneizar bem.
¶ Realização do ensaio
¶ Preparo das amostras
- Realizar a preparação da amostra em Cabine de Segurança Biológica;
- Não utilizar solução desinfetante;
- Tecido nervoso: Bulbo na altura do óbex (FIGURAS 1 a 3);
- A amostra de eleição para o ELISA é o óbex (FIGURA 1), sendo no máximo 1,5 cm rostral ao mesmo;
- Posicionar o tronco encefálico com a secção em forma de V para cima;
- Retirar uma porção da hemissecção do óbex com facas descartáveis (FIGURA 2);
- Colocar no tubo de disrupção fragmento, conforme indicado no kit;
- Uma hemissecção e o restante de amostra permanece disponível para os testes de confirmação, conservada sob congelamento (FIGURA 1, FIGURA 2 e FIGURA3);
- Dispor no homogeneizador os tubos de homogeneização contendo as amostras. Homogeneizar conforme orientação do fabricante do kit; e
- Caso o fabricante determine procedimentos diferentes dos estipulados nos itens anteriores, estas novas determinações devem ser adotadas.
FIGURA 1: Localização do óbex
FIGURA 2: Hemissecção do óbex
FIGURA 3: Corte transversal do óbex indica as principais localizações do príon: 1- tracto solitário, 2- núcleo do nervo trigêmeo, 3- núcleo motor dorsal do vago

¶ Realização do Ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (exemplo: papel toalha). Deixar as placas secas o mínimo de tempo possível, não excedendo 5 minutos entre os passos de lavagem e adição de reagentes; e
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante do kit.
¶ Critérios de aceitação do ensaio
O resultado do ensaio será considerado válido somente se as DOs dos controles estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos resultados
- A interpretação dos resultados se baseia na absorbância da amostra;
- Amostras cujas DOs são inferiores ao valor de “cutoff” são consideradas negativas;
- Amostras cujas DOs são iguais ou superiores ao valor de “cutoff”, são consideradas como inicialmente reativas para PrPsc e são novamente testadas conforme recomendação do fabricante do kit;
- Se as repetições forem inferiores ao “cutoff”, a amostra é considerada negativa. Se um dos valores repetidos for igual ou superior ao valor do “cutoff”, a amostra é considerada reativa e é realizado o ensaio confirmatório; e
- Toda amostra reativa em teste rápido deve ser direcionada para teste confirmatório.
¶ Emissão dos resultados
- Os resultados deverão ser emitidos e expresso como “Detectado” e “Não detectado” ou de acordo com o preconizado pelo fabricante do insumo (kit de diagnóstico); e
- As amostras com resultados diferentes de “Não Detectado” no ELISA deverão ser encaminhadas para o Laboratório Federal de Defesa Agropecuário (LFDA) designado para realizar a confirmação através do ensaio complementar de IHQ, prevalecendo o resultado deste.
¶ Descarte das amostras e resíduos
- Antes da realização do descarte de amostras, produtos de ensaio e suas alíquotas deverão ser observadas os prazos mínimos estabelecidos no item “Retenção de Itens de Ensaio”;
- Realizar a conferência das amostras antes do descarte e registrar em formulário próprio.
- Os resíduos devem ser separados antes do descarte e destinados conforme legislação ambiental;
- Todo o material biológico utilizado na realização do ensaio deve ser submetido ao processamento em autoclave por no mínimo 134ºC por 18 minutos e encaminhado para incineração, conforme legislação ambiental. O monitoramento da esterilização deve estar comprovado em procedimentos próprios do laboratório; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
¶ Retenção de itens de ensaio
- As amostras negativas e suas alíquotas são retidas e descartadas, no mínimo, após 30 dias do envio do resultado; e
- Amostras positivas de qualquer origem devem ser armazenadas de forma permanente incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ B. Ensaio Imuno-histoquímico – IHQ
¶ Materiais
- Cuba de vidro com tampa compatível com o berço para amostras a serem coradas;
- Papel absorvente;
- Estantes para desparafinização de lâminas;
- Tubo de ensaio para diluição do anticorpo;
- Papel de filtro qualitativo;
- Funil;
- Ponteiras compatíveis com as micropipetas utilizadas;
- Descartador de ponteiras;
- Papel Alumínio;
- Pissetas, preferencialmente graduadas;
- Provetas graduadas;
- Sacos para resíduo infectante;
- Sacos plásticos para autoclave, resistentes a temperatura igual ou superior a 134ºC;
- Lâmina polarizada dimensões 75 mm x 25 mm com borda pintada curta máxima 19 mm x 25mm, compatível com uso em Shandon/Sequenza: semelhante à Super Frost Ultra Plus;
- Lamínulas de vidro;
- Suporte de lâmina Shandon/Sequenza;
- Berço autoclavável, usado como suporte para coloração de lâminas; e
- Cuba para imersão de lâminas resistente à autoclave 121ºC a 123ºC/25 minutos.
¶ Equipamentos e Instrumentos
- Processador de tecidos para histologia (opcional);
- Micrótomo;
- CSB Classe II B 2;
- Estufa de Incubação Bacteriológica;
- Agitador de tubos, tipo vórtex;
- Micropipetas Monocanais;
- Pipetador automático;
- Autoclave programável que realize inclusive ciclo de 134ºC por no mínimo 18 minutos;
- Microscópio óptico;
- Timer de contagem regressiva;
- Refrigerador; e
- Termômetros.
¶ Insumos
- Água deionizada;
- Xilol grau histológico P.A./ACS;
- Álcool etílico absoluto P.A.;
- Peróxido de Hidrogênio a 30% P.A;
- Ácido Fórmico 98-99%, P.A;
- Solução de recuperação antigênica - (Dako K8005 50X - Target Retrieval solution, pH baixo);
- Anticorpo Monoclonal F99/97.6.1 (VMRD);
- Soro caprino;
- EnVisionTM FLEX/HRP em kit. Marca DAKO código K8002 (Envision Flex /HRP, Envision FlexDAB Cromógeno e Envision Flex Buffer);
- Hematoxilina de Harrys;
- Hidróxido de Amônio em Solução Aquosa (NH4OH, PM 35,05 g/mol, concentração 28 % - 30 %, aproximadamente 15N);
- Meio de montagem não aquoso (ex. Entellan);
- TRIS Base (hydroxymethyl) aminomethane (NH2C(CH2OH)3, PM 121,14 g/mol);
- Ácido Clorídrico Concentrado (HCl, PA, 36,5%, PM 36,46 g/mol);
- Cloreto de sódio (NaCl, PM 58,44 g/mol); e
- Tween 20 (Monooleato Polioxietileno Sorbitano).
¶ Soluções
- Solução de Álcool etílico 95%;
- Solução de Álcool etílico 80%;
- Solução Tris Tween 20 (50MM TRIS-HCL, 300 MM NACL, 0,1% TWEEN 20, pH7.6);
- Solução Tris HCl 0,1 mol/L, pH 7.6;
- Solução Aquosa de Hidróxido de Amônia 37 mM;
- Solução de Peróxido de Hidrogênio a 3% em água;
- Solução de Recuperação (Target Retrieval) diluída 1:50 em água;
- Solução de 5% de soro caprino em Tris Tween 20;
- Anticorpo 1:18.000 em solução Tris Tween 20; e
- Solução de DAB diluído conforme fabricante.
¶ Realização do ensaio
¶ Preparo dos reagentes/soluções
- Quando não determinado pelo protocolo, diluir a soluções utilizando água ultrapura ou deionizada e homogeneizar bem;
- A bateria de reagentes da fase pré-kit é composta por cubas de vidro com tampas e identificações dos reagentes: xilol (cubas 1 e 2); álcool etílico absoluto (cubas 1 e 2); álcool 95% (cubas 1 e 2); álcool 80% (cubas 1 e 2);
- A solução de Ácido Fórmico pode ser mantida em cuba e reutilizada em até cinco vezes;
- Preparar no momento ou próximo ao uso as soluções: Peróxido de Hidrogênio 3%, Recuperação Antigênica, Anticorpo diluído e Cromógeno DAB;
- Filtrar a hematoxilina em papel de filtro qualitativo no dia do uso; e
- Não permitir que as lâminas sequem em nenhuma das etapas da imuno-histoquímica.
¶ Preparo das amostras
- Realizar a preparação da amostra em Cabine de Segurança Biológica;
- Amostra de eleição a ser testada: constituída por fragmento de bulbo, próximo ao óbex, devidamente fixado em formol a 10% tamponado. Incluir fragmento de cerebelo, sempre que disponível; e
- Etapas iniciais do processamento: as fases pré-analíticas são de técnicas comuns histológicas: Fixação; Clivagem; Processamento Histológico; Inclusão em Parafina e Microtomia.
¶ Desparafinização
- Realizar preferencialmente no mesmo dia do ensaio;
- Incubar a 54 ºC a 62 ºC por aproximadamente uma hora; e
- Retirar e deixar em temperatura ambiente até secar por no mínimo 30 minutos.
¶ Técnica de Imuno-histoquímica - IHQ
- Todas as etapas são executadas a 21ºC a 25ºC, exceto quando indicado. As soluções/reagentes de coloração são usadas na temperatura ambiente (TA);
- Colocar as lâminas no berço de coloração; e
- Após imergir o berço em cada reagente/solução, escorrer em papel toalha, antes de imergir na próxima cuba.
¶ Desparafinização/Reidratação dos Tecidos
- Imergir em Xilol e incubar por 4 minutos. Duas vezes;
- Imergir em Álcool Etílico Absoluto e incubar por 2 minutos. Duas vezes;
- Imergir em Álcool Etílico a 95% e incubar por 2 minutos. Duas vezes;
- Imergir em Álcool Etílico a 80 % e incubar por 2 minutos. Duas vezes; e
- Imergir em água deionizada por dez vezes.
¶ Bloqueio da Peroxidase Endógena
- Imergir em Solução de Peróxido de Hidrogênio a 3% em água, recém preparada, incubar por 10 minutos; e
- Imergir em água deionizada por dez vezes. As lâminas podem permanecer na água por algumas horas, se necessário.
¶ Ativação do Antígeno
- Imergir em Ácido Fórmico 98-99%, incubar por 5 minutos;
- Imergir em água deionizada por dez vezes;
- Imergir em Solução Tris HCl 0,1M pH 7,6 por 3 trocas (3 minutos, 2 minutos e 2 minutos);
- Transferir o suporte com as lâminas para um recipiente resistente ao calor, contendo a Solução de Recuperação (Target Retrieval) previamente diluída 1:50, envolver em papel alumínio e processar em autoclave a 121°C a 123°C por 25 minutos;
- Resfriar;
- Manter as lâminas em Solução Tris Tween 20 até a montagem em Sistema Shandon-Sequenza; e
- Montar as lâminas no Sistema Shandon-Sequenza (FIGURAS 4 a 9). Pipetar 100 µL de Solução Tris Tween 20 e incubar por 5 minutos.
¶
¶ Montagem no Sistema Shandon-Sequenza
FIGURA 4: Montagem da rack Sistema Shandon-Sequenza

FIGURA 5: Rack montada do Sistema Shandon-Sequenza
FIGURA 6: Clip do Sistema Shandon-Sequenza

FIGURA 7: Encaixe da lâmina no clip Sistema Shandon-Sequenza
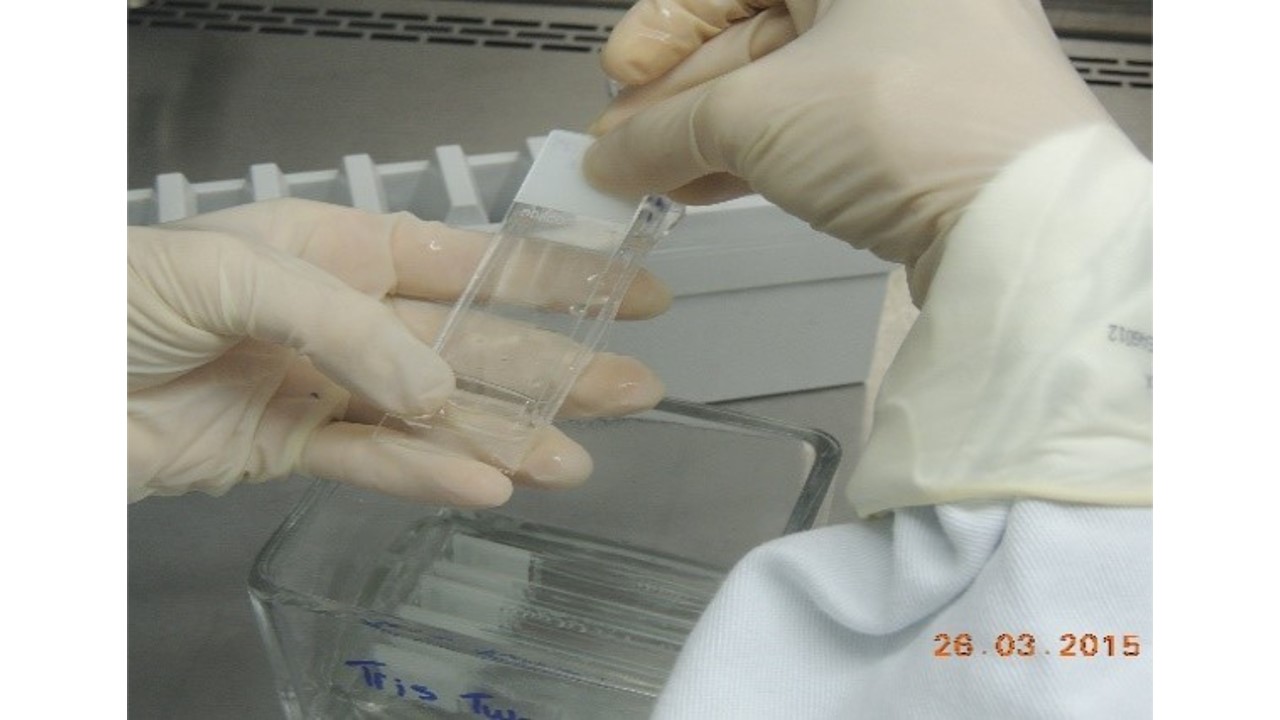
FIGURA 8: Lâmina montada no clip Sistema Shandon-Sequenza
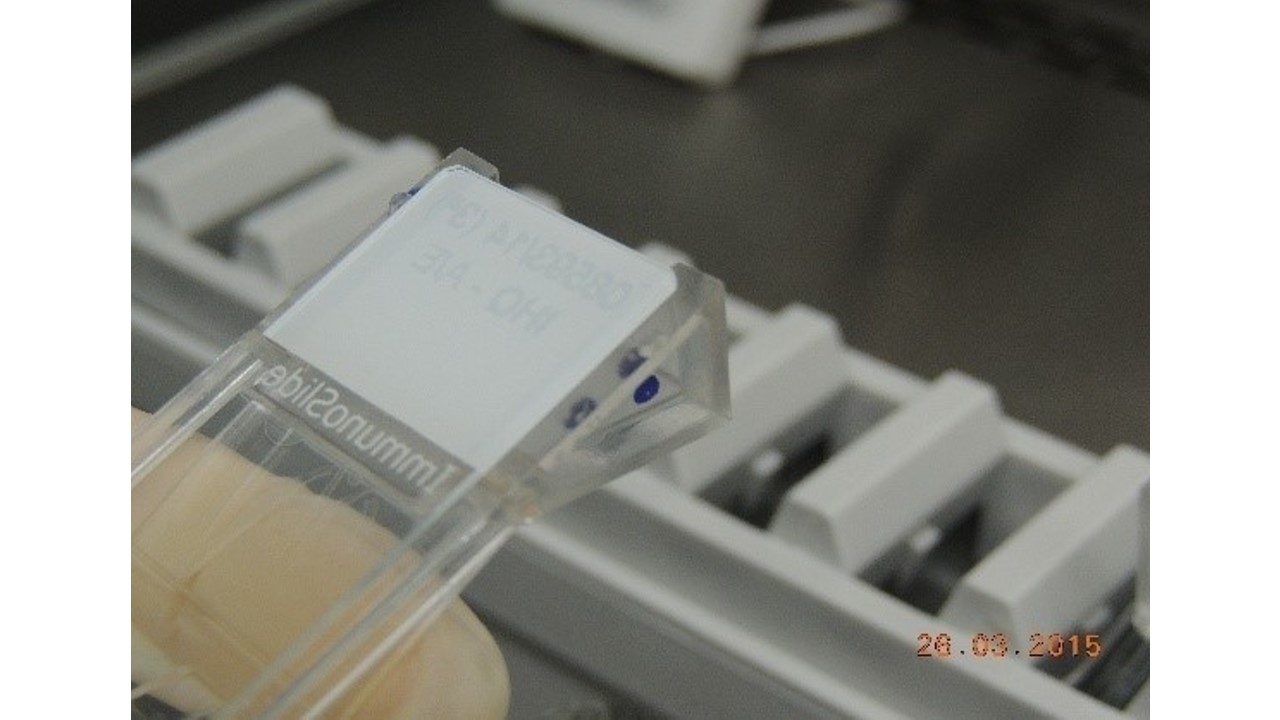
FIGURA 9: Lâmina com reagente montada no Sistema Shandon-Sequenza

¶ Imunocoloração
- Pipetar 100 µL de solução de 5 % de soro caprino em Tween 20 e incubar por 15 minutos;
- Pipetar 100 µL de solução de anticorpo diluído 1:18000, incubar TA por uma hora ou incubar a 4°C a 8°C overnight;
- Adicionar Solução Tris Tween 20 com pisseta e incubar por 5 minutos, duas vezes;
- Pipetar 100 µL do Envision Flex /HRP e incubar por 30 minutos;
- Adicionar Solução Tris Tween 20 com pisseta e incubar por 5 minutos, duas vezes;
- Adicionar água deionizada com pisseta e incubar por 2 minutos, duas vezes;
- Pipetar 100 µL de cromógeno DAB incubar de 5 a 30 minutos (média 10 minutos) Opcionalmente monitorar, microscopicamente, o tempo de incubação até que a intensidade de coloração desejada seja obtida;
- Adicionar água deionizada com pisseta e incubar por 2 minutos, duas vezes;
- Retirar as lâminas do Sistema Shandon-Sequenza, colocar no berço;
- Imergir (1 banho) em Solução de Hematoxilina de Harrys;
- Imergir em água deionizada, por no mínimo 4 vezes;
- Imergir em Solução aquosa de Amônia 37mM por até 10 vezes, ou até que seja perceptível a mudança da coloração do corte histológico para azul;
- Imergir em água deionizada e incubar por 2 a 5 minutos;
- Imergir em Álcool Etílico a 80 % e incubar por 2 minutos. Duas vezes;
- Imergir em Álcool Etílico a 95% e incubar por 2 minutos. Duas vezes;
- Imergir em Álcool Etílico Absoluto e incubar por 2 minutos. Duas vezes;
- Imergir em Xilol e incubar por 4 minutos. Duas vezes; e
- Manter no Xilol durante a montagem das lâminas em Entellan.
¶ Montagem das lâminas
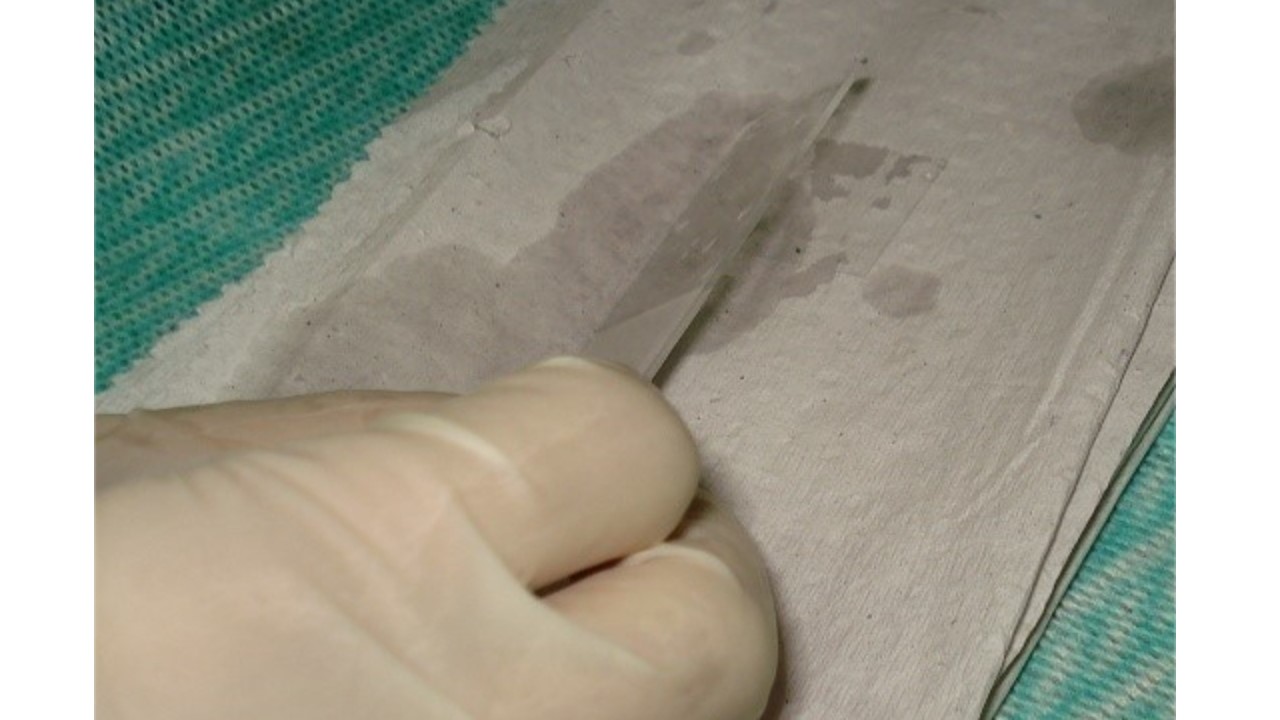
- Dispor a lâmina horizontalmente com o corte voltado para cima, pingar duas gotas de meio de montagem não aquoso sobre o corte histológico. Ajustar a quantidade de gotas conforme o tamanho do corte;
- Colocar a lamínula encostando-a no meio de montagem numa angulação aproximada de 45° (FIGURA 10), soltando-a lentamente em direção ao corte para que não haja formação de bolhas. Esta etapa pode ser feita de forma contrária, posicionando a lâmina em cima da lamínula (FIGURA 11), conforme preferência do executor.
FIGURA 10: Montagem da lâmina

FIGURA 11: Montagem da lâmina
¶ Critérios de aceitação
- Para cada rodada são usados controles positivos e negativos, distribuídos preferencialmente no início e final da rodada. A rodada de provas é considerada válida quando os controles
- Quando os controles não funcionarem adequadamente, repetir a prova.
¶ Interpretação dos resultados
Realizar a leitura em microscópio óptico. São observadas as reações características em marrom nos cortes positivos (FIGURAS 12 e 13) e a coloração totalmente azul nos cortes negativos (FIGURAS 14 e 15).
FIGURA 12: Presença de imunomarcação em aumento de 400x

FIGURA 13: Presença de imunomarcação em aumento de 400x
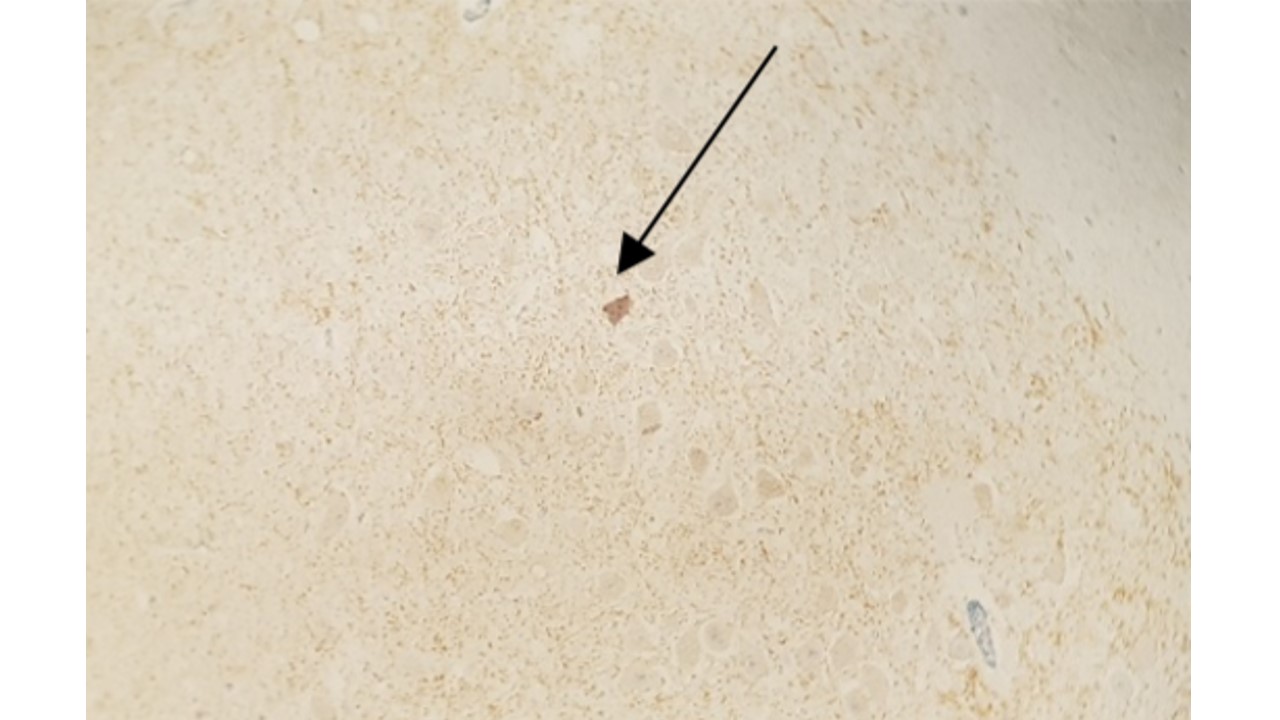
FIGURA 14: Ausência de imunomarcação em aumento de 400x

FIGURA 15: Ausência de imunomarcação em aumento de 400x

¶ Amostra de Tecido Nervoso
¶ Positivo
Quando precipitado marrom característico (FIGURAS 12 e 13) é observado nos neurônios e/ou demais células nervosas que compõem o óbex ou segmento do SNC mais próximo (na ausência do óbex). Os tipos de imunomarcações descritas na IHQ para as Encefalopatias Espongiformes Transmissíveis são as citadas abaixo:
- Imunomarcação particulada no neurópilo da substância cinzenta (dendritos) é a principal forma de imunomarcação específica para a doença. As áreas mais comumente afetadas na EEB são o trato espinhal do núcleo trigêmio, o núcleo e o trato solitário, e o núcleo dorsal do vago;
- Concentrado granular ou particulado margeando neurônios e seus prolongamentos;
- Imunomarcação granular fina ou particulada intraneuronal nos núcleos alvo;
- Depósitos lineares de proteína priônica associados com dendritos;
- Imunomarcação estrelar (reticular) multifocal, provavelmente associada às células da glia;
- Imunomarcação fibrilar, granular ou particulada ao redor de vasos sanguíneos e epêndima; e
- Intensa imunomarcação em forma de “placas”. Comumente observadas na Doença Crônica Depauperante dos cervídeos, menos comum no Scrapie e rara na EEB.
¶ Negativo
Quando não há precipitado marrom granular característico, estando o corte histológico totalmente corado em azul (FIGURAS 14 e 15).
¶ Inconclusivo
Quando há imunomarcação inespecífica.
¶ Imprópria
Amostra sem condições para análise após repetições.
¶ Emissão dos resultados
Os resultados deverão ser emitidos e expresso como “Positivo”, “Negativo”; “Inconclusivo” ou “Imprópria” .
¶ Descarte das amostras e resíduos
- Antes da realização do descarte de amostras, produtos de ensaio e suas alíquotas, deverão ser observados os prazos mínimos estabelecidos no item “Retenção de Itens de Ensaio”;
- Realizar a conferência das amostras antes do descarte e registrar em formulário próprio.
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos;
- Todo o material utilizado na realização do ensaio deve ser submetido ao processo de “esterilização” em autoclave por no mínimo 134ºC por 18 minutos e encaminhado para incineração, conforme legislação ambiental. O monitoramento da esterilização deve estar comprovado em procedimentos próprios do laboratório;
- O resíduo químico (reagentes e/ou amostras fixadas em formol) deve ser identificado e encaminhado para incineração, conforme legislação ambiental; e
- O laboratório deve assegurar a biossegurança dos resíduos gerados, e seguir as legislações ambientais vigentes durante todo o processo do descarte.
¶ Retenção de itens de ensaio
- As amostras negativas e suas alíquotas são retidas e descartadas, no mínimo, após 30 dias do envio do resultado; e
- Amostras positivas de qualquer origem devem ser armazenadas de forma permanente incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ 5. Base legal e documentos de referência
- A Study on the Analytical Sensitivity of 6 BSE Tests Used by the Canadian BSE Reference Laboratory, 2011. Gray JG, Dudas S, Czub S (2011) A Study on the Analytical Sensitivity of 6 BSE Tests Used by the Canadian BSE Reference Laboratory. PLoS ONE 6(3): e17633. https://doi.org/10.1371/journal.pone.0017633.
- Advisory Committee on Dangerous Pathogens Spongiform Encephalopathy. Transmissible Spongiform Encephalopathy Agents: Safe working and the prevention of infection. 46p., March, 1998.
- Biosafety in Microbiological and Biomedical Laboratories.6ª Edição, revisado em junho/2020. U.S. Department of Health and Human Service, Public Health Service, Centers for Disease Control and Prevention, National Institutes of Health.
- Bovine Spongiform Encephalopathy. Chapter 3.4.5. Version (VN: adopted in May 2021 Mnual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2021, versão online. Disponível em: https://www.oie.int/en/standard-setting/terrestrial-manual/access-online/. cesso em: 16 de março. de 2024.
- Canadian Biosafety Handbook. 2ª Edição, revisado em março/2021. Disponível em https://www.canada.ca/en/public-health/services/canadian-biosafety-standards-guidelines/handbook-second-edition.html#s25. Acesso em 30 de maio. de 2024
- Comparative Performance of Three TSE Rapid Tests for Surveillance in Healthy Sheep Affected by Scrapie, Journal of Virological Methods 173 (2011) 161-168.
- Czub, S, Graham, C e Pickles, T. Procedimento Padrão CFIA. Immunohistochemical Detection of Prion Protein in Bovine Spongiform Encephalopathy. CFIA, v 1.10, December 2017, 33p.
- Deeber, S.O.S, et al. Transmissible Spongiform Encephalopathy Diagnosis Using Prpsc Immunohistochemistry on Fixed but Previously Frozen Brain Samples. Journal of Histochemistry & Citochemistry, v. 50, n. 5, p. 611-616, Maio, 2002.
- Evaluation of Two Commercial, Rapid, ELISA kits Testing for Scrapie in Retro-Pharyngeal lymph nodes in Sheep, 2014.
- Fixation, Tissue Processing, Histology and Immunohistochemistry Procedures for Diagnosis of Animal TSE (BSE, Scrapie, Atypical Scrapie), APHA 2018.
- Guidelines Evaluation of Changes to Approved Protocols for TSE Rapid Tests and Details of Information to be Supplied by rapid Test manufacturers to the EURL.Versão 11.0. Disponível em https://science.vla.gov.uk/tse-lab-net/documents/tse-guide-test.pdf.
- Guidelines for the for the Submission of Samples for TSE Confirmatory Testing. Animal & Plant Health Agency. Revisado em janeiro 2019.
- Instrutivo do Kit Herdchek* Antígeno BSE-Scrapie 06-08519-12. Versão # 12.
- Meloni D, Davidse A, Langeveld JPM, Varello K, Casalone C, Corona C, et al. (2012) EU-Approved Rapid Tests for Bovine Spongiform Encephalopathy Detect Atypical Forms: A Study for Their Sensitivities. PLoS ONE 7(9): e43133. https://doi.org/10.1371/journal.pone.0043133.
- Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. AHVLA. Disponível em https://science.vla.gov.uk/tseglobalnet/documents/Confirmatory%20(Histo%20&%20IHC)%20diagnostic%20criteria_Rev_Jan2019.pdf . Revisado em janeiro 2019.
- O’ROURKE, I. K. et al. Active surveillance for Scrapie by third eyelid biopsy and genetic susceptibility testing of flocks of sheep in Wyoming. Clinical Diagnostic Laboratory Immunology, v. 9, n. 5, p. 966-971, Sept. 2002.
- O’ROURKE, I. K. et al. Preclinical diagnosis of Scrapie by immunohistochemistry of third eyelid lymphoid tissue. Journal of Clinical Microbiology, v. 38, n. 9, p. 3254-3259, Sept. 2000.
- Pathogen Safety Data Sheet – BovineSpongiformEncephalopathy, disponível em https://inspection.canada.ca/animal-health/terrestrial-animals/diseases/reportable/bovine-spongiform-encephalopathy/eng/1323991831668/1323991912972. Acesso em 16 de abril de 2024.
- Scientific Opinion Analytical Sensitivity of Approved TSE Rapid Tests – EFSA Panel on Biological Hazards (BIOHAZ), 2009.
- Scientific Opinion on Sensitivity of Approved TSE rapid tests – new data for assessment of two rapid tests – European Food Safety Authority (EFSA), Parma, Italy. EFSA Journal 2010; 8 (4): 1591.
- Scientific Opinion on the Evaluation of the New TSE rapid test submitted in the Framework of the Comission Call for Expression of Interest 2007/S204-247339- EFSA Panel on Biological Hazards (BIOHAZ), 2012.
- TSE confirmatory and discriminatory testing. Disponível em https://science.vla.gov.uk/tseglobalnet/confirmatory-diagnosis.html
- WEBSTER, J. D. et al. Effects of prolonged formalin fixation on diagnostic immunohistochemistry in domestic animals. Journal of Histochemistry &Citochemistry, v. 57, n. 8, p. 753 - 761, 2009.
¶ 6. Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ 7. Histórico de revisões
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1 | -//- | 05.09.2024 | Elaboração do documento |