¶ Folha de rosto
© 2024 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Ano 2024
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Esplanada dos Ministérios, Bloco D, Anexo, Ala B, 4º andar, sala 433
CEP: 70043-900, Brasília - DF
www.agricultura.gov.br
e- mail: cgal@agro.gov.br
Central de Relacionamento: 0800 704 1995
Equipe Técnica:
Ana Cristina Gonçalves Pinto da Rocha
Ana Carolina de Oliveira Nascimento
Anapolino Macedo de Oliveira
Aerlem Cynara Silva
Ana Karina Cunha Callado
Andrea Padilha de Alencar
Anselmo Vasconcelos Rivetti Júnior
Antônio Augusto Fonseca Júnior
Cid Aristóteles de Siqueira Alencar
Dilmara Reischak
Fernanda Gomes Cardoso
Isabela Ciarlini de Azevedo
João Marcos Nacif da Costa
Juliana Nabuco Pereira Otaka
Luanda Bispo Santos do Nascimento Maués
Luciana Amaral Pinto
Luciana Rabello Ferreira
Luciana Taborda Corrêa
Marcelo Fernandes Camargos
Marco Antônio de Carvalho Marques Serqueira
Paulo Martins Soares Filho
Patrícia Gomes de Souza
Rene Ribeiro da Silva
Sheila de Matos Xavier
Silvio Orlan de Castro Chaves
Soraya Cecilia Albieri Camillo
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Realizar a padronização, harmonização, atualização e a unificação dos procedimentos para execução de ensaios laboratoriais da área de Diagnóstico Animal |
|||
|
Processo: Análises Laboratoriais |
||||
|
Entrega: Segurança e saúde dos rebanhos animais |
Público alvo e demais interessados: Laboratórios oficiais ou credenciados do Ministério da Agricultura e Pecuária (Mapa) |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos é responsável pela elaboração, atualização e envio para aprovação deste manual, tendo responsabilidade quanto aos procedimentos descritos no documento. |
||||
¶ 1. Definições e conceitos
Não aplicável.
¶ 2. Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário, no mínimo anualmente, pela Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos (CGAL/DTEC).
A gestão desse manual está sob a responsabilidade da CGAL/DTEC que prestará auxílio ao público alvo leitor dúvidas e/ou sugestões quanto à aplicação deste manual devem ser submetidas ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da SDA para acesso pelo público alvo será de responsabilidade da Secretaria representada pelo DTEC.
¶ 3. Objetivo
O objetivo do Manual é reunir os métodos analíticos a serem empregados na execução de ensaios laboratoriais da área de Diagnóstico Animal da Rede Nacional de Laboratórios Agropecuários (Rede LFDA e Laboratórios credenciados junto ao Ministério da Agricultura e Pecuária).
¶ 4. Procedimentos - Equinos
¶ 4.1 ANEMIA INFECCIOSA EQUINA - AIE (Outubro 2024)
¶ 4.1.1 Amostras
São consideradas amostras para o diagnóstico da Anemia Infecciosa Equina:
Detecção da Resposta Imune
Soro sanguíneo
¶ 4.1.2. Recebimento das Amostras
4.1.2.1. Para atendimento aos Programas e Controle Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.1.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
4.1.2.3. A aliquotagem, identificação, manutenção, armazenamento e descarte das amostras são de inteira responsabilidade do laboratório.
¶ 4.1.3. Técnicas de Diagnóstico
4.1.3.1 Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo legislação em vigor;
4.1.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.1.3.3. O laboratório deverá realizar os ensaios obedecendo as temperaturas preconizadas pelo fabricante dos insumos:
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização em temperatura ambiente;
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18ºC e 25ºC.
4.1.3.4. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios de interpretação dos resultados;
4.1.3.5 .O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.1.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.1.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
4.1.3.8. Para realização do ensaio de ELISA e IDGA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
4.1.3.9. A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com o fabricante do kit.
¶ A. ENSAIO IMUNOENZIMÁTICO (ELISA)
¶ Materiais
- Luvas para procedimentos
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Selador ou tampa para placas de ELISA;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
¶ Equipamentos e Instrumentos
- Geladeira;
- Estufa;
- Termômetros;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional);
- Autoclave; e
- Lavadora de microplacas (opcional).
¶ Insumos
Kit de ELISA de detecção de anticorpos para o vírus da Anemia Infeciosa Equina.
¶ Soluções
- No preparo das soluções devem ser utilizados somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados,
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução concentrada fornecida no kit;
- Diluir as soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar bem.
¶ Realização do Ensaio
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas suavemente ou utilizando um agitador de placas;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos, batendo a placa em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente;
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
¶ Critérios de Aceitação do Ensaio
O resultado do ensaio será considerado válido somente se as DOs dos soros controles estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos Resultados
- De acordo com as DOs obtidas consideram-se os resultados negativo, positivo ou outro parâmetro indicado na bula do kit; e
- As amostras positivas no ELISA devem ser testadas em triplicata no ensaio de IDGA na mesma roseta, prevalecendo o resultado deste.
¶ Emissão dos Resultados
- Os resultados deverão ser emitidos e expressos como “POSITIVO” ou “NEGATIVO” ou outro parâmetro indicado na bula do kit e uma cópia do documento com o resultado deve ser arquivada no laboratório por um período mínimo de 5 anos após sua emissão;
- O laboratório credenciado deve anexar a “Requisição para Diagnóstico” de cada animal ao documento com o resultado; e
- Resultado POSITIVO do teste ELISA, deve ser emitido somente após a finalização do teste de IDGA e no mesmo documento.
¶ Descarte de Amostras e Resíduos
- As amostras devem ser registradas em formulários próprios e conferidas antes do descarte. Serão submetidas ao processo de autoclavação com temperatura de 121°C durante 30 minutos para então serem descartadas.
- Todo material utilizado na realização do ensaio, que não for autoclavável, deve ser imerso completamente em cuba com solução de ácido cítrico 0,2% ou de hipoclorito de sódio 0,5% durante no mínimo 60 minutos. Após esse período, conforme o material, pode ser descartado ou reutilizado após devida higienização; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de itens de ensaio
- As amostras de soros podem ser descartadas após um período mínimo de 60 dias após a emissão do resultado, registrando-se nos formulários próprios e conferidas antes do descarte; e
- Durante o período de armazenamento as amostras devem ser armazenadas congeladas em temperatura de no máximo -10°C.
¶ B. IMUNODIFUSÃO EM GEL DE ÁGAR (IDGA)
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Lâmina para microscópio de 25x75mm ou Placa de Petri de 100mm de diâmetro;
- Descartador de ponteiras;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
¶ Equipamentos e Instrumentos
- Geladeira;
- Freezer;
- Micro-ondas;
- Micropipetas;
- Pipetador automático ou manual;
- Balança analítica;
- Centrífuga;
- Cortador Padrão;
- Câmara Úmida;
- Medidor de pH;
- Autoclave;
- Fonte de luz; e
- Destilador ou deionizador de água.
¶ Insumos
- Kits de Imunodifusão em gel de ágar (IDGA) de detecção de anticorpos para o vírus da Anemia Infeciosa Equina - AIE.
- NaOH; e
- H3BO3
¶ Soluções
- Tampão Borato;
- Ágar Borato a 1%; e
- Ácido cítrico 0,2% ou Hipoclorito de sódio 0,5%.
¶ Realização do Ensaio
- Identificar as lâminas ou placas de Petri conforme o formulário de acompanhamento do ensaio utilizando caneta apropriada; e
- Aquecer o Ágar Borato a 1%, em micro-ondas, por tempo necessário até a completa fusão, evitando o borbulhamento e extravasamento.
- Distribuir o gel na lâmina (4,5 ml) ou placa de Petri (15 ml a 17 ml) e deixá-lo solidificar em temperatura ambiente (20°C a 25°C) ou de refrigeração (2°C a 8°C) durante 30 minutos;
- Perfurar o gel com auxílio do cortador padrão, posicionando as rosetas de forma equidistante;
- Remover o gel dos poços das rosetas;
- Armazenar as lâminas ou placas de Petri na câmara úmida se não forem utilizadas imediatamente, para evitar o ressecamento do gel.
- Homogeneizar as amostras antes do uso;
- Distribuir as amostras a serem testadas, alternadamente, nas posições 1, 2 e 3 (FIGURA 1).
- Distribuir o soro controle positivo (SP), alternadamente com as amostras testadas (FIGURA 1).
- Distribuir o antígeno (Ag) no poço central (FIGURA 1).
- Durante a distribuição evitar o extravasamento de material dos poços. Quando corretamente distribuídos, a superfície fica levemente côncava. Em caso de extravasamento, descartar a lâmina;
- Incubar em câmara úmida durante 48 horas;
- Registrar a temperatura, no momento inicial da incubação, com 24 horas e 48 horas;
- Realizar a leitura após 48 horas de incubação com auxílio de uma fonte de luz; e
- O resultado final somente será emitido após a leitura com 48 horas.
FIGURA 1: Roseta com posicionamento do soro controle positivo (SP), antígeno (Ag) e amostras para teste (1, 2 e 3).
¶ Critérios de Aceitação do Ensaio
Será considerado válido somente se ocorrer a formação de uma linha nítida de precipitação entre o Controle Positivo do kit e o antígeno. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos Resultados
¶ NEGATIVO
As linhas formadas entre o Antígeno e o Controle Positivo prolongam-se até a cavidade onde se encontram a amostra testada, sem encurvar-se (FIGURA 2 – reação “Neg” e FIGURA 3-A).
¶ POSITIVO
A linha de precipitação formada entre o Antígeno e o Controle Positivo se funde com aquela formada com amostra testada, constituindo uma linha contínua de identidade total (FIGURA 2 – reação 4 e FIGURA 3-B).
- Fraco Positivo: a linha de precipitação se forma mais próximo à cavidade onde se encontra a amostra testada, visualizando-se somente uma convergência das duas linhas do controle na direção da cavidade onde se encontra a amostra (FIGURA 2 – reação 1, 2 e 3 e FIGURA 3-C);
- Forte Positivo: a linha de precipitação do soro testado apresenta-se como uma faixa difusa entre as duas linhas dos soros controles, ou pode não ser visualizada, observando-se apenas as duas linhas de controle interrompidas, a mesma distância do poço do soro em teste. (FIGURA 4). As amostras que apresentarem reações suspeitas de serem forte positivas devem ser diluídas em tampão borato e retestadas nas diluições seriadas em base 2 (1:2, 1:4, ou mais, se necessário. (FIGURA 4).
- Linhas Inespecíficas: a reação é inespecífica, não forma uma linha contínua com as do controle, ou seja, não há reação de identidade (Fig. 3D - poço 3). Elas são formadas por outras reações Ag-Ac que não aquela específica para o virus da AIE, podendo ser observada tanto em reações positivas quanto negativas.
As amostras positivas no IGDA devem ser reensaiadas em triplicata na mesma roseta, prevalecendo o resultado deste teste.
Caso o ensaio inicial tenha sido realizado utilizando 3 poços o reensaio não é necessário, prevalecendo o resultado deste.
FIGURA 2: Padrões de reações do ensaio de imunodifusão em gel de ágar.
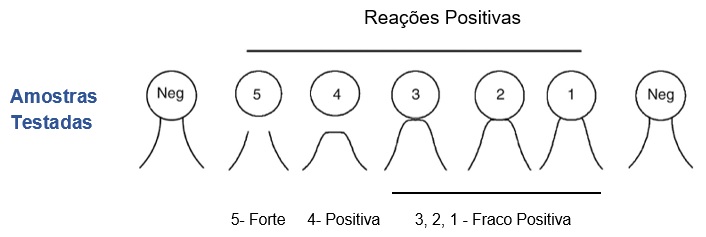
FIGURA 3: Padrões de reações do ensaio de Imunodifusão em gel de ágar.
FIGURA 4: Reações do soro forte positivo, testado em diluições seriadas.
¶ Emissão dos Resultados
- Os resultados deverão ser emitidos e expresso como “POSITIVO” ou “NEGATIVO” e
- O laboratório credenciado deve anexar a “Requisição para Diagnóstico” de cada animal ao Relatório de Ensaio.
¶ Descarte de Amostras e Resíduos
- As amostras devem ser registradas em formulários próprios e conferidas antes do descarte. Serão submetidas ao processo de autoclavação com temperatura de 121°C durante 30 minutos para então serem descartadas.
- Todo material utilizado na realização do ensaio, que não for autoclavável, deve ser imerso completamente em cuba com solução de ácido cítrico 0,2% ou de hipoclorito de Sódio 0,5% durante no mínimo 60 minutos. Após esse período, conforme o material, pode ser descartado ou reutilizado após devida higienização; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de Itens de Ensaio
- As amostras de soros podem ser descartadas após um período mínimo de 60 dias após a emissão do Relatório de Ensaio, registrando-se nos formulários próprios e conferidas antes do descarte; e
- Durante o período de armazenamento as amostras devem ser armazenadas congeladas em temperatura de no máximo -10°C.
¶ 4.2 Mormo
¶ 4.2.1 Amostras
São consideradas amostras para o diagnóstico do Mormo:
Detecção da Resposta Imune
Soro sanguíneo.
¶ 4.2.2 Recebimento das Amostras
4.2.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento;
4.2.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras; e
4.2.2.3. As amostras deverão ser encaminhadas ao laboratório, individualmente separadas por matriz, e obedecendo a critérios de biossegurança.
¶
4.2.3 Técnicas de Diagnóstico
4.2.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo legislação em vigor;
4.2.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.2.3.3. O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos;
4.2.3.4. Quando esta informação não constar na bula, o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização em temperatura ambiente;
4.2.3.5. Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18ºC e 25ºC.
4.2.3.6. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios interpretação dos resultados;
4.2.3.7. O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios; e
4.2.3.8. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada.
¶ A. Ensaio Imunoenzimático (ELISA)
¶ Materiais
- Béqueres;
- Caneta para identificação de vidraria;
- Cubas para descarte de materiais resistentes à autoclavação;
- Descartador de ponteiras;
- Erlenmeyers;
- Luvas para procedimentos;
- Papel absorvente;
- Pipetas de vidro graduadas ou descartáveis;
- Placa auxiliar de 96 poços para diluição das amostras;
- Ponteiras descartáveis;
- Provetas graduadas;
- Reservatórios para soluções (cubetas); e
- Selador ou tampa para placas de ELISA.
¶ Equipamentos e Instrumentos
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional);
- Autoclave;
- Cronômetro;
- Estufa;
- Freezer -20ºC;
- Lavadora de microplacas (opcional);
- Leitora de ELISA;
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Refrigerador; e
- Termômetros.
¶ Insumos
Kits de ELISA de detecção de anticorpos para Burkholderia mallei.
¶ Soluções
- No preparo das soluções deve ser utilizado somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução; e
- Diluir as soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar bem.
¶ Realização do Ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente;
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
¶ Critérios de Aceitação do Ensaio
O resultado do ensaio será considerado válido somente se as Densidade Ótica (DOs) dos soros controles estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos Resultados
De acordo com as DOs obtidas, após realização do cálculo determinado pelo fabricante, considera-se o resultado “Positivo”, “Negativo” ou outra opção indicada na bula do kit;
¶ Emissão dos Resultados
- Os resultados deverão ser e expressos como “Positivo” ou “Negativo” ou de acordo com o preconizado pelo fabricante do insumo (kit de diagnóstico); e
- O laboratório credenciado deve anexar a “Requisição para Diagnóstico” de cada animal ao resultado.
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de Itens de Ensaio”;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período o material deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório;
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte; e
- Realizar a conferência das amostras antes do descarte e registrar em formulário próprio.
¶ Retenção de Itens de Ensaio
- As amostras de soros podem ser descartadas após um período mínimo de 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidas antes do descarte; e
- Durante o período de armazenamento as amostras devem ser armazenadas congeladas em temperatura de no máximo -10°C.
¶ B. Ensaio de Fixação de Complemento (FC)
¶ Materiais
- Balão de fundo chato;
- Caneta tipo retroprojetor ponta fina;
- Cuba para banho de gelo;
- Cubetas para reagentes;
- Estante para tubos de ensaio e tubos de centrífuga;
- Erlenmeyer;
- Gaze estéril;
- Microplacas com fundo em “U” com 96 poços;
- Microtubo plástico;
- Papel alumínio;
- Papel milimetrado di-Log;
- Papel milimetrado;
- Pipetas de vidro graduadas ou descartáveis;
- Ponteiras descartáveis;
- Régua milimetrada;
- Tubo de ensaio de vidro; e
- Tubo plástico de fundo redondo para centrífuga.
¶ Equipamentos e Instrumentos
- Agitador de tubos;
- Agitador de microplacas;
- Autoclave;
- Banho-maria (63ºC ± 2°C);
- Banho-maria (59ºC ± 2°C);
- Banho-maria (37ºC ± 2°C);
- Centrífuga refrigerada (900x g);
- Cronômetro;
- Espectrofotômetro digital (540 nm);
- Estufa (37ºC ± 2°C);
- Freezer -20°C;
- Pipetador automático;
- Micropipeta mono e multicanal de volume regulável;
- Refrigerador; e
- Ultrafreezer -70ºC ou nitrogênio líquido.
¶ Insumos
- Antígeno para teste de FC para mormo;
- Complemento (procedência: cobaio);
- Controle Positivo Alto (CH);
- Controle Positivo Baixo (CL);
- Controle Negativo (CN);
- Hemácia de Carneiro;
- Hemolisina (procedência: coelho); e
- Padrão de Cianometahemoglobina (CMH).
¶ Soluções
- Água destilada ou equivalente;
- Álcool 70° INPM°;
- Alséver;
- Drabkin (SD - opcional);
- Hipoclorito de sódio 1%;
- Trietanolamina de Trabalho (ST); e
- Trietanolamina Concentrada (Solução Mãe).
¶ Realização do Ensaio
¶ Preparo das Amostras e Controles
- Diluir as amostras e controles com ST, de acordo com o QUADRO 1 e inativar de acordo com o QUADRO 2;
- Remover as amostras do banho-maria após o período de inativação e deixá-las estabilizar com a temperatura ambiente da sala de análise. Armazenar em temperatura entre 2°C e 8°C por no máximo 1 semana; e
- Amostras inativadas em dia anterior ao ensaio devem ser inativadas novamente sob a mesma temperatura durante 10 minutos.
QUADRO 1 – Diluição de Amostras e Controles.
QUADRO 2 – Inativação das Amostras e Controles.
¶
Preparo dos Reagentes
1. SUSPENSÃO DE HEMÁCIAS A 2%
Obtenção das Hemácias
- Coletar 30 mL de sangue de carneiro por punção venosa e misturar imediatamente com 30 mL de solução de Alséver estéril;
- Filtrar o sangue em gaze estéril;
- Aliquotar em tubos de vidro com tampa rosca (alíquotas de 10 mL);
- Manter sob refrigeração por 05 dias antes do uso; e
- Utilizar em até 06 semanas.
Lavagem das Hemácias
- Desprezar a Solução de Alséver das hemácias;
- Ressuspender as hemácias em Solução de Trabalho (ST), homogeneizar por inversão suavemente e filtrar em gaze estéril;
- Dividir o filtrado em dois tubos de centrífuga de 50 mL, completar o volume com ST e centrifugar a 900xg por 10 minutos em centrífuga refrigerada;
- Remover o sobrenadante por inversão do tubo, completar o volume do tubo com ST, homogeneizar por inversão suavemente e centrifugar a 900xg por 10 minutos. Realizar o procedimento de lavagem três vezes. Na última lavagem, remover o sobrenadante por sucção com cuidado para não lisar as hemácias; e
- Ressuspender as hemácias em 40 mL de ST, acrescentando ao tubo alíquotas de 10 mL de ST. Lavar bem o tubo e transferir a suspensão para um balão de fundo chato.
Nota: Avaliar a coloração do sobrenadante. Se hemolisado, descartar a hemácia e repetir o procedimento com nova hemácia.
Padronização da Suspensão de Hemácias a 2%
- Pipetar 100 μL da suspensão de hemácias para um tubo de ensaio contendo 2,5 mL de água destilada ou Solução de Drabkin (SD, Instrução de preparo no Anexo I). Mixar bem invertendo e agitando para lisar as células;
- Medir a Densidade Óptica (DO1) no comprimento de onda de 540 nm, em espectrofotômetro ajustado com SD ou água destilada;
- Calcular o volume de ST a ser adicionado: Volume Final da Suspensão de Hemácia (VF1) e Volume de ST a ser adicionado (ST1);
- Adicionar à suspensão de hemácias o volume ST1 calculado e homogeneizar;
- Pipetar 400 μL da nova suspensão de Hemácias para um tubo de ensaio contendo 1,6 mL de água destilada. Mixar bem para lisar as células e medir a DO (DO2);
- Calcular o volume de ST a ser adicionado: Volume Final da Suspensão de Hemácias (VF2) e ST2 a ser adicionado;
- Adicionar à suspensão de hemácias o volume (ST2) calculado e homogeneizar;
- Repetir o procedimento do item “5”, medindo a DO3. Se a DO obtida for diferente de 0,750 (0,740 a 0,760), calcular o volume de Solução de Trabalho (ST3) a ser adicionado;
- Repetir os itens “6” a “7” até a obtenção da DO = 0,750 (0,740 a 0,76).
Cálculo referente ao item 3
| VF1 = DO1 x (39,9)/DOalvo em mL |
| ST1 = VF1 -39,9, em mL |
Cálculo referente ao item 6
| VF2 = DO2 x (VF1 - 0,4)/0,75 em mL |
| ST2 = VF2 - VF1, em mL |
Nota 2: O cálculo da DO alvo está demonstrado no Anexo I.
2. PADRÃO DE COR
Solução de Hemoglobina (Hg):
- Adicionar 18,0 mL de água destilada em um erlenmeyer;
- Adicionar 6,0 mL da Suspensão de Hemácia 2%;
- Mixar bem esta solução de hemoglobina para lisar as hemácias; e
- Adicionar 6,0 mL de Solução Mãe.
Suspensão de Hemácia a 0,4% (Cel)
- Adicionar 24,0 mL de Solução de Trabalho em balão de fundo chato;
- Adicionar 6,0 mL da Suspensão de Hemácia a 2%; e
- Mixar gentilmente por inversão.
Padrão de Cor
- Rotular 13 tubos de ensaio com as porcentagens de hemólise e adicionar Hg e Cel, conforme o QUADRO 3;
- Mixar os tubos por inversão e centrifugar a 900xg em centrífuga refrigerada por 10 minutos;
- Realizar a leitura das DOs correspondentes; e
- Reservar os tubos correspondentes aos percentuais 0%, 25%, 50%, 75% e 100% para uso no ensaio (conservar sob 2ºC a 8°C).
QUADRO 3: Padrão de Cor
Fonte: LFDA-PA
3. SISTEMA HEMOLÍTICO (SH)
- Calcular o volume de Sistema Hemolítico (SH) a ser preparado, considerando que são necessários 4,8 mL de SH para cada placa e 19,2 mL para a titulação do complemento;
- Calcular o volume de Hemolisina (h) a ser adicionado no SH;
- Preparar o SH em balão de vidro;
- Incubar o SH em banho-maria a 37ºC±2°C por 10 minutos e armazenar sob 2°C a 8°C até o momento do uso
Cálculo referente ao item 2
| h = (Volume de He2%/Titulo hemolisina x Diluição hemolisina x 1000 em ul |
Cálculo referente ao item 3
| SH = 505 He2% (mL) + 50% ST(mL) + h(uL) |
Nota: O procedimento de titulação da hemolisina está descrito no Anexo V.
4. COMPLEMENTO DE TRABALHO (CT´)
- Calcular a diluição do Complemento de Trabalho (CT’);
- Calcular a quantidade de CT’ a ser utilizada no ensaio, considerando que são necessários 2,4 mL de complemento para cada placa.
| CT' = (Título x 0,20/ 2,2)/ 10 |
Nota: O procedimento de titulação do Complemento está descrito no Anexo II.
5. ANTÍGENO DE TRABALHO (AgT)
- Preparar o Antígeno de Trabalho (AgT) a partir da diluição do antígeno puro em ST, conforme instruções do fabricante;
- Calcular a quantidade de AgT a ser utilizada no ensaio, considerando que são necessários 2,4 mL de AgT para cada placa;
- Estocar o AgT entre 2°C e 8°C por no máximo 2 dias.
Nota: O procedimento de titulação do antígeno está descrito no Anexo IV.
¶ Rotulagem das Microplacas
A microplaca com os controles e padrão de cor deve ser identificada conforme FIGURA 1. Nesta placa é possível inserir 7 amostras. Para maior número de amostras identificar outras microplacas sem incluir os controles, sendo possível inserir 12 amostras, conforme FIGURA 2;
FIGURA 1: Placa com os controles e padrão de cor.
FIGURA 2: Placa com amostras
¶ Execução do Ensaio na Microplaca
- Adicionar 25 μL dos controles (CH, CL, CN) nos poços de diluição 1:5, 1:10 e AC nas respectivas colunas, conforme FIGURA 1;
- Adicionar 25 μL das amostras nos poços de diluição 1:5, 1:10 e AC nas respectivas colunas, conforme FIGURA 1 e 2;
- Adicionar 25 μL da ST nos poços de titulação 1:10 a 1:320 e na linha AC conforme FIGURA 1 e 2;
- Transferir 25 µL dos controles e amostras dos poços de diluição 1:10 para 1:20, homogeneizando sempre antes da transferência. Repetir o procedimento até a diluição final (1:320) e, após a homogeneização, desprezar 25 μL;
- Adicionar 25 μL do antígeno (AgT) nos poços de diluição 1:5 a 1:320;
- Adicionar 25 μL do complemento (CT’) nos poços da diluição 1:5 a 1:320 e AC;
- Adicionar os Controles dos Reagentes de acordo com o QUADRO 4 e conforme posicionamento na FIGURA 1;
- Cobrir a microplaca para minimizar a evaporação e mixar com auxílio do agitador de microplacas por 2 minutos;
- Incubar em refrigeração (2°C a 8°C) por 18 ± 2 horas;
- Após o período de incubação, adicionar 50μL do SH nos poços das diluições 1:5 a 1:320 e AC;
- Adicionar SH e He2% nos poços dos Controles dos Reagentes, de acordo com o QUADRO 4;
- Homogeneizar por inversão os tubos com Padrão de Cor reservados (0%, 25%, 50%, 75% e 100% de hemólise) e adicionar 125μL nos seus respectivos poços, conforme FIGURA 1;
- Cobrir a microplaca e mixar por 2 minutos com auxílio do agitador de microplacas;
- Incubar a microplaca em estufa a 37°C ± 2°C por 20 minutos;
- Mixar a microplaca por 2 minutos com auxílio do agitador de microplacas e incubar novamente a 37°C ± 2°C por 25 minutos;
- Incubar a microplaca em refrigeração (2°C a 8°C) por no mínimo 2 horas; e
- Realizar a leitura da placa.
QUADRO 4: Controle dos Reagentes
¶ Critérios de Aceitação do Ensaio
- O resultado de ensaio será considerado válido se os Controles de Referência (CH, CL e CN) reagirem conforme o esperado e o Padrão de Cor e os Controles dos Reagentes de acordo com os QUADRO 5 e 6, caso contrário, deve ser realizado novo ensaio; e
- Realizar a leitura dos Controles de Referência e Controles dos Reagentes comparando o percentual de hemólise com o Padrão de Cor. Interpretar os resultados baseados no QUADRO 5 e 6.
QUADRO 5: Interpretação do Padrão de Cor
QUADRO 6: Resultado Padrão dos Controle dos Reagentes.
¶ Interpretação dos Resultados
- Realizar a leitura das amostras testadas avaliando o percentual de hemólise do respectivo poço comparando ao Padrão de Cor (QUADRO 5). Esse percentual é baseado na cor do sobrenadante e espessura do botão;
- Determinar o resultado da amostra testada de acordo com o QUADRO 7; e
- Amostra com resultado POSITIVO, SUSPEITO ou ANTICOMPLEMENTAR deve ser testada em ensaio complementar de Western Blotting (WB), prevalecendo o resultado deste.
QUADRO 7: Resultados obtidos na Técnica de FC para Diagnóstico Sorológico de Mormo.
Nota: Pode ocorrer esporadicamente, quando o soro possuir título muito elevado de reação positiva, o efeito “Prozona”, reagindo fortemente nos poços de títulos mais altos e não reagindo nos títulos mais baixo, nestes casos considerar o resultado como Positivo.
¶ Emissão dos Resultados
- Os resultados deverão ser emitidos e expresso como NEGATIVO, POSITIVO, SUSPEITO ou ANTICOMPLEMENTAR.
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de Itens de Ensaio”;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução similar para descontaminação, por no mínimo de 1 hora;
- Após este período o material deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório;
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte; e
- Realizar a conferência das amostras antes do descarte e registrar em formulário próprio.
¶ Retenção de Itens de Ensaio
- As amostras de soros podem ser descartadas após um período mínimo de 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidas antes do descarte; e
- Durante o período de armazenamento as amostras devem ser armazenadas congeladas em temperatura de no máximo -10°C.
¶ C. Ensaio de Western Blotting (WB)
¶ Materiais
- Bandejas com canaletas para tiras de nitrocelulose;
- Béqueres;
- Caneta para identificação de vidraria;
- Cubas para descarte de materiais resistente à autoclavação;
- Descartador de ponteiras;
- Erlenmeyers;
- Luvas para procedimentos;
- Papel absorvente;
- Pipetas de vidro graduadas ou descartáveis;
- Pisseta;
- Ponteiras descartáveis;
- Provetas graduadas; e
- Reservatórios para soluções (cubetas).
¶ Equipamentos e Instrumentos
- Agitador de tubos tipo vórtex;
- Agitador tipo rocker oscilante;
- Balança;
- Cronômetros;
- Destilador ou Deionizador de água;
- Freezer -20ºC;
- Micropipeta mono e multicanal de volume regulável;
- Pipetador automático ou manual; e
- Refrigerador.
¶ Insumos
Kit de WB de detecção de anticorpos para Burkholderia mallei.
¶ Soluções
- No preparo das soluções deve ser utilizado somente os reagentes fornecidos pelo fabricante ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução; e
- Diluir a soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar bem.
¶ Realização do Ensaio
- Preencher o formulário de acompanhamento do ensaio, incluindo as amostras e os controles negativo e positivo;
- Preparar as soluções e diluições necessárias conforme as orientações do fabricante do kit de diagnóstico utilizado;
- Colocar uma tira em cada uma das caneletas da bandeja de incubação usando uma pinça plástica;
- Adicionar o diluente da amostra em cada canaleta;
- Distribuir o controle negativo, o controle positivo e as amostras nas canaletas apropriadas, conforme o formulário de acompanhamento do ensaio;
- Para permitir que a reação se inicie simultaneamente em todas as canaletas, posicione o agitador durante a adição dos soros de tal forma que as bandejas fiquem inclinadas num ângulo de aproximadamente 30º. Posicione as tiras na parte superior da canaleta para que não tenham contato com o diluente na parte inferior, onde se faz a adição das amostras e dos soros controle;
- Verificar em todas as etapas se as tiras ficaram bem submersas e com as respectivas numerações visíveis;
- Incubar em temperatura ambiente sob agitação;
- Descartar o diluente da amostra e realizar a lavagem das tiras com a solução de lavagem. Repetir 3 vezes o procedimento e secar as bandejas batendo-as emborcadas sobre papel toalha. Evitar que transborde o líquido de uma canaleta à outra durante a eliminação do diluente;
- Antes de finalizar a terceira etapa de lavagem, diluir o conjugado e distribuir em todas as canaletas posicionando as bandejas conforme o item “f”;
- Incubar em temperatura ambiente sob agitação;
- Descartar o Conjugado e realizar a lavagem das tiras;
- Antes de finalizar a terceira etapa de lavagem, preparar o Substrato e distribuir em todas as canaletas, posicionando as bandejas conforme o item “6”;
- Incubar em temperatura ambiente sob agitação;
- Descartar o Substrato e lavar as tiras com abundante água deionizada e/ou destilada para interromper a reação. Por último, secar muito bem as bandejas batendo-as emborcadas sobre papel toalha; e
- Deixar as tiras secarem em temperatura ambiente dentro das bandejas
¶ Critérios de Aceitação do Ensaio
O resultado do ensaio será considerado válido somente se os controles atenderem às especificações do fabricante. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos Resultados
De acordo com a ausência, presença e intensidade de bandas, consideram-se os resultados NEGATIVO ou POSITIVO, levando em conta o recomendado na bula do kit.
¶ Emissão dos Resultados
Os resultados deverão ser expressos como “NEGATIVO” ou “POSITIVO”;
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de Itens de Ensaio”;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução similar para descontaminação, por no mínimo de 1 hora;
- Após este período o material deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório;
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte; e
- Realizar a conferência das amostras antes do descarte e registrar em formulário próprio.
¶ Retenção de Itens de Ensaio
- As amostras de soros podem ser descartadas após um período mínimo de 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidas antes do descarte; e
- Durante o período de armazenamento as amostras devem ser armazenadas congeladas em temperatura de no máximo -10°C.
¶ 5. Base legal e documentos de referência
¶ AIE
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, twelfth edition 2023, Equine Infectious Anaemia CHAPTER 3.6.6. versão online. Disponível em: https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/A_summry.htm. Acesso em 21 de dezembro de 2023.
- ISSEL C.J.S., SCICLUNA MT., COOK S.J., COOK R.F., CAPRIOLI A., RICCI I., ROSONE F., CRAIGO J. K., MONTELARO R.C., AUTORINO G.L. CHALLENGES AND PROPOSED SOLUTIONS FOR MORE ACCURATE DIAGNOSIS OF EQUINE INFECTIOUS ANAEMIA. Veterinary Record, volume 172-8, fevereiro, 2013. Disponível em: ttps://www.ncbi.nlm.nih.gov/pmc/articles/PMC3593188/ .
¶ Mormo
- Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, twelfth edition 2023, Glanders and Melioidosis, CHAPTER 3.6.11. versão online. Disponível em: https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/A_summry.htm. Acesso em 21 de dezembro de 2023.
- National Veterinary Services Laboratories – NVSL. United States Department of Agriculture. Protocol for Evaluation of Antigen Used in The Complement Fixation Test for Diagnosis of Glanders Caused by Burkholderia mallei – Microtitration Method. Ames, 1997. 29 p.
¶ 6. Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ 7. Histórico de revisões
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1 | -//- | 04.03.2024 | Elaboração do documento |
¶ 8. Anexos
¶ Anexo I - DETERMINAÇÃO DO ALVO PARA SUSPENSÃO DE HEMÁCIA DE CARNEIRO
Solução de Drabkin (SD): Preparar uma diluição 1:100 do Drabkin em água deionizada. Essa solução é estável por 2 meses em frasco escuro. Descartar se apresentar turvação ou precipitados.
Padrão de Hemoglobina (HS): Adicionar 0,1 mL de solução padrão de hemoglobina em 12,5 mL de solução de Drabkin. Mixar bem.
Procedimento:
- Rotular 5 tubos para as concentrações de 80, 60, 40, 20 e 0 mg% de CMH e adicionar SD e HS nos tubos de acordo com o QUADRO 8;
QUADRO 8 – Concentração de CMH (mg%)
- Zerar o espectrofotômetro com o tubo 0,0 mg% CMH (solução de Drabkin);
- Fazer 3 leituras de densidade óptica (DO) de cada tubo, zerando aparelho entre as sequências de leituras;
- Calcular a média das leituras das DOs de cada tubo e depois a soma das médias, conforme exemplo do QUADRO 9;
QUADRO 9 – Exemplo da Média de Leitura das DOs.
- Calcular o Fator de Instrumento (FI), conforme fórmula a seguir:
Exemplo baseado no QUADRO 9:
- Calcular a Densidade Óptica Alvo (DOalvo), conforme fórmula a seguir e utilizando o QUADRO 10:
QUADRO 10 – Padrão CMH mg%
Exemplo baseado no QUADRO 9 para Suspensão de Hemácia a 2%:
¶ ANEXO II - TITULAÇÃO DO COMPLEMENTO (C´)
- Realizar a diluição 1:10 do complemento puro: adicionar 9,0 mL de Solução de Trabalho e 1,0 mL de complemento no tubo de ensaio devidamente identificado (C’1:10). Homogeneizar a solução por inversão ou com agitador de tubos e deixar estabilizar por 20 minutos em banho de gelo. O C’ 1:10 pode ser estocado a -70°C, e, uma vez descongelado a sobra deve ser descartada;
Nota: Todo o procedimento de Titulação do Complemento deve ser realizado em banho de gelo.
- Preparar diluições a partir do C´1:10 de acordo com o QUADRO 11. Realizar no mínimo três diluições indicadas no QUADRO 11 e identificar os tubos de ensaio com o título da diluição realizada. Homogeneizar as soluções por inversão ou com agitador de tubos e deixar estabilizar por 20 minutos em banho de gelo;
QUADRO 11: Diluição do Complemento.
- Para cada diluição realizada, identificar uma série de quatro tubos de ensaio com título e numeração de 3 a 6. Por exemplo: para o título 200 identificar 4 tubos (C’200/3, C’200/4, C’200/5, C’200/6);
- Distribuir os reagentes nos tubos conforme o QUADRO 12:
QUADRO 12: Titulação do Complemento.
- Homogeneizar os tubos por inversão e colocá-los em banho-maria a 37ºC±2°C por 15 minutos. Homogeneizar novamente e recolocá-los em banho-maria a 37ºC±2°C por mais 15 minutos;
- Centrifugar os tubos a 900xg por 10 minutos em centrífuga refrigerada;
- Ler a DO de cada tubo em espectrofotômetro com comprimento de onda de 540nm;
- O título do C’ a ser utilizado no ensaio será aquele que apresentar DO inferior ao percentual de hemólise de 50% nas duas primeiras diluições e DO superior a 50% de hemólise nas duas últimas diluições;
Nota: Quando o título do complemento estiver entre dois valores do QUADRO 1, utilizar o título intermediário (Exemplo: entre 500 e 600, utilizar o título médio de 550).
- Construir o gráfico logarítmico da titulação do C’, conforme descrito no ANEXO III (opcional).
¶ ANEXO III - CONSTRUÇÃO DE GRÁFICO LOGARÍTMICO DA TITULAÇÃO DO COMPLEMENTO (C’)
- Construir o gráfico em papel milimetrado di-log, onde o eixo “Y” corresponde ao volume de C’ em mL e o eixo “X” ao percentual de Hemólise;
- No eixo “Y” marcar os números logarítmicos 3, 4, 5 e 6, correspondentes aos tubos 3, 4, 5 e 6, que equivalem a 0,3; 0,4; 0,5 e 0,6 mL de C´;
- Determinar o percentual de hemólise para os tubos 3, 4, 5 e 6 referentes ao Complemento cujo título foi selecionado, através de regra de três simples entre as DOs obtidas de cada tubo e as DOs do percentual de hemólise do Padrão de Cor correspondente. No eixo “X” marcar o valor correspondente ao percentual de hemólise calculado de cada tubo;
- Marcar no gráfico, o ponto de interseção entre o número logarítmico (eixo “Y”) com seu respectivo percentual de hemólise (eixo “X”);
- Traçar uma reta entre os dois primeiros pontos de interseção encontrados e traçar outra reta entre os dois últimos pontos e marcar o ponto médio em cada reta obtida;
- Traçar uma nova reta entre os pontos médios obtidos;
- Marcar o ponto médio da diagonal e a partir deste ponto traçar uma reta até o eixo “Y” para determinar a inclinação da reta diagonal. A inclinação aceitável é de 4,4 ± 20% (0,44mL). Se a inclinação não estiver dentro deste parâmetro, repetir a titulação do C´ com novo lote de hemácia preservada.
- Exemplo de gráfico conforme FIGURA 3.
FIGURA 3: Gráfico logarítmico.
Nota 1: O gráfico é válido quando os dois primeiros pontos (3 e 4) estão à esquerda e os dois últimos pontos (5 e 6) estão à direita, considerando o ponto 50% de hemólise no eixo “X”.
Nota 2: Quando o melhor título do complemento a ser utilizado no ensaio for um título intermediário, não previsto nas titulações realizadas, deverá ser utilizado o título médio, não sendo possível a construção do gráfico.
¶ ANEXO IV - TITULAÇÃO DO ANTÍGENO
Preparação do Soro Controle
Diluir 80 μL do soro controle de médio abaixo título em 320 μL de solução de trabalho (ST) e inativá-lo por 30 minutos a 59°C ± 2°C. Após este período, estabilizar o soro a temperatura ambiente.
Preparação do Antígeno
- Diluir 40 μL do antígeno concentrado em 600 μL de ST para obter a diluição de 1:16. A diluição inicial e seriada do antígeno poderá variar de acordo com o fabricante e lote utilizados;
- Rotular quatro microtubos de 1,5 mL com as diluições 1:32, 1:64, 1:128 e 1:256 e adicionar 300 μL de ST em cada um;
- Transferir 300 μL do antígeno 1:16 para o tubo 1:32. Homogeneizar e transferir 300 μL para o tubo 1:64. Repetir o procedimento até a diluição final (1:256) e, depois de homogeneizar, desprezar 300 μL; e
- O antígeno pode ser utilizado até 5 dias após ter sido diluído. Durante este tempo, deve ser mantido refrigerado (2°C a 8°C).
Preparação do Complemento
- Titular o complemento conforme Anexo II;
- Preparar 1,5 mL do complemento com o título encontrado;
- Rotular dois microtubos de 1,5 mL com as diluições ½ e ¼ do C’ e adicionar 200 μL de ST em cada um;
- Transferir 200 μL do complemento C’ para o tubo ½ do C’, homogeneizar e transferir 200 μL para o tubo ¼ do C’. Depois de homogeneizar, desprezar 200 μL.
Preparação dos Reagentes
Preparar Suspensão de Hemácia a 2%, Padrão de Cor e Sistema Hemolítico (SH) conforme descrito acima.
Execução da Titulação do Antígeno
Rotulagem da Microplaca
QUADRO 13: Placa para titulação do antígeno
Adição dos Reagentes na Microplaca
- Adicionar 25 μL do soro controle inativado nas colunas 1 e 2 (1:5 e 1:10) nas linhas A até E;
- Adicionar 25 μL de ST nas colunas 2 até 7 (1:10 até 1:320) nas linhas A até E;
- Transferir 25 µL do soro controle dos poços de diluição 1:10 (coluna 2) para 1:20 (coluna 3), homogeneizando sempre antes da transferência. Repetir o procedimento até a diluição final na coluna 7 (1:320) e, depois de homogeneizar, desprezar 25 µL;
- Adicionar 25 μL do soro na diluição 1:5 no primeiro poço da linha F;
- Adicionar 25 μL de ST nas colunas 8, 9 e 10 (controle AC);
- Adicionar 25 μL de cada diluição do antígeno nas linhas correspondentes (A até E) nas colunas 1 até 10 (QUADRO 13);
- Adicionar 25 μL de ST nos poços 1F, 8F, 9F e 10F;
- Adicionar 25 μL do complemento C’ nas colunas 1 até 8 e linhas de A até E, e nos poços 1F e 8F (QUADRO 13);
- Adicionar 25 μL do complemento C’ diluído 1/2 na coluna 9 e linhas de A até F, e 25 μL do C´ diluído 1/4 na coluna 10, linhas de A até F (QUADRO 13);
- Cobrir as placas para minimizar a evaporação e mixar com auxílio do agitador de microplacas por 2 minutos;
- Incubar em refrigeração (2°C a 8°C) por 18h ± 2 h;
- Após o período de incubação, adicionar 50 μL do SH em todos os poços (QUADRO 13);
- Homogeneizar por inversão os tubos com Padrão de Cor reservados (0%, 25%, 50%, 75% e 100% de hemólise) e adicionar 125 μL nos seus respectivos poços, conforme QUADRO 1;
- Cobrir a placa e mixar por 2 minutos com auxílio do agitador de microplacas;
- Incubar a placa em estufa a 37°C ± 2°C por 20 minutos;
- Mixar a placa por 2 minutos para ressuspender as células não lisadas e incubar novamente a 37°C ± 2°C por 25 minutos; e
- Deixar a placa no mínimo 2 horas em refrigeração (2°C a 8°C).
Leitura
- Realizar a leitura do resultado de cada poço avaliando o percentual de hemólise comparado ao Padrão de Cor, QUADRO 5, “Interpretação do Padrão de Cor”. Esse percentual é baseado na cor do sobrenadante e espessura do botão.
QUADRO 5: Interpretação do Padrão de Cor
- A diluição a ser utilizada no teste diagnóstico deve ser o dobro da diluição mais sensível na titulação. A diluição do antígeno escolhida deve mostrar 100% de hemólise (0) com o C’ e 1/2C’ e pelo menos 50% de hemólise (>2+) com 1/4C’. O soro que apresentar reação anticomplementar no poço 1F, não deve ser utilizado para titulação do antígeno.
- A leitura da placa está exemplificada no QUADRO 14. Neste exemplo, a diluição mais sensível do antígeno é 1:64. No teste de diagnóstico, o antígeno é utilizado com o dobro desta concentração (1:32 no exemplo fornecido).
QUADRO 14: Exemplo de Leitura da microplaca, em percentual de hemólise expressa em cruzes
¶ ANEXO V - TITULAÇÃO DA HEMOLISINA
Diluição do Complemento (C’)
- Preparar a diluição do Complemento 1:10 e deixar estabilizar por 20 minutos; e
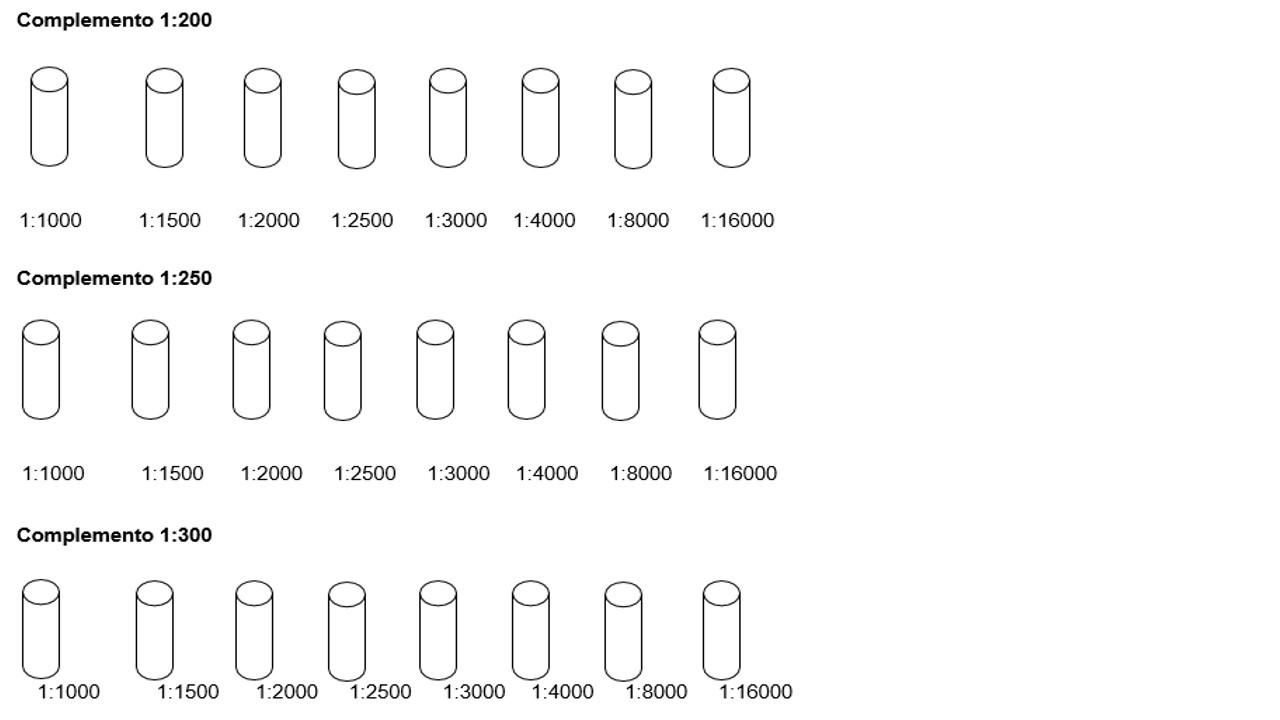
- Preparar as diluições 1:200, 1:250 e 1:300 e deixar estabilizar por mais 20 minutos de acordo com o item 2 do Anexo II, Titulação do Complemento (C´).
Diluição da Hemolisina (HL)
- Preparar a HL a 1:10: pipetar 100 μL de HL pura em 900 μL de solução salina 0,85% (essa solução pode ser estocada para uso na prova);
- Preparar a HL a 1:100: pipetar 200 μL de HL 1:10 em 1800 μL de solução de trabalho (ST);
- Preparar a HL a 1:1000: pipetar 2 mL de HL 1:100 em 18 mL de solução de trabalho (ST);
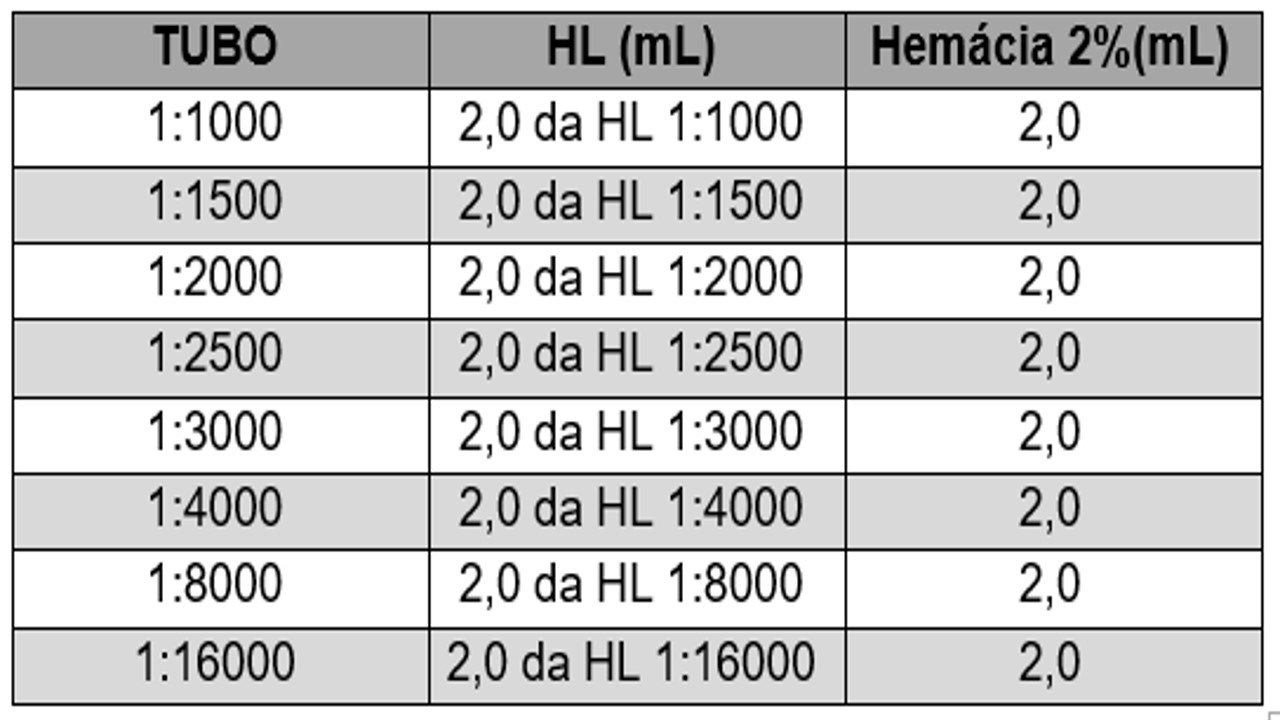
- Rotular sete tubos e diluir a hemolisina conforme o QUADRO 15:
QUADRO 15: Diluição da Hemolisina
Preparação do Sistema Hemolítico
- Rotular oito tubos e pipetar 2,0 mL de cada diluição da HL e 2,0 mL de Hemácia 2%, conforme o QUADRO 16;
QUADRO 16: Preparo do Sistema Hemolítico para cada Diluição da Hemolisina
- Homogeneizar em vórtex ou por inversão e incubar em banho-maria a 37 ºC por 10 minutos.
Titulação da Hemolisina
- Preparar uma série de oito tubos para cada diluição do complemento, conforme a FIGURA 4;
FIGURA 4: Diluição do Complemento
- Adicionar 800 μL de STT em cada tubo;
- Adicionar 400 μL de cada diluição do complemento na série correspondente;
- Adicionar 800 μL de SH obtido do QUADRO 2 para cada série de diluição de hemolisina correspondente;
- Homogeneizar cada tubo em vórtex ou por inversão e incubar em banho-maria a 37ºC por 15 minutos;
- Retirar os tubos do banho-maria, homogeneizar e incubar no banho-maria a 37ºC por mais 15 minutos;
- Centrifugar por 900 x g por 10 minutos; e
- Realizar a leitura das DOs (540 nm) em espectrofotômetro.
Construção do Gráfico
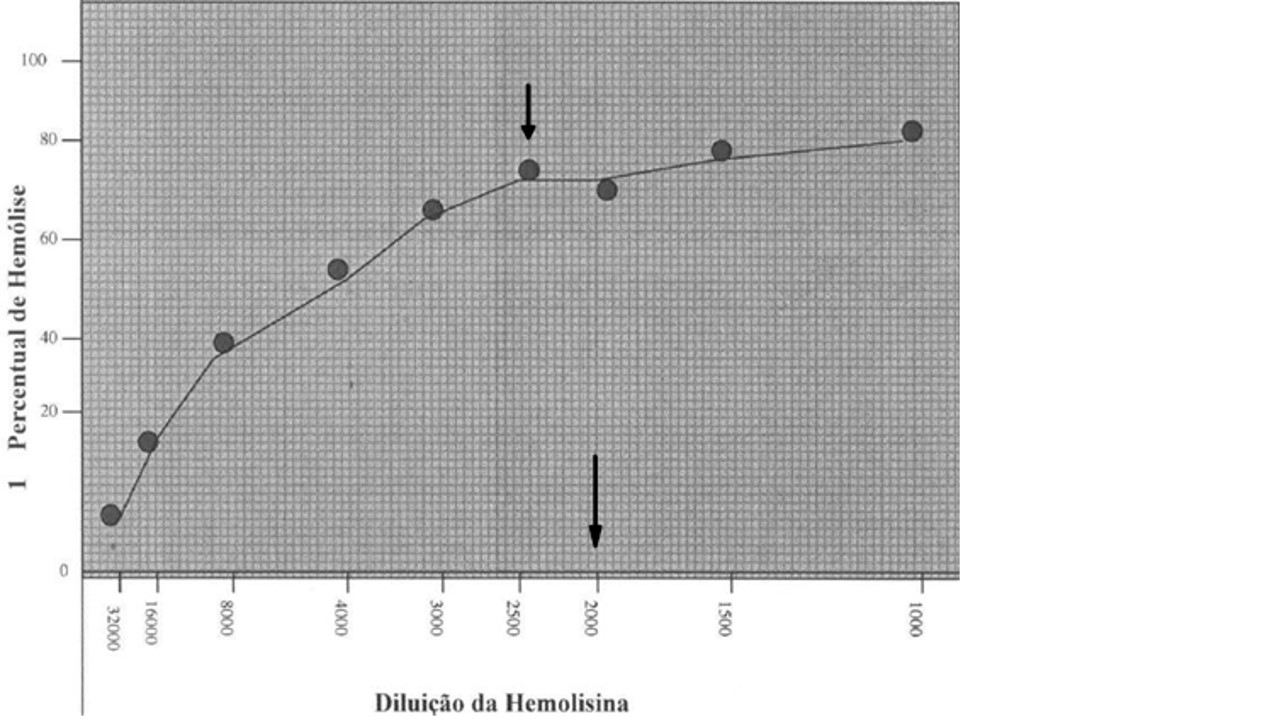
- Calcular o porcentual de hemólise de cada tubo da titulação de HL comparando com o padrão de cor (PC):
- Em papel milimetrado, traçar uma reta com uma régua milimetrada a partir do ponto zero, na horizontal (eixo X) para o lado direito, marcar no ponto de 20 cm a diluição 1:1000;
- Para calcular os demais pontos do eixo X, dividir 20000 por cada diluição, conforme o QUADRO 17;
QUADRO 17: Cálculo dos pontos no eixo X.
|
Diluição HCl |
1000 | 1500 | 2000 | 2500 | 3000 | 4000 | 8000 | 16000 |
|
Cm |
20 | 13,3 | 10 | 8 | 6,7 | 5 | 2,5 | 1,25 |
Fonte: LFDA/PA
- Na reta vertical (eixo Y), marcar os porcentuais de hemólise (10% a 100%), com espaço de dois em dois quadrantes (2 cm em 2 cm);
- Marcar os pontos e traçar o gráfico;
- O ponto ótimo será aquele que mostrar uma estabilidade (FIGURA 5). A titulação final da HL será o ponto seguinte do platô.
FIGURA 5: Titulação da Hemolisina
¶ ANEXO VI - PREPARAÇÃO DAS SOLUÇÕES
¶ SOLUÇÃO SALINA (0,85%)
Materiais e equipamentos
- Espátula e recipiente para pesagem;
- Béquer 500 mL;
- Balão volumétrico 1000 mL;
- Bastão de vidro;
- Frasco estéril 1000 mL (2X);
- Barra magnética;
- Agitador magnético;
- Balança analítica; e
- Autoclave ou membrana de filtração 0,22 µm, seringa estéril e cabine de segurança biológica.
Componentes
- Cloreto de sódio (NaCl)............. 8,5 g; e
- Água deionizada............ q.s.p. 1000 mL
Instrução de Preparo
- Pesar o NaCl e dissolver em aproximadamente 500 mL de água deionizada;
- Completar o volume até 1000 mL;
- Esterilizar a 121°C por 15 minutos ou filtrar por membrana com porosidade de 0,22 µm (separar uma alíquota para a medição do pH); Observação: Não é necessário verificar o pH;
- Armazenamento: 2°C a 8°C; e
- Prazo de validade: 03 meses.
¶ SOLUÇÃO DE ALSÉVER
Materiais e equipamentos
- Espátula e recipiente para pesagem;
- Béquer 200 mL;
- Balão volumétrico 200 mL;
- Bastão de vidro;
- Balão de fundo chato 500 mL (2X);
- Barra magnética;
- Balança analítica;
- Agitador magnético;
- Medidor de pH;
- Autoclave ou membrana de filtração 0,22 µm e seringa estéril; e
- Cabine de segurança biológica.
Componentes
- Glicose... 3,74 g;
- Citrato de sódio anidro (Na3C6H5O7)...1,6 g;
- (ou Citrato de sódio diidratado (Na3C6H5O7 . 2H2O)...1,82 g;
- Ácido cítrico monoidratado (H3C6H507 . H2O)...0,11 g;
- (ou Ácido cítrico anidro (H3C6H507)...0,10 g;
- Cloreto de sódio (NaCl)...0, 84 g; e
- Água deionizada...q.s.p. 200 mL.
Instrução de Preparo
- Pesar os componentes e dissolver separadamente os sais em mais ou menos 100 mL de água deionizada (se necessário aquecer para completa dissolução);
- Adicionar a glicose e completar o volume com água deionizada até 200 mL;
- Autoclavar a 115 °C durante 15 minutos ou filtrar por membrana com porosidade de 0,22 µm (separar uma alíquota para a medição do pH);
- O pH após esterilização deve estar entre 6,1 e 6,3;
- Armazenamento: 2°C a 8°C; e
- Prazo de Validade: 07 dias.
¶ SOLUÇÃO CONCENTRADA DE TRIETANOLAMINA (SOLUÇÃO MÃE)
Materiais e equipamentos
- Espátula e recipiente para pesagem;
- Béquer 600 mL;
- Balão volumétrico 100 e 500 mL;
- Pipeta graduada 10 mL;
- Bastão de vidro;
- Frasco com tampa;
- Barra magnética;
- Balança analítica;
- Agitador magnético; e
- Medidor de pH.
Componentes
- Trietanolamina...14 mL;
- Solução de Ácido clorídrico 1 mol/L (HCl)...90 mL;
- Cloreto de sódio (NaCl)...37,5 g;
- Cloreto de magnésio hexahidratado (MgCl2.6H2O)...0,5g, (ou Cloreto de magnésio anidro...0,235 g);
- Cloreto de cálcio anidro (CaCl2)...0,075 g (ou Cloreto de cálcio diidratado (CaCl2.2H2O) ...0,10 g; e
- Água deionizada...q.s.p. 500 mL.
Instrução de Preparo
- Preparar a solução de ácido clorídrico 1 mol/L (HCl) adicionando 8,3 mL de HCl (37%, 1,19 g/L) em aproximadamente 70 mL de água deionizada e completando o volume até 100 mL com água deionizada em balão volumétrico;
- Pesar os componentes;
- Dissolver o cloreto de sódio em aproximadamente 300 mL de água;
- Adicionar, sob agitação, na seguinte ordem: cloreto de cálcio, cloreto de magnésio e a solução de ácido clorídrico;
- Adicionar a trietanolamina e lavar o frasco que a contém;
- Completar o volume com água deionizada até 500 mL;
- Medir o pH da solução, que deve estar entre 6,9 e 7,7 (o pH da solução não pode ser corrigido);
- Armazenamento: Em frasco com tampa sob temperatura de 2°C a 8°C;
- Prazo de Validade: 30 dias.
Nota: A Trietanolamina é um líquido muito viscoso e deve ser medido cuidadosamente em proveta.
¶ SOLUÇÃO DE TRIETANOLAMINA TRABALHO (SOLUÇÃO DE TRABALHO)
Materiais e equipamentos
- Espátula e recipiente para pesagem;
- Béquer 500 mL;
- Béquer 1000 mL;
- Balão volumétrico 1000 mL;
- Bastão de vidro;
- Frasco com tampa;
- Barra magnética;
- Balança analítica;
- Agitador magnético;
- Medidor de pH; e
- Micro-ondas.
Componentes
- Solução concentrada de trietanolamina 100 mL;
- Gelatina 0,5 g; e
- Água deionizada q.s.p. 1000 mL.
Instrução de Preparo
- Pesar a gelatina e dissolver a gelatina em aproximadamente 100 mL de água deionizada, aquecendo em micro-ondas por dois minutos em potência média;
- Acrescentar aproximadamente 500 mL de água deionizada no balão volumétrico e adicionar a solução concentrada de trietanolamina e a gelatina, lavando o becker;
- Completar o volume com água deionizada até o valor de 1000 mL;
- Medir o pH da solução, que deve estar entre 7,3 e 7,4;
- Se necessário, corrigir o pH com solução de hidróxido de sódio (NaOH) 1 N ou de ácido clorídrico (HCl) 1 N;
- Armazenamento: Em frasco com tampa sob temperatura de 2°C a 8°C; e
- Prazo de validade: 30 dias.
Nota 1: Para preparar a solução de NaOH 1 N, pesar 4 g de NaOH e completar o volume para 100 mL de água deionizada em balão volumétrico.
Nota 2: Para preparar a solução de HCl 1 N, adicionando 8,3 mL de HCl (37%, 1,19 g/L) em aproximadamente 70 mL de água deionizada e completando o volume até 100 mL com água deionizada em balão volumétrico.