¶ Folha de rosto
© 2024 Ministério da Agricultura e Pecuária. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Ano 2024
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária
Secretaria de Defesa Agropecuária - SDA
Departamento de Serviços Técnicos - DTEC
Esplanada dos Ministérios, Bloco D, Anexo, Ala B, 4º andar, sala 433
CEP: 70043-900, Brasília - DF
www.agricultura.gov.br
e- mail: cgal@agro.gov.br
Central de Relacionamento: 0800 704 1995
Equipe Técnica:
Ana Cristina Gonçalves Pinto da Rocha
Ana Carolina de Oliveira Nascimento
Anapolino Macedo de Oliveira
Aerlem Cynara Silva
Ana Karina Cunha Callado
Andrea Padilha de Alencar
Anselmo Vasconcelos Rivetti Júnior
Antônio Augusto Fonseca Júnior
Cid Aristóteles de Siqueira Alencar
Dilmara Reischak
Fernanda Gomes Cardoso
Isabela Ciarlini de Azevedo
João Marcos Nacif da Costa
Juliana Nabuco Pereira Otaka
Luanda Bispo Santos do Nascimento Maués
Luciana Amaral Pinto
Luciana Rabello Ferreira
Luciana Taborda Corrêa
Marcelo Fernandes Camargos
Marco Antônio de Carvalho Marques Serqueira
Paulo Martins Soares Filho
Patrícia Gomes de Souza
Rene Ribeiro da Silva
Sheila de Matos Xavier
Silvio Orlan de Castro Chaves
Soraya Cecilia Albieri Camillo
¶ Folha resumo
|
Macroprocesso: Laboratórios |
Objetivo: Realizar a padronização, harmonização, atualização e a unificação dos procedimentos para execução de ensaios laboratoriais da área de Diagnóstico Animal |
|||
|
Processo: Análises Laboratoriais |
||||
|
Entrega: Segurança e saúde dos rebanhos animais |
Público alvo e demais interessados: Laboratórios oficiais ou credenciados do Ministério da Agricultura e Pecuária (Mapa) |
Versão do documento: 1 |
||
|
Setor responsável e responsabilidades A Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos é responsável pela elaboração, atualização e envio para aprovação deste manual, tendo responsabilidade quanto aos procedimentos descritos no documento. |
||||
¶ 1. Definições e conceitos
Não Aplicável
¶ 2. Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário, no mínimo anualmente, pela Coordenação Geral de Laboratórios Agropecuários do Departamento de Serviços Técnicos (CGAL/DTEC).
A gestão desse manual está sob a responsabilidade da CGAL/DTEC que prestará auxílio ao público alvo leitor dúvidas e/ou sugestões quanto à aplicação deste manual devem ser submetidas ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da SDA para acesso pelo público alvo será de responsabilidade da Secretaria representada pelo DTEC.
¶ 3. Objetivo
O objetivo do Manual é reunir os métodos analíticos a serem empregados na execução de ensaios laboratoriais da área de Diagnóstico Animal da Rede Nacional de Laboratórios Agropecuários (Rede LFDA e Laboratórios credenciados junto ao Ministério da Agricultura e Pecuária).
¶ 4. Procedimentos - Suínos
¶ 4.1 Peste Suína Clássica - PSC (Novembro/2024)
¶ Amostras
São consideradas amostras para o diagnóstico da Peste Suína Clássica:
¶ Detecção da Resposta Imune
- Soro sanguíneo.
¶ Identificação do Agente
- Sangue total;
- Tonsilas Palatinas;
- Baço;
- Rins;
- Linfonodos;
- Íleo e
- Pulmão
¶ 4.1.2. Recebimento das Amostras
4.1.2.1. Para atendimento aos Programas e Controles Oficiais DO mapa os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.1.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
¶ 4.1.3.Técnicas de Diagnóstico
4.1.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo legislação em vigor;
4.1.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.1.3.3. O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos.
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente;
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18 e 25ºC.
4.1.3.4 Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios interpretação dos resultados;
4.1.3.5 O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.1.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.1.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
¶ A.Ensaio Imunoenzimático (ELISA)
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Selador ou tampa para placas de ELISA;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistentes a autoclavação.
¶ Equipamentos e instrumentos
- Autoclave;
- Geladeira;
- Estufa;
- Termômetros
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional); e
- Lavadora de microplacas (opcional).
¶ Insumos
- Kits de ELISA de detecção de anticorpos para o vírus da PSC.
¶ Soluções
- No preparo das soluções deve ser utilizado somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução; e
- Diluir a soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar.
¶ Realização do ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
2. A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
3. Homogeneizar gentilmente todos reagentes e amostras antes do uso;
4. Utilizar ponteiras distintas para cada controle e amostra de soro;
5. Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
6. Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
7. As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente;
8. Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
¶
¶ Critérios de aceitação do Ensaio
O resultado do ensaio será considerado válido somente se os soros controles estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido. Recomenda-se que as amostras com resultados “REAGENTE” ou “INCONCLUSIVO” sejam reensaiadas.
¶ Interpretação dos resultados
- De acordo com as DOs obtidas consideram-se as amostras como reagentes ou não reagentes. As amostras reagentes devem ser encaminhadas para o Laboratório Federal de Defesa Agropecuário (LFDA) designado para realizar a confirmação por Virusneutralização;
- Amostras com DO entre os dois pontos de corte estabelecidos serão consideradas inconclusivas e deverão ser novamente ensaiadas. Se no reensaio o inconclusivo persistir, a amostra deve ser encaminhada ao LFDA para confirmação por teste de Virusneutralização.
¶ Emissão dos resultados
Os resultados deverão ser expressos como “REAGENTE”, “NÃO REAGENTE”, ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico).
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item Retenção de Itens de Ensaio;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de itens de ensaio
- Soro sanguíneo
- Poderão ser descartados 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidos antes do descarte.
Nota: Alíquotas das amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ B. Teste de Virusneutralização
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Frascos de vidro tipo penicilina com tampa;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Microplacas para cultivo celular em poliestireno cristal com 96 cavidades de fundo chato;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
¶
¶ Equipamentos e instrumentos
- Autoclave;
- Cabine de segurança biológica classe II B1 (requisito mínimo);
- Geladeira;
- Freezer;
- Estufa com atmosfera de CO2;
- Estufa;
- Banho seco ou que empregam água;
- Termômetros;
- Micropipetas mono e multicanais de volumes reguláveis;
- Pipetador automático ou manual;
- Agitador de tubos;
- Microscópio invertido;
- Microscópio de luz ultravioleta com imagem invertida (microscópio de fluorescência);
- Balança analítica; e
- Centrífuga refrigerada.
¶ Insumos
- Suspensão celular de linhagem sensível (PK-15 ou SK-6);
- Meio MEM (Meio Essencial Mínimo, reconstituído de acordo com o fabricante);
- Soro fetal bovino (SFB) livre de pestivirus (BVDV) e micoplasma;
- Solução de antibióticos e antifúngicos;
- Anticorpo hiperimune para o vírus da PSC;
- Anticorpo anti-IgG de suíno marcada com isotiocianato de fluoresceína ou peroxidase e
- Anticorpo reagente e não reagente para os vírus da PSC e Diarreia Bovina a Vírus
- Cepas do vírus da PSC e da Diarreia Bovina a Vírus;
- Ovoalbumina Grau V;
- Peróxido de hidrogênio 30 % (V/V);
- Tween 80; e
- Tween 20 (opcional).
¶ Soluções
- Meio MEM com piruvato com 5% de soro fetal bovino e antimicrobianos;
- Solução de salina 0,15 mol/L %;
- Ácido cítrico 0,2 %;
- Solução salina 0,85 % fosfatada tamponada (PBS) pH 7,2-7,4;
- Solução de estoque de 3-amino-9-etil carbazol (AEC) – 0,4 %;
- Acetato de sódio 0,05 mol/L pH 5,0; e
- Solução de antibióticos e antifúngicos.
¶ Realização do ensaio
¶ Incubação soro teste e vírus
- Incubar as amostras de soro em banho seco ou que empregam água a 56 ºC por 30 minutos para inativação do complemento;
- Os soros deverão ser em uma ou duas colunas para se realizar a titulação da amostra;
- Utilizar microplacas para cultivo de células de 96 poços, com 12 colunas identificadas de 1 a 12, e 8 linhas identificadas com a letra A até H;
- Acrescentar 80 μL de MEM nos poços das linhas A e B e 50 μL nos demais poços da placa;
- Colocar 20 μL de cada amostra de soro a ser testada nos poços das linhas A (controle de toxidez) e B da microplaca. O mesmo procedimento deve ser feito com uma amostra de soro reagente e uma de soro não reagente, com fins de controle de prova;
- Homogeneizar e transferir 50 μL da linha B para a linha C e assim sucessivamente até a linha H. Descartar 50 μL ao final;
- Manter pelo menos uma coluna da microplaca para controle de células. Adicionar nesta coluna, 100 μL de MEM e 50 μL volume da suspensão celular utilizada na prova, conforme descrito no item l;
- Retirar um criotubo do vírus de PSC do ultrafreezer, o qual já deverá ter sido titulado pelo método de Reed-Muenchen. Este método será também empregado na titulação da diluição de trabalho do vírus (retrotitulação);
- Diluir o vírus de acordo com o título para que no ensaio sejam utilizados aproximadamente 100 TCID50/50 μL (DT- diluição de trabalho);
- Adicionar 50 μL da diluição trabalho do vírus aos poços, com exceção do controle de toxidez e controle de células. Homogeneizar batendo suavemente na lateral da placa;
- Incubar as microplacas a 37 º C ± 1 ºC, em estufa com 5% de atmosfera de CO2 por um período de 1 hora;
- Adicionar a todos os poços 50 μL de suspensão celular contendo 2 x 105 células/mL com 10% SFB iniciando-se pela coluna referente ao controle de células;
- Incubar as microplacas a 37 º C ± 1 ºC, em estufa com 5% de atmosfera de CO2 por 72 horas; e
- Após o término do período de incubação, fixar as microplacas e proceder a imunocoloração.
¶
¶ Fixação das microplacas
- Descartar o meio em cuba com ácido cítrico 0,2%;
- Lavar a microplaca uma vez com PBS utilizando 200 μL por poço;
- Secar a microplacas utilizando papel toalha;
- Fixar as monocamadas de células incubando as microplacas em estufa com temperatura entre 70 °C a 80 °C por uma hora.
¶ Imunocoloração das microplacas
Imunoperoxidase – direta
- Realizar titulação do anticorpo policlonal anti-PSC conjugado com peroxidase (conjugado anti-PSC), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal a ser utilizada na prova (diluição de trabalho).
- Para a diluição do anticorpo utilizar PBS, previamente tratado com 1 % de Tween e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-PSC a cada poço da microplaca;
- Incubar em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca três vezes com 300 µL PBS, por poço;
- Imediatamente antes do uso, preparar a solução de substrato-cromógeno, preparado como descrito abaixo:
Acetato de sódio 0,05 mol/L pH 5,0
- - Pesar 0,41g de acetato de sódio anidro, transferir para um béquer, adicionar 50 ml de água deionizada ou destilada, e agitar até a completa dissolução;
- - Transferir para um balão volumétrico de 100 ml e completar o volume com água deionizada ou destilada;
- - Verificar o pH que deve estar em 5,0, e caso não esteja, acertar com ácido acético 5 mol/L.
- Solução de estoque de 3-amino-9-etil carbazol (AEC) – 0,4 %
- - Pesar 0,04 de AEC, colocar em um béquer, e adicionar 10 mL de Dimetilformamida (DMF);
- - O procedimento deve ser realizado em capela de exaustão, com uso de óculos protetor e com protetor respiratório com filtro A (P2).
Substrato-cromógeno
- - 0,5 mL da solução de estoque de AEC e 9,5 mL de acetato de sódio;
- - Filtar em membrana o,45 μm e adicionar 5 μL de peróxido de hidrogênio.
- Acrescentar nos poços 50 µL da solução de substrato-cromógeno em cada poço da microplaca;
- Manter a microplaca por 15 a 30 minutos em temperatura ambiente, protegido da luz;
- Descartar o substrato-cromógeno e lavar a microplaca uma vez com PBS;
- Adicionar 50 µL de água destilada por poço da microplaca; e
- Fazer leitura da microplaca em microscópio de luz com imagem invertida.
Imunoperoxidase – indireta
- Realizar titulação do anticorpo policlonal anti-PSC (anticorpo primário), e do anticorpo anti-suíno conjugado com peroxidase (conjugado anti-suíno), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal desses anticorpos a serem utilizadas na prova (diluição de trabalho dos anticorpos).
- Para a diluição dos anticorpos utilizar PBS, previamente tratado com 1 % de Tween 80 e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do anticorpo primário em cada poço da microplaca;
- Incubar em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca três vezes com 300 µL de PBS, por poço;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-suíno com peroxidase em cada poço da microplaca;
- Incubar novamente em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca cinco vezes com 300 µL de PBS, por poço;
- Imediatamente antes do uso, preparar a solução de substrato-cromógeno, preparado como descrito na imunoperoxidase direta;
- Acrescentar nos poços 50 µL da solução de substrato-cromógeno em cada poço da microplaca;
- Manter a microplaca por 15 a 30 minutos em temperatura ambiente, protegido da luz;
- Descartar o substrato-cromógeno e lavar a placa uma vez com PBS;
- Adicionar 50 µL de água destilada por poço da microplaca; e
- Fazer leitura da microplaca em microscópio de luz com imagem invertida.
Imunofluorescência Direta
- Realizar titulação do anticorpo policlonal anti-PSC conjugado com isotiocianato de fluoresceína (conjugado anti-PSC), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal a ser utilizada na prova (diluição de trabalho).
- Para a diluição do anticorpo utilizar PBS, previamente tratado com 1 % de Tween e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-PSC a cada poço da microplaca;
- Incubar em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca três vezes com 300 µL PBS, por poço;
- Adicionar 50 µL de água destilada por poço da microplaca e
- Fazer leitura da microplaca em microscópio de luz ultravioleta com imagem invertida.
Imunofluorescência Indireta
- Realizar titulação do anticorpo policlonal anti-PSC (anticorpo primário), e do anticorpo anti-suíno conjugado com isotiocianato de fluresceína (conjugado anti-suíno), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal desses anticorpos a serem utilizadas na prova (diluição de trabalho dos anticorpos).
- Para a diluição dos anticorpos utilizar PBS, previamente tratado com 1 % de Tween 80 e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do anticorpo primário em cada poço da microplaca;
- Incubar em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca três vezes com 300 µL de PBS, por poço;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-suíno com isotiocianato de fluoresceína cada poço da microplaca;
- Incubar novamente em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca cinco vezes com 300 µL de PBS, por poço;
- adicionar 50 µL de água destilada por poço da microplaca; e
- Fazer leitura da microplaca em microscópio de luz ultravioleta com imagem invertida.
¶ Retrotitulação
- Preparar três diluições do vírus em base 10 a partir da diluição de trabalho (10-1 10-2 e 10-3). Essas três diluições serão utilizadas para a titulação da diluição de trabalho (retrotitulação);
- Adicionar 50 μL de MEM em três colunas de uma microplaca;
- Adicionar 50 μL de cada uma das diluições do vírus em uma coluna, começando pelo vírus mais diluído, de forma que possam ser utilizadas as mesmas ponteiras e o mesmo reservatório para todas as diluições do vírus;
- Incubar as microplacas a 37 º C ± 1 ºC, em estufa com 5% de atmosfera de CO2 por 1 hora;
- Adicionar a todos os poços 50 μL de suspensão celular contendo 2 x 105 células/mL com 10% SFB iniciando-se pela coluna referente ao controle de células;
- Incubar as placas em estufa de CO2 com 5% de atmosfera de CO2 por 72 horas;
- Após o término do período de incubação, fixar as placas e proceder a imunocoloração conforme descrito anteriormente, pelos métodos de imunoperoxidase ou imunofluorescência, direta ou indireta; e
- Cálculo do título deve ser feito pelo método de Reed-Muenchen com base na presença ou ausência de crescimento viral nas colunas inoculadas com as diluições do vírus.
¶ Critérios de aceitação da Prova
A prova estará válida quando a retrotitulação do vírus de prova na diluição de trabalho apresentar as doses infectantes dentro da variação 10 2±0.5, que corresponde a 31 a 316 TCID50/50 μL;
Será considerada válida a prova em que os soros controles se apresentarem dentro do comportamento esperado:
I. Imunoperoxidase
- Soro controle REAGENTE - Caracterizado pela ausência imunocoloração celular específica, indicando a ausência de infecção celular, (figura 1 B)
- Soro controle NÃO REAGENTE – caracterizado presença de imunocoloração celular específica, apresentado o citoplasma corado em vermelho-tijolo ou vermelho-carmim, indicando a presença de infecção viral (figura 1 A).
II. Imunoflourescência
- Soro controle REAGENTE - Caracterizado pela ausência de imunocoloração celular específica, indicando a ausência de infecção celular, (figura 2 B)
- Soro controle NÃO REAGENTE – caracterizado presença de imunocoloração celular específica, apresentado o citoplasma corado em verde fluorescente, indicando a presença de infecção celular, (figura 2 A).
III. Controle de células apresentando tapete íntegro em todos os poços isentos de contaminação ou toxidez.
FIGURA 1 – Células PK15 coradas pela imunoperoxidase – Células infectadas (Figura 1 A) e não infectadas com o vírus da Peste Suína Clássica (Figura 1 B).
FIGURA 2 – Células PK15 coradas por imunofluorescência - Células infectadas (Figura 2 A) e não infectadas com o vírus da Peste Suína Clássica (Figura 2 B)
¶ Interpretação dos resultados
- O resultado é expresso pela recíproca da diluição mais alta do soro em que houve inibição da replicação viral em 50% dos poços (QUADRO 1).
- A amostra será considerada tóxica quando se observar a ausência de multiplicação celular, ou destruição das células por componentes do soro no poço de controle de toxidez. Geralmente é caracterizada pela sedimentação do cultivo semeado no fundo do poço.
- A amostra será considerada contaminada quando houver presença de contaminação bacteriana ou por fungos impedindo a interpretação do resultado.
- O título neutralizante se expressa pela recíproca da diluição mais alta do soro em que houve inibição da replicação viral em 50% dos poços (QUADRO 1).
- Para fins de comércio internacional, considera-se amostras reagentes com uma diluição sérica inicial de 1/5 (1/10 diluição final).
- Para fins de vigilância, amostras são consideradas reagentes em uma diluição de triagem de 1/10 (diluição final de 1/20).
QUADRO 1: Título neutralizante expresso pela recíproca da diluição mais alta do soro em que houve inibição da replicação viral em 50% dos poços.
|
Diluição |
Título |
Título logarítmico |
Poço |
|
1/10 |
10 |
1 |
B |
|
1/20 |
20 |
1,3 |
C |
|
1/40 |
40 |
1,6 |
D |
|
1/80 |
80 |
1,9 |
E |
|
1/160 |
160 |
2,2 |
F |
|
1/320 |
320 |
2,5 |
G |
|
1/640 |
>=640 |
>=2,8 |
H |
¶ Emissão dos resultados
Os resultados deverão ser emitidos como REAGENTE, NÃO REAGENTE, TÓXICA ou CONTAMINADA. Caso a amostra seja considerada reagente, deve ser descrito o valor do título final, que é expresso como o logaritmo da diluição em que houve 100% de Virusneutralização.
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos no item “Retenção de Itens de Ensaio”;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório;
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de itens de ensaio
- Soro sanguíneo
- Poderão ser descartados 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidos antes do descarte;
Nota: Amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo ser registradas e controladas pelo laboratório responsável pela análise.
¶ B. Isolamento viral
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Placas de Petri;
- Frascos de vidro tipo penicilina com tampa;
- Tubo de centrífuga;
- Tubos de ensaio;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Microplacas para cultivo celular em poliestireno com 24 cavidades de fundo chato;
- Microplacas para cultivo celular em poliestireno com 96 cavidades de fundo chato;
- Caneta para identificação de vidraria;
- Cubas para descarte de materiais resistente à autoclavação;
- Areia estéril;
- Filtro para seringa (0,45 µm);
- Gral e Pistilo;
- Tesoura cirúrgica e bisturi; e
- Seringa descartável.
¶ Equipamentos e instrumentos
- Autoclave;
- Cabine de segurança biológica, classe II A (requisito mínimo);
- Geladeira;
- Freezer;
- Estufa com atmosfera de CO2;
- Estufa;
- Banho seco ou que empregam água;
- Termômetros;
- Micropipetas mono e multicanais de volumes reguláveis;
- Pipetador automático ou manual;
- Agitador de tubos;
- Microscópio invertido;
- Microscópio de fluorescência, (para ensaios com anticorpos marcados com isotiocianato de fluoresceína);
- Cronômetro;
- Balança analítica; e
- Centrífuga refrigerada.
¶ Insumos
- Suspensão celular de linhagem sensível (PK-15 ou SK-6);
- Meio MEM (Meio Essencial Mínimo, reconstituído de acordo com o fabricante);
- Soro fetal bovino (SFB), livre de pestivirus (BVDV) e micoplasma;
- Solução de antibióticos e antifúngicos;
- Anticorpo hiperimune para o vírus da PSC;
- Anticorpo anti-IgG de suíno marcada com isotiocianato de fluoresceína ou peroxidase;
- Cepas do vírus da PSC;
- Ovoalbumina Grau V;
- Peróxido de hidrogênio 30 % (V/V); e
- Tween 80 ou Tween 20.
¶ Soluções
- Meio MEM com 5% de soro fetal bovino e tradado com solução de antibióticos e antifúngicos;
- Solução de salina 0,15 mol/L %;
- Ácido cítrico 0,2 %;
- Solução salina 0,85 % fosfatada tamponada (PBS) pH 7,2-7,4;
- Solução de estoque de 3-amino-9-etil carbazol (AEC) - 0,4 %;
- Acetato de sódio 0,05 mol/L pH 5,0; e
- Solução de antibióticos e antifúngicos.
¶ Realização do ensaio
¶ Preparo das amostras
- Processar aproximadamente 0,5 cm3 de cada órgão e tecido;
- Remover o excesso de tecido conjuntivo;
- Recortar e macerar os fragmentos de cada órgão preparando um pool para cada requisição, utilizando gral, pistilo e MEM tratado com solução antimicrobiana até que se forme uma pasta homogênea.
- Pode ser utilizada areia estéril como abrasivo se necessário.
- Não incluir amostras de válvula íleo-cecal no isolamento de vírus para minimizar a ocorrência de contaminação;
- Completar o volume com MEM resultando em uma suspensão de aproximadamente 20 % (P/V);
- Centrifugar a 3000 rpm por 10 minutos;
- Colher o sobrenadante, filtrar e colocar em frasco devidamente identificado; descartar o precipitado;
- Adicionar 100 µL de solução antimicrobiana; e
- Encaminhar 400 µL de inóculo ou de fragmentos do tecido tratado com 1,0 mL de Trizol ou cartuchos para extração de ácidos nucléicos.
¶ Sangue total
- Caso sejam recebidas mais de uma amostra de sangue na requisição preparar um pool com volume final de 1,0 mL. Por exemplo, para quatro amostras adicionar 250 µL de cada amostra; e
- Adicionar 10 µL de solução antimicrobiana.
¶ Passagens em células (suspensão celular)
- Adicionar 100 µL do inóculo de macerado de tecidos, ou 50 µL do inóculo de sangue total em um poço da microplaca de 24 poços.
- Caso seja utilizada uma garrafa de 25 cm2 utilizar 0,5 mL de inóculo de macerado de tecidos ou 0,1 mL de sangue total;
- Quando trabalhar com a placa 24 poços, acrescentar 1 mL de suspensão celular com 10 % de soro fetal bovino na concentração de 300.000 células/mL por poço e 5 ml em garrafas de 25 cm2;
- Incubar a microplaca a 37 ±2°C em estufa com 5% de atmosfera de CO2 por 48 a 72 horas.
- Fazer a leitura e registrar os resultados sobre o crescimento dos cultivos.
- Os materiais em que for observada contaminação não deverão ser submetidos à segunda passagem.
- Congelar a microplaca e descongelar;
- Inocular o material da primeira passagem em microplaca de 96 poços sendo que para cada poço da microplaca de 24 poços ou garrafa deverá ser utilizada uma coluna da microplaca de 96 poços;
- Inocular 10 µL do inóculo nos poços A1, B1, C1 e D1;
- Inocular 5 µL do inóculo nos poços E1, F1, G1 e H1;
- Adicionar 100 µL de células em todos os poços reservando uma coluna para o controle de células e uma para o controle de vírus; e
- Para o controle de vírus utilizar o vírus da PSC. Utilizar amostras já diluídas como controle;
- Incubar as microplacas a 37 º C ± 1 ºC, em estufa com 5% de atmosfera de CO2 por 72 horas;
- Após o término do período de incubação, fixar as microplacas e proceder a imunocoloração.
¶ Fixação das microplacas
- Descartar o meio em cuba com ácido cítrico;
- Lavar a microplaca uma vez com PBS utilizando 200 μL por poço;
- Secar a placa utilizando papel toalha; e
- Fixar as monocamadas de células incubando as microplacas entre 70 °C e 80 °C por uma a três horas.
¶ Imunocoloração das microplacas
Imunoperoxidase – direta
- Realizar titulação do anticorpo policlonal anti-PSC conjugado com peroxidase (conjugado anti-PSC), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal a ser utilizada na prova (diluição de trabalho).
- Para a diluição do anticorpo utilizar PBS, previamente tratado com 1 % de Tween e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-PSC a cada poço da microplaca;
- Incubar a microplaca a 37 ±1°C em estufa com 5% de atmosfera de CO2 por 60 minutos;
- Lavar a microplaca três vezes com 300 µL PBS, por poço;
- Imediatamente antes do uso, preparar a solução de substrato-cromógeno, preparado como descrito abaixo:
Acetato de sódio 0,05 mol/L pH 5,0
- - Pesar 0,41g de acetato de sódio anidro, transferir para um béquer, adicionar 50 ml de água deionizada ou destilada, e agitar até a completa dissolução;
- - Transferir para um balão volumétrico de 100 ml e completar o volume com água deionizada ou destilada;
- - Verificar o pH que deve estar em 5,0, e caso não esteja, acertar com ácido acético 5 mol/L.
- Solução de estoque de 3-amino-9-etil carbazol (AEC) – 0,4 %
- - Pesar 0,04 de AEC, colocar em um béquer, e adicionar 10 mL de Dimetilformamida (DMF);
- - O procedimento deve ser realizado em capela de exaustão, com uso de óculos protetor e com protetor respiratório com filtro A (P2).
Substrato-cromógeno
- - 0,5 mL da solução de estoque de AEC e 9,5 mL de acetato de sódio;
- - Filtar em membrana o,45 μm e adicionar 5 μL de peróxido de hidrogênio.
- Acrescentar nos poços 50 µL da solução de substrato-cromógeno em cada poço da microplaca;
- Manter a microplaca por 15 a 30 minutos em temperatura ambiente, protegida da luz;
- Descartar o substrato-cromógeno e lavar a microplaca uma vez com PBS;
- Adicionar 50 µL de água destilada por poço da microplaca; e
- Fazer leitura da microplaca em microscópio de luz com imagem invertida.
Imunoperoxidase – indireta
- Adicionar 50 µL da diluição de trabalho pré-determinada do anticorpo policlonal anti-PSC aos poços utilizados diluído em PBS com 1 % de Tween e 1 % de ovoalbumina GV;
- Incubar a microplaca a 37 ±1°C em estufa com 5% de atmosfera de CO2 por 60 minutos;;
- Lavar três vezes com 300 µL por poço com PBS com 1 % de Tween 80 e uma vez com água destilada;
- Adicionar 50 µL da diluição pré-determinada do conjugado anti-suíno com peroxidase diluído com 1 % de tween e 1 % de ovoalbumina GV;
- Incubar a microplaca a 37 ±1°C em estufa com 5% de atmosfera de CO2 por 60 minutos;;
- Lavar a placa cinco vezes com 300 µL por poço com PBS com 1 % de Tween,;
- Imediatamente antes do uso, preparar a solução de substrato-cromógeno, preparado como descrito na imunoperoxidase direta;
- Acrescentar nos poços 50 µL da solução de substrato;
- Manter a microplaca por 15 a 30 minutos em temperatura ambiente, no escuro;
- Descartar o substrato-cromógeno e lavar a placa uma vez com água destilada; e
- Fazer leitura da microplaca em microscópio de luz com imagem invertida.
Imunofluorescência – direta
- Realizar titulação do anticorpo policlonal anti-PSC conjugado com isotiocianato de fluoresceína (conjugado anti-PSC), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal a ser utilizada na prova (diluição de trabalho).
- Para a diluição do anticorpo utilizar PBS, previamente tratado com 1 % de Tween e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-PSC a cada poço da microplaca;
- Incubar em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca três vezes com 300 µL PBS, por poço;
- Adicionar 50 µL de água destilada por poço da microplaca; e
- Fazer leitura da microplaca em microscópio de luz ultravioleta com imagem invertida.
Imunofluorescência Indireta
- Realizar titulação do anticorpo policlonal anti-PSC (anticorpo primário), e do anticorpo anti-suíno conjugado com isotiocianato de fluresceina (conjugado anti-suino), frente a um cultivo celular infectado com o vírus da PSC, para se conhecer a diluição ideal desses anticorpos a serem utilizadas na prova (diluição de trabalho dos anticorpos).
- Para a diluição dos anticorpos utilizar PBS, previamente tratado com 1 % de Tween 80 e 1 % de ovoalbumina GV e para a lavagem das placas utilizar PBS tratado com 1% de Tween 80;
- Adicionar 50 µL da diluição de trabalho do anticorpo primário em cada poço da microplaca;
- Incubar em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca três vezes com 300 µL de PBS, por poço;
- Adicionar 50 µL da diluição de trabalho do conjugado anti-suíno em cada poço da microplaca;
- Incubar novamente em estufa a 37 ºC ± 1 ºC por 60 minutos;
- Lavar a microplaca cinco vezes com 300 µL de PBS, por poço;
- adicionar 50 µL de água destilada por poço da microplaca; e
- Fazer leitura da microplaca em microscópio de luz ultravioleta com imagem invertida.
¶ Critérios de aceitação das provas
As provas de identificação do agente serão consideradas válidas quando os cultivos celulares sabidamente infectados apresentam imunocoloração específica e ausência de imunocoloração nos cultivos que não foram infectados.
¶ Interpretação dos resultados
I. Imunoperoxidase
- Detectado - caracterizada presença de imunocoloração celular específica, apresentado o citoplasma corado em vermelho-tijolo ou vermelho-carmim, indicando a presença de infecção viral (figura 3 A).
- Não detectado – caracterizado pela ausência de imunocoloração celular específica, apresentado o citoplasma sem coloração, indicando a ausência de infecção viral (figura 3 B).
- A amostra será considerada contaminada quando houve presença de contaminação bacteriana ou por fungos impedindo a interpretação do resultado.
II. Imunofluorescência
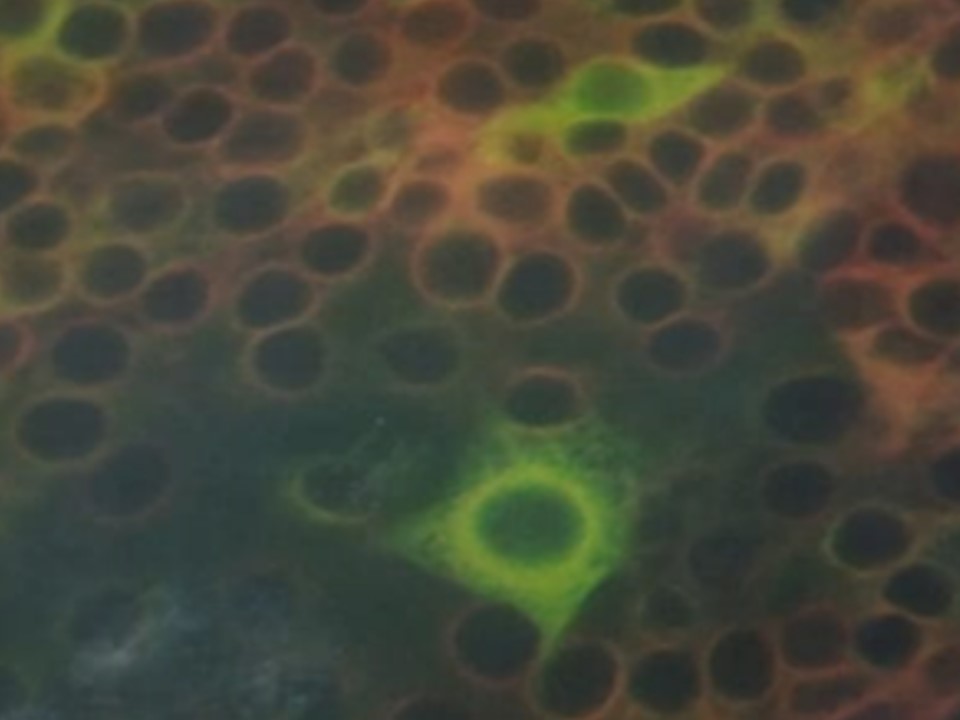
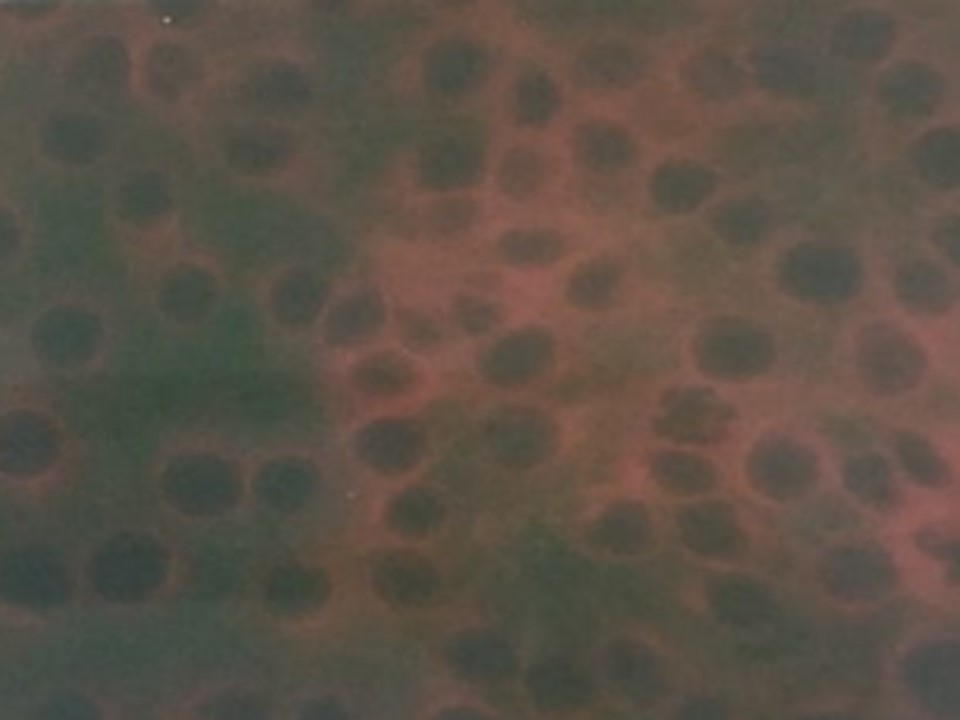
- Detectado – caracterizado pela presença de imunocoloração celular específica, apresentado o citoplasma corado em verde fluorescente, indicando a presença de infecção celular, (figura 4 A).
- Não detectado – caracterizado pela ausência de imunocoloração celular específica, apresentado o citoplasma sem coloração fluorescente, indicando a ausência de infecção viral (figura 4 B).
- A amostra será considerada contaminada quando houve presença de contaminação bacteriana ou por fungos impedindo a interpretação do resultado.
FIGURA 3 – Células PK15 coradas pela imunoperoxidase – Células infectadas (Figura 3A) e não infectadas com o vírus da Peste Suína Clássica (Figura 3B).
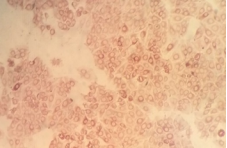

FIGURA 4 – Células PK15 coradas por imunofluorescência - Células infectadas (Figura 4A) e não infectadas com o vírus da Peste Suína Clássica (Figura 4B).
¶ Emissão dos resultados
Os resultados deverão ser emitidos e expresso como DETECTADO, NÃO DETECTADO, TÓXICA ou CONTAMINADO no isolamento viral do vírus para PSC.
¶ Descarte de Amostras e Resíduo
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos.
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶
Retenção de itens de ensaio
Amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ C. Técnica de PCR em tempo real com transcrição reversa RT-qPCR para o vírus da PSC
Materiais
- Luvas de procedimento nitrílicas ou de látex isentas de pó;
- Microtubos de volumes variados ou microplacas;
- Microplacas ou microtubos para leitura óptica de RT-qPCR;
- Tampas adesivas para microplacas para leitura óptica de RT-qPCR;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
¶ Equipamentos e instrumentos
- Autoclave;
- Cabine de segurança biológica com filtro HEPA classe II (requisito mínimo) ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Termociclador para PCR em tempo real;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Microcomputador; e
- Equipamento para extração automatizada de ácidos nucleicos (opcional).
¶ Insumos
- Água livre de nucleases;
- Oligonucleotídeos para RT-qPCR (QUADRO 2);
- Controle DETECTADO para o vírus da PSC (sempre utilizar RNA viral para averiguar eficiência da transcrição reversa);
- Kit de RT-qPCR;
- Kit de extração de RNA (automática);
- Trizol (manual); e
- Recomenda-se o uso de reações de passo único (one step) para síntese e amplificação de cDNA no mesmo tubo.
QUADRO 2: Sugestão de oligonucleotídeos para RT-qPCR para detecção molecular do vírus da PSC (VCSF)
|
Oligonucleotídeo |
Tipo de PCR |
Sequência |
Referência |
|
VCSF.Hoffman.92.F |
RT-qPCR |
ATGCCCAYAGTAGGACTAGCA |
Hoffman et al., 2005 |
|
VCSF.Hoffman.92.R |
CTACTGACGACTGTCCTGTAC |
||
|
VCSF.Hoffman.92.P |
FAM-TGGCGAGCTCCCTGGGTGGTCTAAGT-BHQ |
||
|
VCFV.Eberling.92.F |
RT-qPCR |
TGCCCAAGACACACCTTAACC |
Eberling et al., 2011 |
|
VCSF.Eberling.92.R |
GGCCTCTGCAGCGCCCTAT |
||
|
VCSF.Eberling.92.P |
FAM-TGATGGGAGTACGACCTG-MGB/NFQ |
||
|
VCSF.Risatti.93.F |
RT-qPCR |
CCCTGGGTGGTCTAAG |
Risatti et al., 2003 |
|
VCSF.Risatti.93.R |
CATGCCCTCGTCCAC |
||
|
VCSF.Risatti.93.P |
FAM- CTGAGTACAGGACAGTCGTCAGTAGTT-NFQ |
¶ Soluções
- Solução de Álcool 70%;
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses.
¶ Realização do ensaio
¶ Extração de RNA
- A extração pode ser realizada de forma automatizada ou manual, através de kits de extração de RNA ou reagentes específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Não utilizar reagentes após a data de validade e não misturar reagentes de lotes diferentes; e
- Adicionar as seguintes amostras controle a cada procedimento de extração: controle NÃO DETECTADO (água ou tecido bovino ou suíno).
¶ Reação de amplificação de ácido nucleico por RT-qPCR
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR) isenta de material genético e amplicons, e outra para a transferência de DNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com Solução Descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou Álcool 70º INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
¶ Preparo do mix de reação
- Preparar o mix de reação, de acordo com protocolos que tiveram a verificação desempenho dos ensaios comprovadas, e específicos para o agente pesquisado (vírus da PSC), em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Após o preparo do mix, adicionar o RNA nos poços da placa ou em microtubos para leitura óptica;
- A adição de RNA e das amostras controle deve ser realizada em uma área distinta do preparo do mix (sala de PCR);
- Devem ser incluídos nas análises:
- Controle DETECTADO para vírus da PSC;
- Controle NÃO DETECTADO da extração;
- Branco (água livre de nucleases); e
- Controle DETECTADO e NÃO DETECTADO do kit utilizado (se houver).
¶ Reação de RT-qPCR
- Selar a placa com adesivo óptico ou fechar a tampa dos microtubos. Verificar se há bolhas no fundo do poço e/ou gotículas na parede dos poços da placa ou tubo. Caso isto ocorra, centrifugar brevemente para reduzir as bolhas e para que o conteúdo se posicione na parte inferior da placa ou tubo;
- Iniciar e entrar com os dados no software do termociclador (identificação das amostras e seleção dos fluoróforos), conforme especificações do fabricante;
- Inserir a placa ou os tubos no termociclador, salvar o arquivo e iniciar a corrida; e
- Ao finalizar, salvar os dados e interpretar os resultados.
¶
¶ Critérios de aceitação da prova
- Para a validação do ensaio, o controle DETECTADO deve apresentar uma curva sigmoide (em forma de S) e um Cq satisfatório; e
- O controle NÃO DETECTADO deve ter Cq indeterminado ou maior que o limite do kit. O gráfico do controle NÃO DETECTADO deve apresentar traços de fluorescência na linha de base durante todo o ensaio. Esses traços não devem apresentar curva sigmoide ou um aumento gradual na fluorescência.
¶ Interpretação dos resultados
- Ao analisar os resultados da corrida, o operador deve avaliar os seguintes componentes: controle DETECTADO, controle NÃO DETECTADO, controle da extração, background de fluorescência e gráficos de amplificação de cada amostra individualmente. Após a validação do ensaio, interpretar os resultados conforme especificações do fabricante;
- O limiar de Cq a ser considerado DETECTADO deve ser avaliado conforme definido na verificação desempenho da técnica ou conforme consta a literatura;
- Amostra com resultado inconclusivo: aquelas com valor de Cq intermediário entre o valor para detectado e não detectado; e
- Amostras positivas, podem ser submetidas a sequenciamento para genotipagem viral.
¶ Emissão dos resultados
- Os resultados deverão ser emitidos em documento denominado “Relatório de Ensaio” e expressos como “DETECTADO”, “NÃO DETECTADO” ou “INCONCLUSIVO”; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
¶ Descarte das amostras e Resíduos
- Após um período mínimo de 30 dias da realização das análises, as amostras negativas poderão ser descartadas, registrando-se nos formulários próprios e conferidas antes do descarte;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes para o descarte.
¶ 4.2 PESTE SUÍNA AFRICANA - PSA
¶ 4.2.1 Amostras
São consideradas amostras para o diagnóstico da Peste Suína Africana:
Detecção da Resposta Imune
- Soro sanguíneo; e
- Plasma.
Identificação do Agente
- Sangue total;
- Tonsilas palatinas;
- Baço;
- Rins;
- Linfonodos;
- Íleo; e
- Pulmão.
¶ 4.2.2 Recebimento das Amostras
4.2.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os Laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.2.2.2. Deverão ser obedecidos os critérios estabelecidos no capítulo de verificação de conformidade de amostras.
¶
¶ 4.2.3 Técnicas de Diagnóstico
4.2.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo legislação em vigor;
4.2.3.2. Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.2.3.3. O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos.
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente;
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18 e 25ºC.
4.2.3.4 Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios interpretação dos resultados;
4.2.3.5 O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.2.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.2.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: A utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
¶ A. Ensaio Imunoenzimático (ELISA)
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Selador ou tampa para placas de ELISA;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
¶ Equipamentos e instrumentos
- Autoclave;
- Geladeira;
- Estufa;
- Termômetros
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional); e
- Lavadora de microplacas (opcional).
¶ Insumos
Kits de ELISA de detecção de anticorpos para o vírus da PSA (ASFV).
¶ Soluções
- No preparo das soluções deve ser utilizado somente os reagentes fornecidos pelo fabricante, ou aqueles por ele indicados;
- Conjugados, substratos e solução de parada deverão ser utilizados obedecendo-se as condições do fabricante;
- No preparo da solução de lavagem deve-se assegurar que não existem cristais precipitados na solução;
- Diluir a soluções utilizando água ultrapura ou destilada conforme instruções do fabricante e homogeneizar.
¶
¶ Realização do ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
- Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente; e
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
¶ Critérios de aceitação do Ensaio
O resultado do ensaio será considerado válido somente se as Densidades Óticas (DOs) dos soros controles estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos resultados
- De acordo com as DOs obtidas consideram-se as amostras como reagentes ou não reagentes. As amostras reagentes devem ser confirmadas pela técnica de Imunoperoxidase em cultivo celular; e
- Amostras com DO entre os dois pontos de corte estabelecidos serão consideradas inconclusivas e deverão ser novamente ensaiadas. Se no reensaio o inconclusivo persistir, a amostra deve ser testada pela técnica de Imunoperoxidase em cultivo celular.
¶ Emissão dos resultados
Os resultados deverão ser emitidos e expresso como REAGENTE, NÃO REAGENTE, ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico).
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos. Retenção de Itens de Ensaio;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de itens de ensaio
- Soro sanguíneo; e
- Poderão ser descartados 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidos antes do descarte.
Nota: Amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ B. Teste de Imunoperoxidase em cultivo celular
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Frascos de vidro tipo penicilina com tampa;
- Ponteiras estéreis descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Microplacas para cultivo celular em poliestireno cristal com 96 cavidades de fundo chato;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
¶
¶ Equipamentos e instrumentos
- Autoclave;
- Cabine de segurança biológica classe II B1 (requisito mínimo);
- Geladeira;
- Freezer <-70 ºC.;
- Estufa com atmosfera de CO2;
- Estufa;
- Banho seco ou que empregam água;
- Termômetros;
- Micropipetas mono e multicanais de volumes reguláveis;
- Pipetador automático ou manual;
- Agitador de tubos;
- Microscópio invertido;
- Balança analítica; e
- Centrífuga refrigerada.
¶ Insumos
- Soros controle reagente e não reagente;
- Linhagem celular VERO (3 x 105 células/mL) com isolados adaptados de ASFV.
¶ Soluções
- Meio MEM (Meio Essencial Mínimo, reconstituído de acordo com o fabricante);
- Soro fetal bovino (SFB) livre de pestivirus (BVDV) e micoplasma;
- Solução de antibióticos e antifúngicos;
- Solução Salina 0,8 % Fosfatada Tamponada (PBS) pH 7,0 - 7,4;
- Tampão de acetato, conforme preparado abaixo:
- Ácido acéticoglacial 0,2 mol/L (solução A)
- Ácido acético glacial(CH3CO2H – 60,05g/mol – CAS Number 64-19-7).................................... 1,15 mL
- Água deionizada destilada(Água DD)........................................................................................... 100 mL
- Acetato de sódio 0,2 mol/L (soluçãoB)
- Acetato de sódio tri-hidratado (CH3COONa.3H2O – 136,08 g/mol – CAS Number 6131-90-4)....... 5,44 g
- Água deionizada destilada(Água DD)....................................................................................... QSP 200 mL
- Tampão acetato(solução final A+B)
- Solução A........................................................................................................................................ 74 mL
- Solução B...................................................................................................................................... 176 mL
- Solução estoque de AEC - 3-aminoethil-carbazol, preparado como descrioto abaixo:
- Etilcarbazol (AEC) (C14H14N2 – 210,27 g/mol – CAS Number 132-32-1)................................................. 20 mg
- Dimetilformamida (C₃H₇NO – 73,09 g/mol – CAS Number 68-12-2)................................................... 2,5 mL
- Utilizar luvas, protetorrespiratório com filtroA (P2), óculosde segurança e trabalhar em uma capela química;
- Pesar 0,02 g de AEC ou, se disponível, utilizar 1 tabletede 20 mg;
- Transferir para um frasco âmbar;
- Medir 2,5 mL de dimetilformamida;
- Transferir para o frasco âmbar.
- Água destilada;
- Proteína A conjugada com peroxidase;
- Leite em pó desnatado;
- Soro Fetal Bovino (SFB);
- Tween-20;
- Peróxido de hidrogênio (H2O2).
- Solução fria de 30 % de acetona com 70 % de metanol. Estocar a <-10°C.
- Solução de bloqueio (PBS com 0,05 % Tween 20 e 5 % de leite em pó); e
- Solução de substrato (Misturar 300 µL de solução estoque em 5 mL de tampão acetato e 5 µL de H2O2.
¶ Realização do ensaio
¶
¶ Preparo das placas ASFV-IPT
- Titular o ASFV;
- Fazer uma suspensão de VERO com 150.000 células/mL semeando em placas de 96 poços com 100 μL para cada poço;
- Incubar as células por 24 a 48 h (até obter 80 a 90 % de confluência);
- Descartar o sobrenadante;
- Diluir o vírus para inocular em uma multiplicidade de infeção (moi) de 0,025 a 0,5 conforme: (Fator de diluição: 0,7 x título viral x volume de vírus por poço )/(Número de células por poço x moi)
- Utilizar o resultado obtido acima para dividir pelo volume total de vírus necessário. Exemplo, se o resultado obtido acima for 100 e forem necessários 1000 μL de vírus, será necessário adicionar 10 μL do vírus concentrado à 990 μL de meio;
- Adicionar 100 μL de vírus e incubar a 37 ±2°C.em estufa com 5% de atmosfera de CO2 por 18 ± 1 hora.
- Retirar cuidadosamente o MEM das placas de 96 poços por aspiração ou pipetagem.
- Adicionar 50 μL de solução fixadora por poço;
- Incubar entre 8 ± 2 minutos à temperatura ambiente;
- Lavar as placas fixadas por 20 minutos com PBS em agitação contínua;
- Secar as placas à temperatura ambiente; e
- Estocar as placas em freezer em temperatura < - 10 ºC (válidas por até 6 meses).
¶ Bloqueio das placas
- Mantenha as placas ASFV-IPT em temperatura ambiente (18-25ºC) por 30 minutos após a retirada do freezer;
- Bloqueie as placas adicionando 100 μL por poço de solução de bloqueio.
- Incubar 1 hora a 37 ± 2 ºC em agitação contínua;
- Durante a etapa de bloqueio, pré-incubar por 1 h a 37 ± 2 ºC em agitação contínua as amostras e os soros de referência de ASF (controles) em duplicata em placas separadas de microtitulação de 96 poços com fundo em U, conforme o esquema da FIGURA 1; e
- Preparar uma diluição de 1/40 das amostras e controles de referência ASF na solução de bloqueio com 2 % de SFB (100 μL / poço – 2,5 μL amostra + 97,5 μL).
FIGURA 1 - Esquema de montagem das placas para o ensaio.
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
A |
+S |
|
|
|
|
|
|
|
|
|
|
CC |
|
B |
+S |
|
|
|
|
|
|
|
|
|
|
CC |
|
C |
LS |
|
|
|
|
|
|
|
|
|
|
CC |
|
D |
LS |
|
|
|
|
|
|
|
|
|
|
CC |
|
E |
-S |
|
|
|
|
|
|
|
|
|
|
CC |
|
F |
-S |
|
|
|
|
|
|
|
|
|
|
CC |
|
G |
|
|
|
|
|
|
|
|
|
|
|
CC |
|
H |
|
|
|
|
|
|
|
|
|
|
|
CC |
+S: soro positivo; LS: soro limite (+S diluído); -S: soro negativo;
CC: controle de células não infectadas pelo ASFV
¶ Transferência de placas e adição conjugado
- Após 1 h, elimine a solução de bloqueio das placas ASFV-IPT e transfira para a placa com a pipeta multicanal as amostras pré-incubadas e os soros de referência;
- Incubar 45 minutos a 37 ± 2 ºC em agitação contínua;
- Lavar três vezes adicionando 100 µL por poço de PBS 1x por 5 minutos a 37 ± 2 ºC em agitação contínua. Entre as lavagens descartar o PBS e substituir por solução nova;
- Adicionar 100 μL por poço de conjugado diluído a 1/5000 em solução de bloqueio;
- Incubar 45 minutos a 37 ± 2 ºC em agitação contínua; e
- Lavar três vezes adicionando 100 µL por poço de PBS 1x por 5 minutos a 37 ± 2 ºC em agitação contínua. Entre as lavagens descartar o PBS e substituir por solução nova.
¶ Imunocoloração das microplacas
- Adicionar 50 µL da solução de substrato por poço e incube 5-10 minutos à temperatura ambiente (18-25ºC) ou até observar que as cavidades, principalmente se o controle positivo apresentar cor;
- Adicionar 100 µL por poço de PBS 1x para interromper a reação. Recomenda-se executar este passo duas vezes para evitar reações inespecíficas; e
- Realizar a leitura no microscópio.
¶ Critérios de aceitação da Prova
O teste é validado quando há uma coloração citoplasmática vermelha intensa em poços de controle positivo e ausência no caso de controles negativos. Os poços de controle de limite devem ter menos coloração vermelha do que o controle positivo.
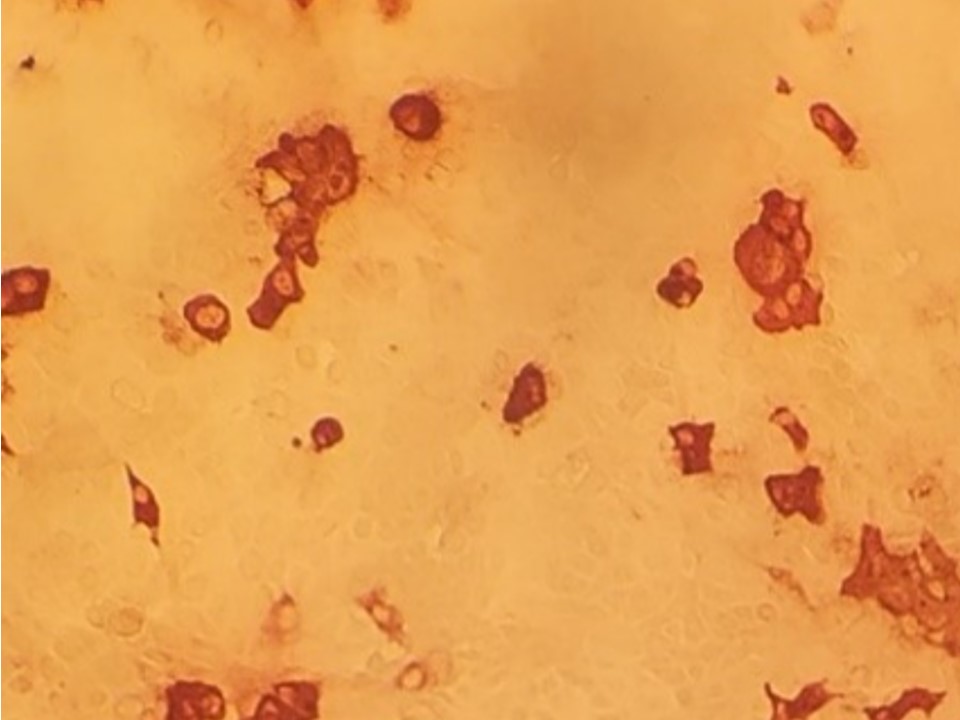
FIGURA 1 – Células Vero infectadas e adaptadas com o vírus da Peste Suína Africana (FIGURA 2A) e não infectadas (FIGURA 2B) coradas por imunoperoxidase.

¶ Interpretação dos resultados
- Nos poços com amostras positivas de soro contra a ASF, o anticorpo (Ac) estará ligado ao cultivo celular infectado pelo ASFV formando o complexo Ac-Ag que é revelado através da ação da peroxidase com o substrato. Uma intensa coloração citoplasmática vermelha será observada nas células infectadas.
- A coloração citoplasmática vermelha intensiva é interpretada como um resultado positivo para PSA (REAGENTE) e a ausência como resultado negativo (NÃO REAGENTE).
¶ Emissão dos resultados
Os resultados deverão ser emitidos e expresso como REAGENTE, NÃO REAGENTE.
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos. Retenção de Itens de Ensaio;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de itens de ensaio
- As amostras negativas poderão ser descartadas 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidos antes do descarte.
Nota: Amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ C. Técnicas moleculares para o vírus da PSA
¶
¶ Materiais
- Microtubos de 0,2 mL, 0,5 mL, 1,5 mL;
- Placas de 96 poços para PCR em tempo real (sempre averiguar o equipamento disponível e a compatibilidade da placa) Placas de 96 poços para PCR em tempo real (sempre averiguar o equipamento disponível e a compatibilidade da placa);
- Selante adesivo para placas;
- Caneta de retroprojetor;
- Descartador;
- Luvas descartáveis para procedimento;
- Ponteiras com filtro; e
- Raque refrigerada.
¶ Equipamentos e instrumentos
- Autoclave;
- Micropipetas;
- Termociclador em tempo real;
- Termociclador convencional;
- Cuba para eletroforese;
- Fonte para eletroforese;
- Transiluminador UV;
- Alternativamente, os resultados de PCR convencional podem ser avaliados por outras metodologias disponíveis como equipamento automatizado;
- Agitador de tubos;
- Cabine de segurança biológica classe II (requisito mínimo); e
- Centrífuga para microtubos.
¶ Insumos
Reação em Cadeia da Polimerase em Tempo Real - qPCR
- Água livre de nucleases;
- Iniciadores e sondas descritos no QUADRO 1; e
- Master mix para PCR em tempo real Master mix para PCR em tempo real.
Reação em Cadeia da Polimerase PCR
- Água livre de nucleases;
- Iniciadores e sondas descritos no QUADRO 1;
- Cloreto de magnésio;
- Tampão específico para DNA polimerase;
- DNA polimerase; e
- DNTP.
QUADRO 1 - Oligonucleotídeos utilizados nas PCRs
|
Oligonucleotídeo |
Sequência |
Referência |
|
ASFV.OIE.F |
CTGCTCATGGTATCAATCTTATCGA |
King, 2003 |
|
ASFV.OIE.R |
GATACCACAAGATCRGCCGT |
|
|
ASFV.OIE.S |
FAM-CCACGGGAGGAATACCAACCCAGTG-IowaBlack |
|
|
ASFV.EUA.63.F |
GGAAACTCATTCACCAAATCCTT |
Zsak, 2005 |
|
ASFV.EUA.63.R |
CCTCGGCGAGCGCTTTATCAC |
|
|
ASFV.EUA.S |
FAM- CgATgCAAgCTTTAT-MGB/NFQ |
|
|
ASFV.Tignon2011.114.F |
CCACTGGGTTGGTATTCCTC |
Tignon, 2011 |
|
ASFV.Tignon2011.114.R |
TGCTCATGGTATTCAATCTTATCG |
|
|
ASFV.Tignon2011.114.S |
FAM-TTCCATCAAAGTTCTGCAGCTCTT-IowaBlack |
|
|
ASFV.68.F |
CCCAGGRGATAAAATGACTG |
Fernández-Pinero., 2013 |
|
ASFV.68.R |
CACTRGTTCCCTCCACCGATA |
|
|
ASFV.68.S |
FAM-TCC-TGG-CCR-ACC-AAG-TGC-TT-BHQ* |
|
|
ASFV.p72.478.F |
GGCACAAGTTCGGACATGT |
Bastos, 2003 |
|
ASFV.p72.478.R |
GTACTGTAACGCAGCACAG |
|
|
ASFV.CD2V.816.F |
TCTGTTGATTCCCCAACTATTAC |
Sanna, 2017 |
|
ASFV.CD2V.816.R |
ATGGCGGGATATTGGGTAGT |
*Sonda atualizada após publicação do artigo
Todas as soluções estoques de oligonucleotídeos devem ser mantidas a uma concentração de 500 µM a não ser que já venham previamente diluídas. Recomenda-se que as soluções de trabalho sejam diluídas a 10 µM;
¶ Soluções
- Solução de Álcool 70º INPM; e
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses.
¶
¶ Realização do ensaio
¶ Extração de DNA
- A extração pode ser realizada de forma automatizada ou manual, através de kits de extração de DNA ou reagentes específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante. Os métodos manuais utilizando kits com coluna de sílica são alternativas para poucas amostras ou em caso de impossibilidade do uso dos equipamentos automáticos;
- Não utilizar reagentes após a data de validade e não misturar reagentes de lotes diferentes;
- Adicionar as seguintes amostras controle a cada procedimento de extração: controle NÃO DETECTADO (água ou tecido suíno).
¶
¶ Reação de amplificação de ácido nucleico
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR) isenta de material genético e amplicons, e outra para a transferência de DNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com Solução Descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou Álcool 70º INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
¶ PCR para detecção de ASFV
PCR em tempo real - qPCR
- Descongelar e homogeneizar todos os reagentes;
- Identificar os tubos ou placas;
- Preparar o mix de reação, de acordo com protocolos que tiveram a verificação desempenho dos ensaios comprovadas, e específicos para o agente pesquisado (vírus da PSA), em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Ao distribuir o volume das reações individuais, descontar o volume dos ácidos nucleicos extraídos das amostras e dos controles;
- Adicionar à solução de ácidos nucleicos extraídos, conforme volume indicado no QUADRO 3, em local determinado no laboratório diferente daquele em que o mix de PCR foi preparado;
- Selar as placas ou fechar os tubos. É recomendável realizar um spin no caso de uso de placas de qPCR;
- Programar o termociclador, conforme os protocolos de validação dos ensaios.
PCR Convencional - cPCR
- Descongelar e homogeneizar todos os reagentes;
- Identificar os tubos ou placas;
- Preparar o mix de reação, de acordo com protocolos que tiveram a verificação desempenho dos ensaios comprovadas, e específicos para o agente pesquisado (vírus da PSA), em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Ao distribuir o volume das reações individuais, descontar o volume dos ácidos nucleicos extraídos das amostras e dos controles;
- Adicionar a solução de ácidos nucleicos extraídos conforme volume indicado no QUADRO 3 em local determinado no laboratório diferente daquele em que o mix de PCR foi preparado;
- Selar as placas ou fechar os tubos. É recomendável realizar um spin no caso de uso de placas de PCR;
- Programar o termociclador, conforme os protocolos de validação dos ensaios.
¶ Interpretação dos resultados
qPCR
- Ao analisar os resultados da corrida, o operador deve avaliar os seguintes componentes: controle DETECTADO, controle NÃO DETECTADO, controle da extração, background de fluorescência e gráficos de amplificação de cada amostra individualmente. Após a validação do ensaio, interpretar os resultados conforme especificações do fabricante;
- O limiar de Cq a ser considerado DETECTADO deve ser avaliado conforme definido na verificação desempenho da técnica ou conforme consta a literatura;
- Amostra com resultado inconclusivo: aquelas com valor de Cq intermediário entre o valor para detectado e não detectado;
- Qualquer amostra questionável deverá ser retestada; e
- Amostras positivas devem ser submetidas a sequenciamento para genotipagem viral.
PCR convencional - PCR
- Os controles positivos devem apresentar bandas de acordo com o padrão esperado definido pela metodologia. Os tamanhos dos produtos de PCR para as técnicas ASFV.OIE, ASFV.p72.478, ASFV.CD2V.816 são 250, 478 e 816 pares de base;
- Os controles negativos não devem apresentar bandas em padrão semelhante ao dos controles positivos; e
- Amostras com padrão de eletroforese semelhantes ao do controle positivo serão consideradas positivas, podendo ser submetidas ao sequenciamento para confirmação.
¶
¶ Emissão dos resultados
- Os resultados deverão ser emitidos e expressos como “DETECTADO”, “NÃO DETECTADO” ou “INCONCLUSIVO”;
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
¶ Descarte das amostras e Resíduos
- Após um período mínimo de 30 dias da realização das análises, as amostras negativas poderão ser descartadas, registrando-se nos formulários próprios e conferidas antes do descarte;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes para o descarte.
¶ Retenção de itens de ensaio
- As amostras negativas poderão ser descartados 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidos antes do descarte; e
- Amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo elas serem registradas e controladas pelo laboratório responsável pela análise.
¶ 4.3 SÍNDROME REPRODUTIVA E RESPIRATÓRIA DOS SUÍNOS - PRRS
¶ 4.3.1 Amostras
São consideradas amostras para o diagnóstico de PRRS:
Detecção da Resposta Imune
Soro sanguíneo.
Identificação do Agente
- Soro Sanguíneo
- Sangue total;
- Tonsilas Palatinas;
- Baço;
- Linfonodos;
- Pulmão;
- Íleo;
- Lavado bronco-alveolar; e
- Fluido Oral.
¶ 4.3.2. Recebimento das Amostras
4.3.2.1. Para atendimento aos Programas e Controles Oficiais do MAPA os laboratórios credenciados somente receberão as amostras previstas na legislação em vigor para as finalidades e ensaios previstos no seu escopo de credenciamento.
4.3.2.2. Deverão ser obedecidos aos critérios estabelecidos no capítulo de verificação de conformidade de amostras.
¶ 4.3.3.Técnicas de Diagnóstico
4.3.3.1. Somente poderão ser utilizados insumos de diagnóstico que tenham registro no MAPA, segundo legislação em vigor;
4.3.3.2 Todos os insumos utilizados na análise devem ser controlados e previamente testados e aprovados;
4.3.3.3. O laboratório deverá realizar os ensaios obedecendo às temperaturas preconizadas pelo fabricante dos insumos
a) Quando esta informação não constar na bula o laboratório deverá consultar o fabricante, mesmo que a indicação seja de realização a temperatura ambiente
b) Quando não informado pelo fabricante, serão considerados como temperatura ambiente, valores de temperatura entre 18 e 25ºC.
4.3.3.4. Antes da utilização dos insumos, realizar a avaliação de todos os parâmetros referentes aos lotes e valores de ponto de corte dos critérios interpretação dos resultados;
4.3.3.5. O laboratório deve estabelecer um meio de avaliação apropriado para todos os insumos utilizados nos ensaios;
4.3.3.6. Devem ser retidos os registros dos controles dos ensaios realizados, devendo ser registrada data e responsável de todas as etapas realizadas para cada amostra analisada;
4.3.3.7. Os resultados encontrados para cada amostra e controles, dados dos insumos utilizados e outras informações pertinentes devem ser registrados em formulários próprios e/ou sistema informatizado do próprio laboratório;
Nota: a utilização de sistemas informatizados para registros apenas é permitido quando:
I. A inclusão dos dados for realizada durante a execução e leitura do ensaio, sem anotação prévia em formulários de papel. Dados transcritos não são considerados dados brutos.
II. As alterações de informações estejam prontamente disponíveis e rastreáveis, sem a necessidade de intervenção de especialistas em informática ou geração de logs ou equivalentes.
III. O dado anterior, o responsável pela alteração e a data da realização da alteração estiver prontamente disponível.
¶ A. Ensaio Imunoenzimático (ELISA)
¶ Materiais
- Luvas para procedimentos;
- Pipetas de vidro graduadas ou descartáveis;
- Provetas graduadas;
- Béqueres;
- Erlenmeyers;
- Ponteiras descartáveis;
- Descartador de ponteiras;
- Reservatórios para soluções (cubetas);
- Papel absorvente;
- Selador ou tampa para placas de ELISA;
- Caneta para identificação de vidraria; e
- Cubas para descarte de materiais resistente à autoclavação.
¶ Equipamentos e instrumentos
- Autoclave;
- Geladeira;
- Estufa;
- Termômetros
- Micropipetas monocanal e multicanal de volumes reguláveis;
- Pipetador automático ou manual;
- Leitora de ELISA;
- Cronômetros;
- Agitador de tubos tipo vórtex (opcional);
- Agitador de microplacas (opcional); e
- Lavadora de microplacas (opcional).
¶ Realização do ensaio
- Para realização dos ensaios de ELISA devem ser consideradas as orientações do fabricante do kit de diagnóstico utilizado. Atentar para ocorrência de atualização na bula do kit, principalmente em mudanças de lote;
- A ordem de execução das etapas do ensaio, duração, volumes utilizados e temperatura de incubação variam de acordo com fabricante do kit utilizado;
- Homogeneizar gentilmente todos reagentes e amostras antes do uso;
- Utilizar ponteiras distintas para cada controle e amostra de soro;
- Homogeneizar as placas tocando-as na lateral ou utilizando um agitador de placas;
- Nas etapas de incubação, as placas devem ser seladas para se evitar evaporação;
- As placas devem ser lavadas com a solução indicada pelo kit. Após a última lavagem remover resíduos em um material absorvente (papel toalha ou toalha). Deixar as placas secas o mínimo de tempo possível entre a lavagem e adição do próximo reagente; e
- Decorridas todas as etapas do teste, realizar a leitura da absorbância na leitora de ELISA utilizando filtro com comprimento de onda indicado nas instruções do fabricante.
¶ Critérios de aceitação do Ensaio
O resultado do ensaio será considerado válido somente se as Densidades Óticas (DOs) dos soros controles estiverem dentro dos limites aceitáveis e determinados pelo fabricante. Caso contrário, o ensaio deve ser repetido.
¶ Interpretação dos resultados
De acordo com as DOs obtidas consideram-se os resultados como não reagente ou reagente.
¶ Emissão dos resultados
Os resultados e expresso como, reagente, não reagente, ou de acordo com o preconizado com o fabricante do insumo (kit de diagnóstico).
¶ Descarte de Amostras e Resíduos
- Antes da realização do descarte de amostras e produtos de ensaio deverão ser observados os prazos mínimos estabelecidos. Retenção de Itens de Ensaio;
- Todo material utilizado na realização do ensaio deve ser imerso em cuba com solução de ácido cítrico 0,2%, hipoclorito de sódio 0,5% ou solução para descontaminação similar, por no mínimo de 1 hora;
- Após este período, todo o material utilizado na realização do ensaio deve ser submetido ao processo de autoclavação apropriado e validado. A efetividade de esterilização deve estar comprovada em procedimentos próprios do laboratório;
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes durante todo processo de descarte.
¶ Retenção de itens de ensaio
- Soro sanguíneo; e
- Poderão ser descartados 60 dias após a emissão do relatório de ensaio, registrando-se nos formulários próprios e conferidos antes do descarte.
Nota: Amostras positivas de qualquer origem devem ser armazenadas de forma permanente, incluindo todos os registros e documentação pertinente, devendo as mesmas serem registradas e controladas pelo laboratório responsável pela análise.
¶ B. Técnica de PCR convencional com transcrição reversa RT-PCR para detecção de PRRSV (sequenciamento genético)
¶ Materiais
- Luvas de procedimento nitrílica ou de látex isentas de pó;
- Pipetas graduadas;
- Microtubos de volumes variados ou microplacas;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
¶ Equipamentos e instrumentos
- Autoclave;
- Cabine de segurança biológica com filtro HEPA classe II (requisito mínimo) ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Pipetador automático ou manual;
- Termociclador;
- Balança de precisão;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Micro-ondas;
- Cuba e fonte para eletroforese;
- Microcomputador;
- Sistema de fotodocumentação; e
- Equipamento para extração automatizada de ácidos nucleicos (opcional).
¶ Insumos
- Água livre de nucleases;
- Oligonucleotídeos para RT-PCR (QUADRO 1);
- Controle DETECTADO para o vírus da PRRS (sempre utilizar RNA viral para averiguar eficiência da transcrição reversa);
- Kit de RT-PCR;
- Kit de extração de RNA (automática);
- Trizol (manual);
- Recomenda-se o uso de reações de passo único (one step) para síntese e amplificação de cDNA no mesmo tubo.
QUADRO 1: Sugestão de Oligonucleotídeos para PCR convencional com transcrição reversa RT-PCR para sequenciamento genético de PRRSV
|
Oligonucleotídeo |
Tipo PCR |
Sequência |
Referência |
|
PRRS.ORF7.484.USA.F |
RT-PCR |
tcgtgttgggtggcagaaaagc |
Kim, 2008 |
|
PRRS.ORF7.484.USA.R |
gccattcaccacacattcttcc |
||
|
PRRS.ORF7.457.EU.F |
aaacgagctgttaaacgaggagtgg |
||
|
PRRS.ORF7.457.EU.R |
ccaatcgcggccattcacctgactg |
||
|
PRRS.Chung2002.255.F |
RT-PCR |
cctcctgtatgaacttgc |
Chung, 2002 |
|
PRRS.Chung2002.255.R |
aggtcctcgaacttgagctg |
||
|
PRRS.255.F2 |
cctcytrtatgaacttgc |
||
|
PRRS.255.R2 |
agrtcctcgaayttragctg |
||
|
PRRS.Chung2002.186.F |
gtatgaacttgcaggatg |
||
|
PRRS.Chung2002.186.R |
gccgacaataccatgtgctg |
||
|
PRRS.Chung2002.107.F |
ggcgcagtgactaagaga |
||
|
PRRS.Chung2002.107.R |
gtaactgaacaccatatgctg |
||
|
PRRS.Chung2002.255.F |
cctcctgtatgaacttgc |
¶ Soluções
- Solução de Álcool 70%;
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses.
¶ Realização do ensaio
¶ Extração de RNA
- A extração pode ser realizada de forma automatizada ou manual, através de kits de extração de RNA ou reagentes específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Não utilizar reagentes após a data de validade e não misturar reagentes de lotes diferentes; e
- Adicionar as seguintes amostras controle a cada procedimento de extração: controle NÃO DETECTADO (água ou tecido bovino ou suíno).
¶ Reação de amplificação de ácido nucleico (RT-PCR)
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR), isenta de material genético e amplicons, e outra para a transferência de DNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou Álcool 70%; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
¶ Preparo do mix de reação
- Preparar o mix de reação de acordo com protocolos validados e específicos para o agente pesquisado (vírus da PRRS), em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Adicionar o mix de reação a cada poço da microplaca (ou microtubos); e
- Devem ser incluídos nas análises:
- Controle DETECTADO para PRRS;
- Controle NÃO DETECTADO da extração;
- Branco (água livre de nucleases).
¶ Reação de PCR
- Após o preparo do mix, adicionar o RNA nos poços da placa ou em microtubos identificados com a numeração da amostra a ser testada; e
- Realizar a amplificação em termociclador certificado, conforme as especificações de temperatura do protocolo utilizado.
¶ Eletroforese
- Preparar o gel de agarose em concentração adequada ao protocolo de PCR utilizado. Adicionar um corante para ácidos nucleicos em proporção suficiente para visualização das bandas;
- Para a corrida das amostras, adicionar tampão de carregamento (loading buffer) ao produto de PCR;
- Aplicar marcador de peso molecular em um dos poços do gel;
- Realizar a corrida em cuba de eletroforese, utilizando o tempo e a voltagem adequados para o volume do gel e o protocolo de PCR utilizado; e
- Visualizar o gel sob luz ultravioleta, fotografar com o auxílio de um fotodocumentador e analisar o resultado.
¶ Critérios de aceitação da prova
- As amostras de controle DETECTADO para PRRS devem apresentar bandas de tamanhos correspondentes aos amplicons do protocolo utilizado; e
- As amostras de controle NÃO DETECTADO (controle NÃO DETECTADO da extração e branco) não devem apresentar bandas de amplificação.
¶ Interpretação dos resultados
- Comparar os resultados das amostras testadas ao das amostras controle, a fim de classificá-las como positivas ou negativas;
- A leitura das bandas deve ser clara e livre de amplicons inespecíficos para o teste ser considerado satisfatório; e
- Qualquer amostra questionável deverá ser retestada.
¶ Emissão dos resultados
- Os resultados deverão ser emitidos e expressos como “DETECTADO” ou “NÃO DETECTADO”; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
¶ Descarte das amostras e Resíduos
- Após um período mínimo de 90 dias da realização das análises, as amostras negativas poderão ser descartadas, registrando-se nos formulários próprios e conferidas antes do descarte;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes para o descarte.
¶ C. Técnica de RT-qPCR para detecção do PRRSV
¶ Materiais
- Luvas de procedimento nitrílica ou de látex isentas de pó;
- Microtubos de volumes variados ou microplacas;
- Microplacas ou microtubos para leitura óptica de RT-qPCR;
- Tampas adesivas para microplacas para leitura óptica de RT-qPCR;
- Ponteiras com filtro, estéreis, livres de DNAses e RNAses;
- Estantes para microtubos; e
- Gaze ou papel toalha.
¶ Equipamentos e instrumentos
- Autoclave;
- Cabine de segurança biológica com filtro HEPA classe II (requisito mínimo) ou estação de trabalho para PCR (Workstation PCR) com luz UV germicida;
- Geladeira;
- Freezer;
- Micropipetas mono e multicanais de volumes reguláveis;
- Termociclador para PCR em tempo real;
- Centrífuga refrigerada com rotores para microtubos;
- Agitador de microtubos;
- Microcomputador; e
- Equipamento para extração automatizada de ácidos nucleicos (opcional).
¶ Insumos
- Água livre de nucleases;
- Kit específico de RT-qPCR para detecção de PRRS;
- Controle DETECTADO para PRRS (sempre utilizar RNA viral para averiguar eficiência da transcrição reversa);
- Kit de extração de RNA (automática);
- Trizol (manual);
- Recomenda-se o uso de kits com reações de passo único (one step) para síntese e amplificação de cDNA no mesmo tubo.
¶ Soluções
- Solução de Álcool 70%; e
- Solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses.
¶ Realização do ensaio
¶ Extração de RNA
- A extração pode ser realizada de forma automatizada ou manual, através de kits de extração de RNA ou reagentes específicos para o tipo de material a ser analisado, seguindo as recomendações do fabricante;
- Não utilizar reagentes após a data de validade e não misturar reagentes de lotes diferentes; e
- Adicionar as seguintes amostras controle a cada procedimento de extração: controle NÃO DETECTADO (água ou tecido bovino ou suíno).
¶ Reação de amplificação de ácido nucleico por PCR em tempo real com transcrição reversa RT-qPCR
- Realizar o ensaio em duas áreas separadas: uma para o preparo do mix de reação (sala de pré-PCR) isenta de material genético e amplicons, e outra para a transferência de DNA para placa ou microtubos (sala de PCR);
- Antes e após o preparo do mix de reação, descontaminar a cabine e os materiais a serem utilizados com solução descontaminante de moléculas residuais de RNAs / DNAs / amplicons /resíduos de proteínas de superfícies, entre as quais DNAses/RNAses e/ou álcool 70º INPM; e
- As micropipetas utilizadas para o preparo do mix de reação e adição das amostras devem ser exclusivas para tais finalidades.
¶ Preparo do mix de reação
- Preparar o mix de reação de acordo com protocolos validados e específicos para o agente pesquisado (vírus da PRRS), em quantidade suficiente para o número de amostras a serem testadas, considerando algumas a mais;
- Após o preparo do mix, adicionar o RNA nos poços da placa ou em microtubos para leitura óptica;
- A adição de DNA e das amostras controle deve ser realizada em uma área distinta do preparo do mix (sala de PCR);
- Devem ser incluídos nas análises:
- Controle DETECTADO para PRRS;
- Controle NÃO DETECTADO da extração;
- Branco (água livre de nucleases);
- Controle DETECTADO e NÃO DETECTADO do kit utilizado (se houver).
¶ Reação de RT-qPCR
- Selar a placa com adesivo óptico ou fechar a tampa dos microtubos. Verificar se há bolhas no fundo do poço e/ou gotículas na parede dos poços da placa ou tubo. Caso isto ocorra, centrifugar brevemente para reduzir as bolhas e para que o conteúdo se posicione na parte inferior da placa ou tubo;
- Iniciar e entrar com os dados no software do termociclador (identificação das amostras e seleção dos fluoróforos), conforme especificações do fabricante;
- Inserir a placa ou os tubos no termociclador, salvar o arquivo e iniciar a corrida; e
- Ao finalizar, salvar os dados e interpretar os resultados.
¶ Critérios de aceitação da prova
- Para a validação do ensaio, o controle DETECTADO deve apresentar uma curva sigmoide (em forma de S) e um Cq satisfatório;
- O controle NÃO DETECTADO deve ter Cq indeterminado ou maior que o limite definido pelo fabricante do kit. O gráfico do controle NÃO DETECTADO deve apresentar traços de fluorescência na linha de base durante todo o ensaio. Esses traços não devem apresentar curva sigmoide ou um aumento gradual na fluorescência.
¶ Interpretação dos resultados
- Ao analisar os resultados da corrida, o operador deve avaliar os seguintes componentes: controle DETECTADO, controle NÃO DETECTADO, controle da extração, background de fluorescência e gráficos de amplificação de cada amostra individualmente. Após a validação do ensaio, interpretar os resultados conforme especificações do fabricante;
- O limiar de Cq a ser considerado DETECTADO deve ser avaliado conforme definido na verificação desempenho da técnica ou conforme consta a literatura;
- O limiar de Cq a ser considerado DETECTADO deve ser avaliado conforme definido na verificação desempenho da técnica ou conforme consta a literatura;
- Qualquer amostra questionável deverá ser retestada; e
- Amostras positivas devem ser submetidas a sequenciamento para genotipagem viral.
¶ Emissão dos resultados
- Os resultados deverão ser emitidos e expressos como “DETECTADO”, “NÃO DETECTADO” ou “INCONCLUSIVO” ; e
- Expressar a quantidade de alíquotas positivas ou negativas dentre o total de alíquotas analisadas.
¶ Descarte das amostras e Resíduos
- Após um período mínimo de 90 dias da realização das análises, as amostras negativas poderão ser descartadas, registrando-se nos formulários próprios e conferidas antes do descarte;
- Os materiais descartados devem ser separados adequadamente entre resíduos químicos e biológicos; e
- O laboratório deve assegurar a biosseguridade dos resíduos gerados e seguir as legislações ambientais vigentes para o descarte.
¶ 5. Base legal e documentos de referência
PSC
- Eberling AJ, Bieker-Stefanelli J, Reising MM, Siev D, Martin BM, McIntosh MT, Beckham TR. Development, optimization, and validation of a Classical swine fever virus real-time reverse transcription polymerase chain reaction assay. J Vet Diagn Invest. 2011 Sep;23(5):994-8.
- Freitas, T. R. P., et al. Conceitos básicos, métodos e técnicas em laboratório de virologia animal. Pedro Leopoldo, Gráfica Tavares, 2006. 176 p.
- Hoffmann B, Beer M, Schelp C, Schirrmeier H, Depner K. Validation of a real-time RT-PCR assay for sensitive and specific detection of classical swine fever. J Virol Methods. 2005 Dec;130(1-2):36-44.
- Risatti GR, Callahan JD, Nelson WM, Borca MV. Rapid detection of classical swine fever virus by a portable real-time reverse transcriptase PCR assay. J Clin Microbiol. 2003 Jan;41(1):500-5.
- Classical Swine Fever (Infection with a Classical Swine Virus). CHAPTER 3.9.3 Version (NB: Version adopted in May 2022). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2022, versão online. Disponível em: https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/3.09.03_CSF.pdf .
- Reed LJ, Muench H. A simple method of estimating fifty per cent endpoints. Am J Hyg. 1938; 27:493–497.
PSA
- African Swine Fever (Infection with a African Swine Virus). CHAPTER 3.9.1 Version (NB: Version adopted in May 2019). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2023 , versão online. Disponível em: Acesso em: 18 de jan. de 2024
- Bastos AD, Penrith ML, Crucière C, Edrich JL, Hutchings G, Roger F, Couacy-Hymann E, R Thomson G. Genotyping field strains of African swine fever virus by partial p72 gene characterisation. Arch Virol. 2003 Apr;148(4):693-706.
- CENTRO DE INVESTIGACION EN SANIDAD ANIMAL (CISA – INIA) - Indirect Immunoperoxidase Technique for ASF Antibody Detection, SOP/CISA/ASF/IPT/1, 7p., rev. 2018.
- CENTRO DE INVESTIGACION EN SANIDAD ANIMAL (CISA – INIA) - Indirect Immunoperoxidase Technique for ASF Antibody Detection, SOP/CISA/ASF/IPT-plates/1, 6p, rev. 2018.
- Fernández-Pinero J, Gallardo C, Elizalde M, Robles A, Gómez C, Bishop R, Heath L, Couacy-Hymann E, Fasina FO, Pelayo V, Soler A, Arias M. Molecular diagnosis of African Swine Fever by a new real-time PCR using universal probe library. Transbound Emerg Dis. 2013 Feb;60(1):48-58. doi: 10.1111/j.1865-1682.2012.01317.x.
- Gallardo, C.; Reis, A.L.; Kalema-Zikusoka, G. Malta, J.; Soler, A.; Blanco, E.; Parkhouse, R. M. E.; Leitão, A. Recombinant Antigen Targets for Serodiagnosis of African Swine Fever. American Society for Microbiology. Vol. 16, nº 7, 2009.
- King DP, Reid SM, Hutchings GH, Grierson SS, Wilkinson PJ, Dixon LK, Bastos AD, Drew TW. Development of a TaqMan PCR assay with internal amplification control for the detection of African swine fever virus. J Virol Methods. 2003 Jan;107(1):53-61.
- Ribeiro EL, Oliveira AGG, Laguardia-Nascimento M, Mata CPSM, Reis JKP, Fonseca Júnior AA. Estudo comparativo e validação de três técnicas de PCR em tempo real (qPCR) para diagnóstico de Peste Suína Africana. Pesquisa Veterinária Brasileira, 2016, 36(6), 473-478.
- Sanna G, Dei Giudici S, Bacciu D, Angioi PP, Giammarioli M, De Mia GM, Oggiano A. Improved Strategy for Molecular Characterization of African Swine Fever Viruses from Sardinia, Based on Analysis of p30, CD2V and I73R/I329L Variable Regions. Transbound Emerg Dis. 2017 Aug;64(4):1280-1286.
- Tignon M, Gallardo C, Iscaro C, Hutet E, Van der Stede Y, Kolbasov D, De Mia GM, Le Potier MF, Bishop RP, Arias M, Koenen F. Development and inter-laboratory validation study of an improved new real-time PCR assay with internal control for detection and laboratory diagnosis of African swine fever virus. J Virol Methods. 2011 Dec;178(1-2):161-70.
- Zsak L, Borca MV, Risatti GR, Zsak A, French RA, Lu Z, Kutish GF, Neilan JG, Callahan JD, Nelson WM, Rock DL. Preclinical diagnosis of African swine fever in contact-exposed swine by a real-time PCR assay. J Clin Microbiol. 2005 Jan;43(1):112-9.
SÍNDROME REPRODUTIVA E RESPIRATÓRIA DOS SUÍNOS - PRRS
- Chung HK, Choi C, Kim J, Chae C. Detection and differentiation of North American and European genotypes of porcine reproductive and respiratory syndrome virus in formalin-fixed, paraffin-embedded tissues by multiplex reverse transcription-nested polymerase chain reaction. J Vet Diagn Invest. 2002. Jan;14(1):56-60.
- Kim WI, Kim JJ, Cha SH, Yoon KJ. Different biological characteristics of wild-type porcine reproductive and respiratory syndrome viruses and vaccine viruses and identification of the corresponding genetic determinants. J Clin Microbiol. 2008;46(5):1758–1768. doi:10.1128/JCM.01927-07
- Porcine reproductive and respiratory syndrome (infection with porcine reproductive and respiratory syndrome virus. CHAPTER 3.9.6 (NB: Version adopted in May 2021 ). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2023, versão online. Disponível em: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/Acesso em: 16 de fev. de 2024.
¶ 6. Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ 7. Histórico de revisões
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1 | -//- | 05.09.2024 | Elaboração do documento |