¶ Folha resumo
|
Macroprocesso: 22 - Prevenção, Controle e Erradicação de Doenças e Pragas |
Objetivo: Este Manual visa estabelecer os procedimentos para o trânsito de subprodutos de origem animal, emissão de CIS-E e credenciamento de médicos veterinários particulares. |
|||
|
Processo: 22.05 - Gerenciar os riscos na produção, trânsito e comércio de animais, vegetais e seus produtos |
||||
|
Entrega: Sanidade dos Animais e das Plantas |
Público alvo e demais interessados: Público interno: destinado à Secretaria de Defesa Agropecuária. Destinado ao Serviço Veterinário Oficial (Federal), Serviço Veterinário Oficial (Estadual) e Médicos Veterinários habilitados. |
Versão do documento: 3.0 |
||
|
Setor responsável e responsabilidades Departamento de Saúde Animal (DSA): responsável por elaborar e revisar o manual sempre que houver necessidade, para atendimento ou atualização com base nas leis, regulamentações e normas internas aplicáveis. |
||||
¶ Definições e conceitos
Para fins deste Manual, consideram-se as seguintes definições:
I – produto de origem animal: todas as partes ou derivados oriundos de animais;
II – subproduto de origem animal: todas as partes ou derivados oriundos de animais, não destinados à alimentação humana;
III – serviço veterinário oficial: instituição pública de defesa sanitária animal;
IV – médico veterinário responsável técnico: profissional graduado em medicina veterinária que comprovadamente presta assistência técnica a estabelecimento produtor ou transformador de subprodutos de origem animal;
V – médico veterinário oficial: profissional graduado em medicina veterinária pertencente ao quadro do serviço veterinário oficial;
VI – funcionário autorizado: profissional pertencente ao quadro do serviço veterinário oficial, autorizado a emitir o Certificado de Inspeção Sanitária modelo “E” – CIS-E;
VII – animais de açougue: mamíferos (bovídeos, equídeos, suídeos, ovinos, caprinos e coelhos), aves domésticas e animais de aquicultura, pesca e extrativismo, bem como os animais silvestres criados em cativeiro, destinados ao abate em estabelecimentos sob inspeção veterinária oficial.
Siglas:
CIS-E: Certificado de Inspeção Sanitária modelo “E"
CGTQA: Coordenação-Geral de Trânsito e Quarentena Animal
CSN: Certificado Sanitário Nacional
CRMV: Conselho Regional de Medicina Veterinária
DSA: Departamento de Saúde Animal
GT: Guia de Trânsito de Produtos
MAPA: Ministério da Agricultura, Pecuária e Abastecimento
SDA: Secretaria de Defesa Agropecuária
SFA: Superintendência Federal de Agricultura
SIF: Serviço de Inspeção Federal
¶ Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário pelo Departamento de Saúde Animal (DSA) e aprovada pela Secretaria de Defesa Agropecuária (SDA).
A gestão desse manual está sob a responsabilidade do Departamento de Saúde Animal (DSA), que prestará auxílio ao público-alvo leitor. Dúvidas e/ou sugestões quanto a aplicação deste manual deve ser submetida ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da Secretaria de Defesa Agropecuária (SDA) para acesso pelo público-alvo será de responsabilidade da Secretaria representada pelo Departamento de Saúde Animal (DSA).
¶ Objetivo
O objetivo deste manual é estabelecer os procedimentos para o trânsito de subprodutos de origem animal, emissão de CIS-E e credenciamento de médicos veterinários particulares.
¶ Procedimentos
¶ 1. CONTROLE DO TRÂNSITO DE SUBPRODUTOS DE ORIGEM ANIMAL
Todo subproduto de origem animal para fins industriais, quando em trânsito, deve estar acompanhado do Certificado de Inspeção Sanitária modelo “E” – CIS-E, conforme modelo aprovado pela Portaria nº 51, de 19 de setembro de 1977. Não é permitida a utilização do CIS-E para o trânsito de produtos de origem animal destinados ao consumo humano.
Deve-se utilizar um certificado para o trânsito de cada tipo de subproduto (couro, pelo, osso, lã, crina, cerda, pelo, pena, chifre, casco, etc.)
Para o trânsito a partir de estabelecimentos sob controle veterinário do Serviço de Inspeção Federal – SIF, permanecem vigentes os modelos de Guia de Trânsito de Produtos (GT) e de Certificado Sanitário Nacional (CSN) definidos pela Instrução de Serviço Nº 10, de 15 de abril de 1991, ou outros modelos equivalentes que venham a ser adotados pelo MAPA. O trânsito de subprodutos de origem animal deve seguir as normas estabelecidas pela Coordenação de Trânsito e Quarentena Animal e pelos programas oficiais de controle ou erradicação de doenças conduzidos pelo Departamento de Saúde Animal. Essas regras devem ser observadas pelo profissional que emitirá o CIS-E previamente à expedição do documento. Portanto, o trânsito de subprodutos de animais susceptíveis à febre aftosa está condicionado ao cumprimento dos parâmetros definidos na Instrução Normativa nº 48, de 14 de julho de 2020, assim como o trânsito de subprodutos de aves é regido pela Instrução Normativa nº 17, de 7 de abril de 2006, e assim por diante. O profissional responsável pela emissão do CIS-E deverá conhecer profundamente a legislação que rege o tema, a fim de segui-la em todos seus pormenores. Uma lista dos instrumentos legais relacionados está elencada no item I desta Norma Interna. A página eletrônica do Ministério da Agricultura na rede mundial de computadores também disponibiliza ao público em geral a legislação relativa a cada programa sanitário, na aba “planos e programas”.
¶ 2. NORMAS PARA EMISSÃO DO CIS-E.
¶ 2.1 NORMAS GERAIS
A emissão do CIS-E para subprodutos de origem animal pode ser realizada pelos seguintes profissionais:
I. médico veterinário responsável técnico, em estabelecimentos que comercializam subprodutos de origem animal;
II. médico veterinário oficial ou funcionário autorizado do órgão executor de sanidade animal ou da Superintendência Federal de Agricultura;
III. médico veterinário oficial em estabelecimentos sob inspeção municipal ou estadual, nos casos em que não haja documento equivalente emitido pelo serviço veterinário municipal ou estadual.
Os médicos veterinários responsáveis técnicos dos estabelecimentos que comercializam subprodutos de origem animal apenas estarão aptos a emitir o CIS-E após treinamento específico e publicação de Portaria de credenciamento pela respectiva Superintendência Federal de Agricultura.
Os estabelecimentos que manipulam e comercializam subprodutos de origem animal destinados a fins industriais deverão estar cadastrados junto ao serviço veterinário oficial estadual, a fim de que possam estar aptos à emissão do CIS-E. O mesmo deverá ser expedido com base nos registros sobre o estabelecimento de procedência dos subprodutos de origem animal e nos processamentos a que estes foram submetidos.
A impressão dos formulários do CIS-E pelos órgãos executores de defesa sanitária animal nas Unidades Federativas somente poderá ocorrer mediante o fornecimento e controle, por parte da CGTQA/DSA, da numeração das guias a serem produzidas.
Será permitida a expedição do CIS-E empregando-se código de barras, bem como sua emissão por meio de assinatura eletrônica, conforme os procedimentos e padrões a serem estabelecidos pela Secretaria de Defesa Agropecuária – SDA/MAPA.
Em todas as vias do CIS-E, deverão constar data, carimbo, identificação e assinatura do emitente.
Os carimbos de identificação dos responsáveis pela expedição do CIS-E obedecerão às seguintes características, segundo condição do emitente, devendo ser apostos nos documentos empregando-se a cor azul:
I - carimbo do Auditor Fiscal Federal Agropecuário:
A) nome do Auditor Fiscal Federal Agropecuário: fonte tipo Arial Narrow tamanho 12, em negrito;
B) formação profissional: Médico Veterinário: fonte tipo Arial Narrow tamanho 11;
C) número da Carteira de Identificação Fiscal: fonte tipo Arial Narrow tamanho 11;
D) número de registro no CRMV: fonte tipo Arial Narrow tamanho 11.
II - carimbo do Médico Veterinário dos órgãos executores de defesa sanitária animal:
A) nome do Médico Veterinário: fonte tipo Arial Narrow tamanho 12, em negrito;
B) formação profissional: Médico Veterinário: fonte tipo Arial Narrow tamanho 11;
C) número de controle junto ao órgão oficial de defesa sanitária animal: fonte tipo Arial Narrow tamanho 11;
D) número de registro no CRMV: fonte tipo Arial Narrow tamanho 11.
III - carimbo de outros funcionários autorizados dos órgãos estaduais de defesa sanitária animal:
A) nome do Funcionário Autorizado: fonte tipo Arial Narrow tamanho 12, em negrito;
B) número de controle junto ao órgão oficial de defesa sanitária animal: fonte tipo Arial Narrow tamanho 11;
C) função no escritório de atendimento à comunidade: fonte tipo Arial Narrow tamanho 11.
IV - identificação do Médico Veterinário Credenciado:
A) nome do Médico Veterinário: fonte tipo Arial Narrow tamanho 12, em negrito;
B) formação profissional: Médico Veterinário: fonte tipo Arial Narrow tamanho 11;
C) número do ato legal de credenciamento junto ao órgão oficial de defesa sanitária animal: fonte tipo Arial Narrow tamanho 11;
D) número de registro no CRMV: fonte tipo Arial Narrow tamanho 11.
¶ 2.2. INSTRUÇÕES DE PREENCHIMENTO
CAMPO 01 – CERTIFICADO
Itens 01 e 02 – Série e número que identificam o documento.
CAMPO 02 – CÓDIGO DO MUNICÍPIO
Item 03 – Escrever o código IBGE do município de procedência dos subprodutos.
Item 04 – Escrever o código IBGE do município de destino dos subprodutos.
CAMPO 03 – ARQUIVAMENTO
Não preencher.
CAMPO 04 - IDENTIFICAÇÃO
Item 05 – Descrever o subproduto a ser transportado, de maneira sucinta, mas suficiente para caracterizar a carga. Ex.: pele ovina salgada, crina equina, ovos claros de galinha, etc.
CAMPO 05 - TRANSPORTE
Item 06 – Colocar um “X” na quadrícula correspondente ao meio de transporte a ser utilizado. Quando utilizado mais de um meio de transporte, colocar um “X” nas quadrículas correspondentes aos meios utilizados e um “X” na quadrícula correspondente a “misto”.
CAMPO 06 - CARACTERÍSTICAS
Item 07 – Quantidade: usar, de acordo com cada caso, a unidade: fardo, caixa, volume, etc.
Escrever os algarismos e o número por extenso entre parênteses.
Item 08 – Marca: nome da empresa de onde procedem os subprodutos.
Item 09 – Peso: usar o quilograma como unidade. Usar somente algarismos.
Item 10 – Valor: escrever em reais. Usar somente algarismos.
CAMPO 07 – PROCEDÊNCIA
Item 11 – Escrever o nome completo da empresa ou proprietário de origem dos subprodutos.
Item 12 – Escrever o endereço da empresa ou do proprietário de origem dos subprodutos.
Item 13 – Escrever o nome completo do município onde está localizada a empresa ou propriedade de origem dos subprodutos, de acordo com a base de municípios do IBGE. Atenção, não empregar nomes de distritos, bairros, vilas ou outras localidades do município.
Item 14 – Escrever a sigla, com letras maiúsculas, da Unidade da Federação (Estado ou Distrito Federal) onde se localiza o município citado no campo acima.
CAMPO 08 - DESTINO
Item 15 – Escrever o nome completo da empresa para onde se destinam os subprodutos ou o nome do destinatário.
Item 16 – Escrever o endereço da empresa ou da propriedade de destino dos subprodutos.
Item 17 – Escrever o nome completo do município onde está localizada a empresa ou propriedade de destino dos subprodutos, de acordo com a base de municípios do IBGE. Atenção, não empregar nomes de distritos, bairros, vilas ou outras localidades do município.
Item 18 – Escrever a sigla, com letras maiúsculas, da Unidade da Federação (Estado ou Distrito Federal) onde se localiza o município citado no campo acima.
CAMPO 09 – OBSERVAÇÕES
Campo destinado a qualquer informação complementar ou observação pertinente ao cumprimento das regras de trânsito. Deve ser utilizado principalmente para a descrição dos tratamentos aos quais os subprodutos foram submetidos, em especial quando tais tratamentos estiverem previstos na legislação vigente. A descrição deve ser dotada de detalhamento suficiente para explicitar o nível de garantia sanitária oferecida pelo tratamento, conforme instruções contidas no item V deste Manual.
Este campo também pode ser utilizado para transcrição de número de lacre (quando exigido pelo serviço veterinário oficial), informações referentes à finalidade do subproduto (quando houver relevância), declaração da origem dos animais dos quais se derivam os subprodutos (quando assim definido pelo serviço veterinário oficial) e qualquer outra informação adicional sanitariamente relevante.
CAMPO 10 – CERTIFICADO
Os subprodutos especificados no CIS-E devem ser examinados nas 72 horas que antecedem o embarque, a fim de que seja verificado seu estado de conservação. O certificado já está impresso.
Item 19 – Escrever o nome do município e a sigla da Unidade Federativa onde foi emitido o certificado.
Item 20 – Escrever a data de emissão do certificado, indicando o dia, mês e ano, usando dois algarismos para o dia e o mês e quatro para o ano (por exemplo: 06/10/2009).
Item 21 – Escrever a data em que expira a validade do certificado, indicando dia, mês e ano, usando dois algarismos para o dia e o mês e quatro para o ano. A validade do certificado fica a critério do emitente, considerando a distância a ser percorrida, o meio de transporte a ser utilizado e outras informações pertinentes ao tempo de percurso do trânsito dos subprodutos.
Item 22 – Usar carimbo do Médico Veterinário emitente, no modelo descrito nesta Norma Interna.
OBSERVAÇÕES:
As vias do certificado terão a seguinte destinação:
1ª via – acompanha os subprodutos até o destino.
2ª via – é enviada à Unidade Veterinária Local onde o estabelecimento de destino é cadastrado. Caso o estabelecimento não tenha cadastro, essa via deve ser encaminhada à sede do serviço veterinário oficial estadual.
3ª via – emitente (arquivo).
É facultada a adoção de mais de três vias de CIS-E.
Segue exemplo fictício de CIS-E preenchido:
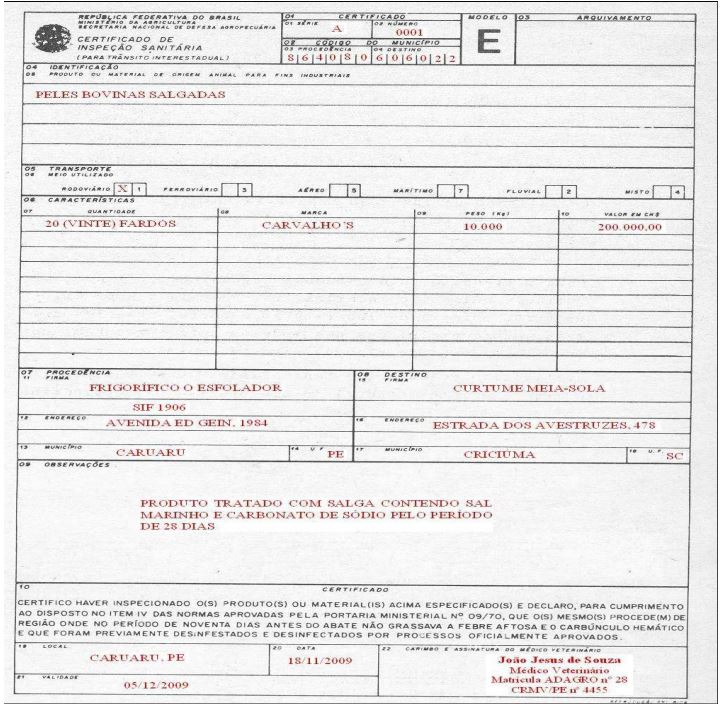
¶ 3. NORMAS PARA CREDENCIAMENTO DE MÉDICOS VETERINÁRIOS SEM VÍNCULO COM O SERVIÇO OFICIAL PARA EMISSÃO DE CIS-E.
A aceitação pelo MAPA de CIS-E firmado por médico veterinário não vinculado ao serviço oficial de Defesa Sanitária Animal é regulada pelo disposto nesta Norma Interna e nos demais dispositivos legais relativos à Defesa Sanitária Animal, cabendo ao Departamento de Saúde Animal - DSA, às Superintendências Federais de Agricultura – SFAs e aos Órgãos Executores de Defesa Sanitária Animal nas Unidades Federativas promover e fiscalizar a execução dessas medidas. O CIS-E só terá validade quando expedido em formulário aprovado pelo MAPA.
O credenciamento será concedido a médicos veterinários não-vinculados ao serviço oficial de Defesa Sanitária Animal, em unidades administrativas em que não existam ou sejam em número insuficiente os médicos veterinários ou funcionários autorizados dos órgãos oficiais de Defesa Sanitária Animal.
A emissão do CIS-E fica condicionada à assistência veterinária aos estabelecimentos de onde se originam os subprodutos, aos registros do estabelecimento de procedência e ao cumprimento das exigências de ordem sanitária estabelecidas para cada subproduto.
Somente poderão emitir CIS-E os médicos veterinários previamente credenciados pela SFA de seu estado de atuação, por meio de Portaria publicada no Boletim de Pessoal da SFA correspondente, desde que atendidas as seguintes exigências:
I - solicitação de credenciamento pelo interessado, dirigida ao Superintendente Federal de Agricultura da respectiva UF, entregue no escritório de atendimento à comunidade do serviço de Defesa Sanitária Animal da Unidade Federativa onde pretende atuar;
II - preenchimento de ficha cadastral, em modelo próprio;
III - parecer do Órgão Executor da Defesa Sanitária Animal da Unidade Federativa;
IV - documento expedido pelo Conselho Regional de Medicina Veterinária da Unidade Federativa de atuação, declarando que o profissional está devidamente inscrito;
V - participação do interessado em treinamentos especializados, quando convocado pelo MAPA.
O médico veterinário credenciado só poderá emitir CIS-E nos municípios especificados em Portaria expedida pela SFA. Ele também se tornará obrigado a atender às convocações da SFA. As SFAs ficarão responsáveis pela manutenção de cadastro atualizado dos profissionais credenciados por município, conforme Portaria expedida. Essa lista deverá ser disponibilizada aos Órgãos Executores de Defesa Sanitária Animal nas UFs e ao Departamento de Saúde Animal, para elaboração de um cadastro nacional.
O médico veterinário terá seu credenciamento cancelado pela SFA, quando:
I - infringir o disposto nesta Norma Interna, ou qualquer das demais disposições legais e regulamentares atinentes à Defesa Sanitária Animal;
II - praticar ato que, a juízo da SFA, seja incompatível com o objeto do credenciamento;
III - deixar de prestar as informações obrigatórias ou solicitadas pela SFA, nos prazos estipulados;
IV - sem justa causa, não comparecer às convocações da SFA;
Independentemente do disposto nos itens acima, a autorização de que trata este Manual poderá ser cancelada, a qualquer tempo, a juízo exclusivo da autoridade competente. O médico veterinário somente poderá requerer novo credenciamento depois de decorrido um ano do cancelamento e, a critério do serviço oficial, poderá ou não ser concedido, considerando principalmente a irregularidade cometida. As despesas decorrentes da indenização dos trabalhos profissionais necessários à expedição dos CIS-E em nenhum caso poderão acarretar ônus aos cofres públicos, correndo às expensas dos interessados.
¶ 4. RISCO SANITÁRIO DO TRÂNSITO DE SUBPRODUTOS DE ORIGEM ANIMAL
O trânsito de subprodutos de origem animal é um dos fatores de maior risco na propagação de doenças de impacto à pecuária nacional. A minimização de tal risco pode envolver diversas estratégias, como o controle do status sanitário da origem, controle da utilização e destino final do subproduto ou aplicação de tratamentos de natureza física, química ou biológica, que inativem ou inviabilizem os agentes etiológicos das doenças animais de controle oficial. A respeito desse último ponto, cabe ressaltar que diversos são os processamentos a que podem ser submetidos os subprodutos de origem animal – sendo alguns de aplicação rotineira na indústria, e, outros, procedimentos específicos que visam à inativação de micro-organismos.
Uma vez que a aplicação desses tratamentos é o método mais comum de controle sanitário, torna-se importante conhecê-los, ao menos em sua essência, a fim de saber julgar seu alcance e eficácia. Alguns exemplos a seguir descrevem os principais processamentos utilizados para subprodutos de origem animal:
¶ 4.1 Peles e couros
Define-se pele como o órgão de revestimento dos animais, separada da carcaça durante as operações de esfola. O couro, por sua vez, é o produto resultante do curtimento da pele. Ambos sofrem diversos tipos de tratamento durante as etapas de industrialização a que são submetidos. Seguem destacados os mais importantes:
¶ 4.1.1 Processamento industrial
¶ 4.1.1.1 Salga
Realizada preferencialmente entre 3 e 4 horas após o abate, estende-se em geral pelo período mínimo de vinte e quatro horas. Baseia-se na desidratação como método de controle de ações enzimáticas e de crescimento bacteriano. Utiliza-se cloreto de sódio com 98% de pureza mínima, na proporção de, no máximo, 50% do peso das peles.
Eficiência no controle sanitário: inibe crescimento bacteriano, mas por si só é ineficiente para a inativação de agentes de doenças de controle oficial.
¶ 4.1.1.2 Piquelagem
Consiste em submeter a pele a tratamento em solução ácida, conhecida como píquel. Tem por objetivo preparar as fibras colágenas para uma fácil penetração dos agentes curtentes. O píquel é realizado com 6 a 10% de cloreto de sódio, 1 a 1.5% de ácido sulfúrico e 60 a 100% de água. Em alguns casos também são adicionados 0.5 a 1% de ácido fórmico. Previamente à execução da piquelagem, as peles devem ser tratadas com solução salina.
Eficiência no controle sanitário: devido ao baixo pH a que as peles são submetidas durante essa etapa (no mínimo 3, por período não inferior a 6 horas), a piquelagem é considerada eficiente para a inativação de patógenos sensíveis a meios ácidos, como o vírus da febre aftosa.
¶ 1.1.3 Curtimento
É a operação central de todo o processamento industrial, em que o reagente curtente interage com o colágeno da pele, fixando-se na forma de um complexo com diversas cadeias de aminoácidos. Essa reação confere à pele um caráter imputrescível, gerando as propriedades adequadas à sua posterior utilização, e transformando-a em couro. Os agentes curtentes utilizados podem ser de origem mineral (cromo, por exemplo) ou vegetal (tanino, por exemplo). A coloração e consistência dos diversos couros obtidos pelos diferentes agentes curtentes definem a nomenclatura do produto final. Assim, couros curtidos ao cromo são conhecidos como “wet-blue”, ao passo que couros curtidos com curtentes vegetais podem variar em uma escala de cores que se estende do branco ao marrom, recebendo o nome de “wetwhite” ou “wet-brown”, em decorrência da tonalidade em que se enquadrem.
Eficiência no controle sanitário: A transformação de colágenos em fibras imputrescíveis inviabiliza o desenvolvimento e sobrevivência de agentes etiológicos das doenças que afetam os animais.
¶ 1.1.4 Pré-acabamento
Envolve a secagem, recondicionamento e amaciamento. O resultado final é o couro semiacabado, também conhecido como crust.
¶ 1.1.5 Acabamento
Envolve diversas etapas, desde a impregnação até a prensagem. O resultado final é o couro acabado, pronto para uso industrial.
¶ 4.1.2 Processamentos específicos para inativação de agentes:
¶ 4.1.2.1 Salga com sal marinho e carbonato de sódio
Realizada com sal marinho e carbonato de sódio a 2%, tem a duração de 28 dias, ou outra estabelecida pela legislação vigente, e objetiva a elevação do pH a valores acima de 9, o que garante a inativação do vírus da febre aftosa.
¶ 4.1.2.2 Armazenamento
O armazenamento de peles por quarenta dias garante a inviabilização do agente etiológico da dermatose nodular contagiosa, doença exótica no Brasil.
¶ 4.2 Farinhas
As farinhas de origem animal são o produto resultante da trituração e cocção de despojos não comestíveis obtidos da carcaça de animais de açougue.
¶ 4.2.1 Processamento industrial
¶ 4.2.1.1 Produção de despojos de não ruminantes
Os despojos não comestíveis de animais de açougue abatidos são encaminhados à graxaria, onde passam por diversos processamentos, em geral na seguinte sequência:
FRAGMENTAÇÃO → COZIMENTO → PERCOLAÇÃO → PRENSAGEM → MOAGEM → PENEIRAMENTO
Ao final dos processamentos, o produto terá sido submetido, em média, a temperaturas acima de 110ºC, por tempo superior a uma hora.
Eficiência no controle sanitário: o tratamento descrito é suficiente para inativar a maioria dos agentes etiológicos das doenças de controle oficial, com exceção dos príons.
¶ 4.2.2 Processamentos específicos para inativação de agentes
¶ 4.2.2.1. Produção de despojos de ruminantes
Os despojos de ruminantes passam por processamento semelhante aos de não ruminantes, atingindo, entretanto, temperaturas superiores a 133º C, sob 3 bars de pressão, pelo tempo mínimo de 20 minutos, conforme preconizado pela Instrução Normativa nº 34, de 28 de maio de 2008. Ao contrário do que ocorre com as peles, as farinhas são sempre processadas em um único estabelecimento, desde sua fragmentação até o peneiramento.
Eficiência no controle sanitário: a esterilização descrita diminui em até 1000 vezes a infectividade de príons
¶ 4.3 Gorduras
Gorduras podem ser obtidas da carcaça de animais ou no processamento de seus despojos, quando ocorre a separação da fase gordurosa durante a produção de farinhas.
¶ 4.3.1 Processamento industrial
Quando obtida da separação da fase gordurosa durante a produção de farinhas, a gordura sofre tratamento semelhante ao da própria farinha, sendo submetida a temperaturas acima de 110ºC, por tempo superior a uma hora.
Eficiência no controle sanitário: o tratamento descrito é suficiente para inativar a maioria dos agentes etiológicos das doenças de controle oficial, com exceção dos príons.
Quando obtidas diretamente das carcaças, as gorduras podem sofrer tratamentos posteriores, que variam de acordo com sua natureza quanto à eficiência na inativação de patógenos.
¶ 4.3.2 Processamentos específicos para a inativação de agentes
Gorduras desproteinadas (com teor máximo de impurezas insolúveis correspondentes a, no máximo, 0.15% do peso) são consideradas materiais que não apresentam risco de transmissão do príon da encefalopatia espongiforme bovina, doença exótica no Brasil.
¶ 4.4 Lã
¶ 4.4.1 Processamento industrial
¶ 4.4.1.1 Lã bruta
Após a tosquia, a lã é enviada a estabelecimento transformador, onde é selecionada e submetida ao processo de lavagem industrial. Tal lavagem é geralmente realizada com uso de sabões ou detergentes, enquanto a lã é imersa em água a temperaturas acima de 60ºC por algumas horas. Nessa etapa, ocorre a separação da suarda (produto das secreções sudoríparas e sebáceas que se aderem ao pelo), da qual se obtém a lanolina. Eficiência no controle sanitário: a lavagem industrial é considerada suficiente para inativar os agentes etiológicos das doenças transmitidas pela lã.
¶ 4.4.1.2 Lã cardada e penteada
Após a lavagem, a lã é cardada e penteada. Esses processos consistem em passar as lãs limpas e secas através de um sistema de rolos de fio para aprumar as fibras e para remover toda a matéria vegetal restante, sendo o tecido resultante desse procedimento posteriormente escovado. Essas operações apenas são possíveis após a lavagem industrial, de modo que a lã cardada e penteada, geralmente comercializada “em tops”, pode ser considerada um produto seguro do ponto de vista sanitário.
¶ 4.4.2 Processamentos específicos para inativação de agentes
Pode-se submeter a lã a um dos processamentos abaixo, a fim de mitigar o risco de transmissão de enfermidades:
- Armazenamento da lã a 4° C por 4 meses, ou a 18° C por 4 semanas, ou a 37° C por 8 dias;
- Depilação química com leite de cal (hidróxido de cálcio) ou sulfito de sódio;
- Fumigação com formaldeído em um local hermeticamente fechado durante, pelo menos, 24 horas. Eficiência no controle sanitário: os tratamentos descritos são considerados suficientes para inativar os agentes etiológicos das doenças transmitidas pela lã.
¶ 4.5 Cascos, chifres e cornos
¶ 4.5.1. Processamento industrial
Cascos, chifres e cornos podem sofrer diversos tipos de tratamentos, de acordo com a finalidade a que serão destinados. Muitas vezes são adicionados a outros despojos para posterior produção de farinhas.
¶ 4.5.2. Processamentos específicos para inativação de agentes
Quando destinados à confecção de troféus de caça, chifres e cornos devem passar pelo seguinte tratamento com vistas à mitigação do risco de transmissão de enfermidades:
a) imersão em água fervente durante tempo suficiente para garantir a remoção de todas as matérias, exceto ossos, cornos, cascos, garras, galhadas ou dentes, com subsequente desinfecção e sujeição do troféu, antes do tratamento taxidermal completo, a um dos seguintes processos:
a.1) irradiação gama em uma dose de pelo menos 20 kiloGray na temperatura de 20°C ou mais elevado;
ou
a.2) embebição, sob agitação, em uma solução de 4% de carbonato de sódio - Na2CO3 mantida em pH 11,5 ou acima, por pelo menos 48 horas;
ou
a.3) embebição, sob agitação, em uma solução de ácido fórmico (100 quilogramas de sal [NaCl] e 12 quilogramas de ácido fórmico por 1.000 litros de água) mantida abaixo de pH 3,0 por pelo menos 48 horas.
Eficiência no controle sanitário: os tratamentos descritos são considerados suficientes para inativar os agentes etiológicos das doenças transmitidas pelos produtos em questão.
¶ 4.6 Pelos, cerdas e crinas
¶ 4.6.1. Processamentos específicos para inativação de agentes
Embora pelos, cerdas e crinas possam passar por diversos tratamentos com vistas à sua conservação, a OIE recomenda especificamente os seguintes processamentos para inativação do vírus da febre aftosa:
¶ 4.6.1.1. Procedimentos para a inativação do vírus da febre aftosa em pelos
Para inativar os vírus presentes em pelos destinados a uso industrial, pode-se utilizar um dos seguintes procedimentos:
1. lavagem industrial, que consiste em submergir os pelos em uma serie de banhos à base de água, sabão e hidróxido de sódio ou potássio, ou em detergente hidrossolúvel mantido entre 60 e 70ºC de temperatura;
2. depilação química com hidróxido de cálcio ou sulfito de sódio;
3. fumigação com formaldeído em um local hermeticamente fechado, durante, pelo menos, 24 horas. O procedimento mais prático consiste em verter em recipientes - que não sejam de plástico nem de polietileno - permanganato de potássio e acrescentar formol comercial; as quantidades de formol e de permanganato de potássio são de 53 ml e 35 g, respectivamente, por metro cúbico de local;
4. armazenamento dos pelos a 4°C durante quatro mes es, ou a 18ºC durante quatro semanas, ou a 37°C durante oito dias
¶ 4.6.1.2 Procedimentos para a inativação do vírus da febre aftosa em crinas e cerdas
Para inativar os vírus presentes nas crinas e cerdas destinadas a uso industrial, pode-se utilizar um dos seguintes procedimentos:
1. ebulição durante, pelo menos, uma hora;
2. imersão, durante pelo menos 24 horas, em uma solução de formaldeído a 1%, preparada mediante a diluição de 30 ml de formol comercial em um litro de água
¶ 4.7 Sangues e derivados
¶ 4.7.1 Processamento industrial
O sangue obtido em matadouros-frigoríficos pode ser destinado à obtenção de farinha de sangue, forma sob a qual geralmente é aproveitado para uso em alimentação animal ou como matéria-prima para produção de fertilizantes. Pode-se produzir farinhas de sangue integral, de plasma ou de hemácias, de acordo com a finalidade pretendida.
Existem vários métodos para a produção de farinha de sangue. Atualmente, são bastante utilizadas as técnicas conhecidas como “flash drying” e “spray drying”. A primeira consiste em desidratar parcialmente o sangue por processo mecânico, ou condensá-lo por cocção até um estado semi-sólido, quando então é transferido para um secador rápido para remover a umidade restante. A segunda resulta da evaporação em baixa temperatura, sob vácuo, e posterior passagem na forma de spray sob ar quente até a obtenção do produto final.
Independentemente do método utilizado, as farinhas produzidas atingem, com freqüência, temperaturas acima de 110º C em seu processamento. A farinha produzida por “spray drying”, por exemplo, alcança nas máquinas de secagem as seguintes temperaturas, de acordo com sua composição:
- Sangue integral ou hemoglobina: temperatura de entrada: 350°C / temperatura de saída: 90°C;
- Plasma: temperatura de entrada: 220°C / temperatura de saída: 80°C
Eficiência no controle sanitário: os métodos de produção de farinha, incluindo o “flash drying” e o “spray drying”, são considerados suficientes para inativar os agentes etiológicos das doenças transmitidas pelo sangue.
¶ 4.7.2. Processamentos específicos para inativação de agentes
O sangue de ruminantes pode sofrer processamento semelhante às demais farinhas de origem animal, mas a legislação brasileira atual o dispensa, por meio da Instrução Normativa nº 34, de 28 de maio de 2008, da esterilização a 133ºC por 20 minutos sob 3 bars de pressão.
¶ 4.8 Ovos
Ovos não fecundados (chamados de “ovos claros”) são destinados muitas vezes ao uso industrial, inclusive para a produção de alimentos para animais.
O trânsito de ovos incubados descartados, deve estar acompanhado de documento definido em legislação específica, quando da ocorrência de doenças de controle do Programa Nacional de Sanidade Avícola.
Parágrafo único. Quando a propriedade estiver sob restrição de movimentação, devido a ocorrência de caso suspeito, provável ou confirmado de Influenza aviária (IA) e doença de Newcastle (DNC), o trânsito especificado no caput fica condicionado à autorização do serviço veterinário oficial." (NR)
¶ 4.8.1. Processamentos específicos para inativação de agentes
Segundo a OIE, os seguintes tratamentos térmicos são eficientes para a inativação dos vírus da influenza aviária e da doença de Newcastle em ovos e seus produtos:
| Temperatura (ºC) | Tempo | |
| Ovo inteiro | 55 | 2.521 segundos |
| Ovo inteiro | 57 | 1.596 segundos |
| Ovo inteiro | 59 | 674 segundos |
| Clara de ovo líquida | 55 | 2.278 segundo |
| Clara de ovo líquida | 57 | 986 segundos |
| Clara de ovo líquida | 59 | 301 segundos |
| Gema salgada a 10% | 55 | 176 segundos |
| Clara de ovo seca | 57 | 50,4 horas |
¶ 4.9 Bílis
¶ 4.9.1 Processamento industrial
A bílis pode ser comercializada concentrada ou in natura. Entende-se por "bílis concentrada", segundo o RIISPOA, “o subproduto resultante da evaporação parcial da bile fresca”, devendo conter, no máximo, “25% (vinte e cinco por cento) de umidade e no mínimo 40% (quarenta por cento) de ácidos biliares totais”. Para se obter tal produto, é necessário aquecer a bílis in natura por temperaturas superiores a 100º C por várias horas.
Eficiência no controle sanitário: a evaporação parcial é considerada suficiente para inativar os agentes etiológicos das doenças transmitidas pela bílis.
¶ 4.10 Penas e plumas
As penas constituem o revestimento exterior das aves. São impermeáveis, dotadas de um eixo tubular central e possibilitam a realização do voo. As plumas, por sua vez, situam-se sob as penas, na forma de pequenos chumaços entrelaçados. São responsáveis pelo isolamento térmico do animal, devido à sua capacidade de reter calor em minúsculas bolsas de ar.
Ambas constituem materiais de grande risco para a transmissão de doenças. Podem ser utilizadas para a produção de farinha de penas ou serem comercializadas in natura.
¶ 4.10.1 Processamentos específicos para inativação de agentes
Segundo a OIE, quando destinadas à produção de farinhas, as penas e plumas devem ser submetidas a um dos seguintes tratamentos para inativação dos vírus da influenza aviária e da doença de Newcastle:
- calor úmido com uma temperatura mínima de 118° C, durante pelo menos 40 minutos,
ou
- processo de hidrólise contínua sob pressão de vapor de, pelo menos, 3.79 bars a uma temperatura mínima de 122° C durante, pelo menos, 15 minutos. Para inativação dos vírus da influenza Aviária e da doença de Newcastle, também é considerado eficiente pelo Departamento de Saúde Animal o processo de fumigação, utilizando-se mistura de formalina (formaldeído a 40%) com cristais de permanganato de potássio, na proporção de 45 ml de formalina para 30g de permanganato de potássio por metro cúbico, a uma temperatura não inferior a 21ºC e umidade mínima de 50%, por 10 horas, em um container hermeticamente fechado.
¶ 4.11 Cama de aviário
A cama de aviário é um resíduo da avicultura composto pelo substrato da cama, fezes, restos de ração, urina e penas. Seu uso é proibido na alimentação de ruminantes, segundo a Instrução Normativa nº 8, de 25 de março de 2004.
O trânsito de esterco, cama de aviário e demais resíduos da incubação e de animais mortos deve estar acompanhado de documento definido em legislação específica, quando da ocorrência de doenças de controle do Programa Nacional de Sanidade Avícola.
Parágrafo único. Quando a propriedade estiver sob restrição de movimentação, devido a ocorrência de caso suspeito, provável ou confirmado de Influenza aviária (IA) e doença de Newcastle (DNC), o trânsito especificado no caput fica condicionado à autorização do serviço veterinário oficial." (NR)
¶ 4.12 Ossos
¶ 4.12.1. Processamento industrial
Ossos obtidos em matadouros ou açougues podem ser enviados a graxarias para a produção de farinhas. Existem dois tipos de farinha de ossos: a autoclavada e a calcinada. A primeira é obtida a partir de ossos não decompostos, submetidos a tratamento térmico em autoclave, secados e moídos. A segunda, por sua vez, é derivada de ossos submetidos à moagem e à calcinação (tratamento térmico a temperaturas superiores a 500 ºC).
O uso de farinhas autoclavadas na alimentação de ruminantes é proibido no Brasil pela Instrução Normativa nº 8, de 25 de março de 2004. O mesmo instrumento legal autoriza, por outro lado, a utilização de farinhas de ossos calcinados para o mesmo fim.
Eficiência no controle sanitário: a autoclavagem é suficiente para inativar a maioria dos agentes etiológicos das doenças de controle oficial, com exceção dos príons. A calcinação, por sua vez, é considerada suficiente para mitigar o risco de transmissão de príons.
¶ Base legal e documentos de referência
- Decreto nº 24.548, de 03 de julho de 1934;
- Decreto nº 5.741, de 30 de março de 2006;
- Portaria Nº 51, de 19 de dezembro de 1977;
- Portaria Nº 9, de 08 de janeiro de 1970;
- Decreto nº 818, de 5 de setembro de 1969;
- Portaria 300, de 16 de junho de 2005;
- Instrução Normativa nº 34, de 28 de maio de 2008;
- Instrução de Serviço nº 02, de 15 de dezembro de 1999;
- Instrução Normativa nº 48, de 14 de julho de 2020;
- Instrução Normativa Nº 17, de 07 de abril de 2006;
- Instrução Normativa Nº 6, de 09 de março de 2004; e
- Instrução Normativa Nº 01, de 04 de janeiro de 2001.
¶ Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ Histórico de revisão
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1.0 |
|
11/2009 | - |
| 2.0 |
|
12/2021 |
Transcrição do manual para o modelo de manualização validado pela SDA no Projeto de elaboração do modelo de manualização da SDA. |
|
3.0 |
Foi alterado o item 4.11 Cama de aviário. | 04/2022 | Adequação a portaria Nº 565, DE 20 DE ABRIL DE 2022. |