¶ Folha de rosto
© 2022 Ministério da Agricultura, Pecuária e Abastecimento. Todos os direitos reservados. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Elaboração, distribuição, informações:
Ministério da Agricultura, Pecuária e Abastecimento
Secretaria de Defesa Agropecuária - SDA
Departamento de Saúde Animal - DSA
Coordenação Geral de Sanidade Animal - CGSA
Coordenação de Animais Terrestres - CAT
Divisão de Sanidade das Aves - DISAV
Coordenação Geral de Planejamento e Avaliação Zoossanitária - CGPZ
Esplanada dos Ministérios - Bloco D - Anexo A - Sala 322
Brasília-DF CEP: 70.043 900
Tel.: +55 (61) 3218-2782/2780
e-mail: pnsa@agro.gov.br
https://www.gov.br/agricultura/pt-br/assuntos/sanidade-animal-e-vegetal/saude-animal/programas-de-saude-animal/pnsa/programa-nacional-de-sanidade-avicola-pnsa
Equipe Técnica: Ronaldo Carneiro Teixeira, Daniela de Queiroz Baptista, Bruno Rebelo Pessamilio,, Thiago Luiz Mendes Arcebispo, Eduardo de Azevedo Pedrosa Cunha, Taís Oltramari Barnasque
Colaboradores: Manuel Jose Sanchez Vazquez (Panaftosa), Lia Puppim Buzanovsky (Panaftosa), Daniel Magalhães Lima (Panaftosa); Patrícia Pereira Serafin (ICMBio).
¶ Folha resumo
|
Macroprocesso: 22 - Prevenção, controle e erradicação de doenças e pragas |
Objetivo: O objetivo geral deste manual é apresentar o Plano de Vigilância para Influenza Aviária e Doença de Newcastle, provendo uma base de referência sobre as ações a serem executadas para prevenir a introdução e impedir a disseminação dos agentes dessas doenças no plantel avícola nacional, sendo os objetivos específicos: 1) detecção precoce de casos IA e DNC nas populações de aves domésticas e silvestres 2) demonstração de ausência de IA e DNC na avicultura industrial de acordo com as diretrizes internacionais de vigilância para fins de comércio. 3) monitorar a ocorrência de cepas virais da IA para subsidiar estratégias de saúde pública e saúde animal |
|||
|
Processo: 22.04 - Regulamentar as ações de saúde animal e sanidade vegetal |
||||
|
Entrega: Sanidade dos animais e das plantas |
Público alvo e demais interessados: Todos os envolvidos na criação, manejo, transporte, produção, fiscalização, inspeção, diagnóstico, ensino, pesquisa e cuidados com as aves, entre outras atividades, são considerados partes interessadas no Plano de vigilância de IA e DNC, com responsabilidades na execução de partes das atribuições da vigilância |
Versão do documento: 1.0 |
||
|
Setor responsável e responsabilidades A gestão desse manual está sob a responsabilidade do Departamento de Saúde Animal (DSA) que prestará auxílio ao público alvo leitor dúvidas e/ou sugestões quanto à aplicação deste manual devem ser submetidas ao Departamento responsável. |
||||
¶ Definições e conceitos
DNC: Doença de Newcastle
DSA: Departamento de Saúde Animal
ELISA: Ensaio imunoenzimático
e-Sisbravet: Ferramenta eletrônica do Sistema Brasileiro de Vigilância e Emergências Veterinárias
IA: Influenza aviária
MAPA: Ministério da Agricultura, Pecuária e Abastecimento
MVO: Médico Veterinário Oficial
OESA: Órgão Executor de Sanidade Agropecuária
OMSA: Organização Mundial de Saúde Animal
PCR: Reação em cadeia da polimerase
PNSA: Programa Nacional de Sanidade das Aves
SDA: Secretaria de Defesa Agropecuária
SIGEP: Sistema de Gerenciamento de Estudos Epidemiológicos
SVE: Serviço veterinário estadual de saúde animal
SVO: Serviço Veterinário Oficial
SRN: Síndrome Respiratória e Nervosa das Aves
AGID: imunodifusão em gel de ágar
IAV: vírus influenza A
ELISA: ensaio enzimático imunoadsorvido
HI: inibição de hemaglutinação
ICPI: índice de patogenicidade intracerebral
IVPI: índice de patogenicidade intravenosa
NDV: vírus da doença de Newcastle
NDV-F: gene F do vírus da doença de Newcastle
NDV-M: gene M do vírus da doença de Newcastle
NI: inibição da neuraminidase
RT-qPCR: reação da transcriptase reversa seguida de reação em cadeia da polimerase em tempo real
¶ Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário pela Coordenação de Animais Terrestres (CAT) do Departamento de Saúde Animal (DSA) e aprovada pela Secretaria de Defesa Agropecuária (SDA).
A gestão desse manual está sob a responsabilidade do Departamento de Saúde Animal (DSA) que prestará auxílio ao público alvo leitor dúvidas e/ou sugestões quanto à aplicação deste manual devem ser submetidas ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da SDA para acesso pelo público alvo será de responsabilidade da Secretaria representada pelo Departamento de Saúde Animal (DSA).
¶ Objetivo
A vigilância de IA e DNC no Brasil tem os seguintes objetivos:
Objetivo 1: detecção precoce de casos IA e DNC nas populações de aves domésticas e silvestres
É o principal objetivo da vigilância de doenças ausentes (erradicadas ou exóticas) no país, permite a pronta reação, erradicação e restituição da condição de livre. A detecção precoce de casos suspeitos de IA e DNC somente é possível com o fortalecimento da vigilância passiva, que se baseia na notificação obrigatória imediata de casos suspeitos, para rápida investigação pelo serviço oficial de saúde animal, que deverá coordenar a aplicação das medidas para diagnóstico, contenção e erradicação previstos no Planos de Contingência.
Objetivo 2: demonstração de ausência de IA e DNC na avicultura industrial de acordo com as diretrizes internacionais de vigilância para fins de comércio.
A demonstração da ausência de IA e DNC por meio do sistema de vigilância ativa dá suporte e permite a certificação da condição sanitária de livre dessas doenças nas populações alvo da vigilância, perante a OMSA e os parceiros comerciais.
Esse objetivo é atendido principalmente por meio dos componentes de vigilância ativa, com a realização de estudos epidemiológicos nas populações alvo selecionadas conforme critérios de risco e impactos na produção e no comércio.
O delineamento amostral proposto permite identificar se houve ou não exposição prévia para IABP ou transmissão viral de cepas de IABP ou DNC lentogênica. Esses dados, associados aos resultados da investigação de suspeitas, permitem dar as garantias de certificação ao comércio internacional de aves e produtos avícolas.
Objetivo 3: monitorar a ocorrência de cepas virais da IA para subsidiar estratégias de saúde pública e saúde animal
A vigilância direcionada para determinados populações alvo de IA permite a identificação e o monitoramento da circulação de cepas do vírus que podem ser introduzidas no país pelo movimento de aves migratórias, possibilitando a contenção de disseminação entre as aves de produção, a prevenção de mutações de vírus de IABP para IAAP e a proteção da saúde pública no enfoque atual de “Saúde Única”.
¶ Procedimentos
¶ 1. INTRODUÇÃO
A avicultura brasileira se desenvolveu a partir da década de 70, com a entrada no mercado de empresas especializadas na produção e processamento da carne de frango. Transformações tecnológicas, técnicas de produção intensiva e o desenvolvimento de genética adaptada contribuíram para o grande avanço da atividade. O surgimento do sistema de integração vertical na Região Sul do país alavancou um extraordinário crescimento na produção de carne, transformando o Brasil no terceiro maior produtor e maior exportador mundial. Nesse modelo de parceria, mais verticalizado e intensivo, o avicultor integrado passou a contar com o apoio da indústria no que se refere ao fornecimento dos principais insumos da atividade, como ração e medicamentos, além de assistência técnica e reposição de lotes (pintainhos). A produção é repassada à indústria, que garante a remuneração ao avicultor e estabilidade de fornecimento de matéria prima de qualidade.
A avicultura de postura também evoluiu bastante e ultrapassou 50 bilhões de ovos produzidos em 2020. O número de aves de postura alojadas no campo vem avançando nos últimos anos, impulsionado pelo aumento no consumo per capita interno. As exportações de ovos in natura e subprodutos processados, apesar de ainda pouco representativas, totalizaram 11,3 mil toneladas em 2021, com crescimento de 81% em relação a 2020.
A condição sanitária da avicultura nacional é bastante favorável por ser livre da Influenza Aviária (IA) e da Doença de Newcastle (DNC), doenças de grande importância econômica e amplamente distribuídas no mundo. A manutenção desta condição no Brasil proporciona maior segurança alimentar para a população brasileira e vantagem competitiva para o acesso a mercados internacionais. O crescente trânsito internacional de pessoas, o comércio internacional de animais e produtos, a intensificação da produção e a diversidade de aves silvestres presentes em distintas rotas migratórias contribuem para o aumento dos riscos de introdução e disseminação dessas doenças, cujos custos sociais, econômicos e ambientais podem ser extremamente altos. Assim, as medidas de prevenção e a vigilância se tornam cada vez mais importantes. Diante destes crescentes riscos, é necessário fornecer evidências cada vez mais robustas para certificar a sanidade dos animais e produtos comercializados e a assegurar a capacidade de abastecer a demanda nacional. Tais evidências são fundamentadas nas diretrizes da Organização Mundial de Saúde Animal (OMSA) para a segurança sanitária do comércio internacional.
A IA tem um importante potencial zoonótico e pandêmico, caso ocorra o spill over da infecção das aves para a população humana e a sustentação da transmissão entre humanos, o que justifica os esforços de vigilância para a detecção precoce, que beneficia não apenas o componente animal como também a saúde pública. Dessa forma, adicionalmente aos procedimentos de biosseguridade, a vigilância representa um dos principais componentes dos sistemas de saúde animal e permite a detecção precoce de doenças animais emergentes e reemergentes, viabilizando o controle e a erradicação eficiente, e a certificação da condição de livre de doenças, ampliando o acesso dos sistemas produtivos ao comércio nacional e internacional. Este Plano de vigilância de IA e DNC visa aperfeiçoar o sistema de vigilância do país, incorporando os recentes conceitos internacionais sobre o tema, por meio da vigilância baseada em risco, de forma a melhorar sua eficácia e eficiência, e contribuindo para a proteção da saúde pública e animal.
O Plano de vigilância de IA e DNC foi desenvolvido sob a coordenação do Departamento de Saúde Animal (DSA), subordinado à Secretaria de Defesa Agropecuária (SDA) do Ministério da Agricultura, Pecuária e Abastecimento (MAPA), com a colaboração do Centro Panamericano de Febre Aftosa, e em consulta às Superintendências Federais de Agricultura, Pecuária e Abastecimento (SFA), os órgãos estaduais de sanidade agropecuária (OESA), os órgãos federais da saúde (Ministério da Saúde) e do meio ambiente (Instituto Chico Mendes de Conservação da Biodiversidade – ICMBio), e representantes dos setores privados interessados.
¶ 2. DESCRIÇÃO E CONTEXTO EPIDEMIOLÓGICO DA IA E DNC
¶ 2.1 Influenza aviária (IA)
A IA é causada pelo vírus da Influenza A, da família Orthomyxoviridae e gênero Alphainfluenzavirus, que são os únicos vírus influenza que afetam as aves naturalmente.
A doença é altamente contagiosa, afeta várias espécies de aves domésticas e silvestres e, ocasionalmente, mamíferos como ratos, gatos, cães, cavalos, suínos e o homem. Aves aquáticas são os maiores reservatórios do vírus, e a grande maioria dos isolados são considerados de baixa patogenicidade para galinhas e perus.
Os subtipos do Vírus Influenza A são identificados com base nas proteínas de superfície, sendo 18 subtipos de hemaglutininas (H) e 11 subtipos de neuraminidases (N). De acordo com o índice de patogenicidade, são classificados como Influenza Aviária de Alta Patogenicidade (IAAP) ou Influenza Aviária de Baixa Patogenicidade (IABP). Somente alguns subtipos H5 e H7 foram identificados como responsáveis pelas infecções de IAAP. A maioria dos isolados de H5 e H7 e todos os outros subtipos são caracterizados como de baixa patogenicidade.
A epidemiologia da IA é complexa, pois os vírus evoluem constantemente por mutação e rearranjo, com o surgimento de novos subtipos e possibilidade de adaptação a novos hospedeiros, causando impacto na saúde e produção animal. Além disso, alguns subtipos de IA já causaram infecções zoonóticas (H5, H7, H9) em algumas regiões do mundo, e apresentam potencial pandêmico, caso as mutações permitam manter a transmissão sustentada entre humanos.
Os sinais e lesões nas aves podem ser bastante variáveis, dependendo da espécie suscetível, da cepa e patogenicidade do vírus, do estado imunitário das aves, da presença de infecções secundárias e das condições ambientais:
Influenza Aviária de Alta Patogenicidade (IAAP): Taxa de mortalidade alta e súbita, sem manifestação de sinais clínicos; ou doença severa, com depressão intensa e sinais respiratórios e neurológicos; cianose e focos necróticos na crista e na barbela além de queda na postura e produção de ovos deformados, com casca fina ou sem pigmentação. No exame post mortem pode-se verificar edema, congestão, hemorragia e necrose em vários órgãos internos e pele.
Influenza Aviária de Baixa Patogenicidade (IABP): A grande maioria dos vírus da IABP são mantidos de forma assintomática em aves silvestres. Nas aves domésticas os sinais podem estar ausentes ou ser brandos, incluindo sinais respiratórios (espirros, tosse, corrimento nasal e ocular), diarreia, letargia, edema da face, além de queda de produção e consumo de água e alimento. No exame post mortem pode-se verificar rinite, sinusite, congestão na traqueia, hemorragia em trato reprodutivo de poedeiras, aerossaculite e peritonite.
No Brasil, qualquer suspeita de IA, tanto de baixa patogenicidade quanto de alta patogenicidade, é de notificação obrigatória e imediata ao Serviço Veterinário Oficial (SVO), conforme definido na Instrução Normativa Mapa nº 50, de 23 de setembro de 2013. A confirmação de um foco requer aplicação das medidas de contenção e erradicação previstas no Plano de Contingência da doença.
A OMSA inclui a IA em sua lista de doenças e todos os países devem notificar a ocorrência de infecção pelo vírus IAAP em qualquer espécie e tipo de aves, incluindo aves silvestres, ou, ainda, casos de IABP em aves domésticas e silvestres em cativeiro quando houver potencial de transmissão natural para humanos associada a consequências graves à saúde pública ou saúde animal.
É importante destacar que, conforme disposto no Código de Animais Terrestres da OMSA, a ocorrência e a notificação de IAAP em aves de subsistência e em aves silvestres, ou a notificação de IABP em aves domésticas ou silvestres de cativeiro, incluindo ornamentais, de exposição e de companhia, silvestres, sinantrópicas ou outras não altera a condição sanitária de IAAP do país. Nenhum país membro deverá impor proibições ao comércio internacional de mercadorias de aves domésticas em resposta a tais notificações ou a outra informação da presença de qualquer vírus da influenza tipo A em aves cuja notificação não seja obrigatória.
Conforme padronizado no Manual de Testes Diagnósticos e Vacinas dos Animais Terrestres – OMSA, o DSA/Mapa utiliza os seguintes critérios de confirmação de caso de IA, conforme testes de diagnóstico para detecção do agente:
● Influenza aviária de alta patogenicidade (IAAP) - infecção em aves causada por qualquer vírus Influenza tipo A que apresenta: sequência de aminoácidos do sítio de clivagem HA0 similar às observadas em vírus previamente considerados de alta patogenicidade em galinhas; ou índice de patogenicidade intravenosa (IPIV) superior a 1,2 em 10 galinhas (de 4 a 8 semanas de idade) inoculadas por via intravenosa; ou mortalidade superior a 75%, em 10 dias, em no mínimo 8 galinhas (de 4 a 8 semanas de idade) inoculadas por via intravenosa.
● Influenza aviária de baixa patogenicidade (IABP) - infecção em aves por qualquer vírus Influenza tipo A que apresenta: sequência de aminoácidos do sítio de clivagem HA0 diferente das observadas em vírus previamente considerados de alta patogenicidade ou taxa de mortalidade e IPIV inferiores aos da IAAP.
Atualmente os principais fatores que contribuem para a transmissão da influenza aviária são os seguintes:
● Aves migratórias/silvestres – A exposição direta a aves silvestres infectadas é o principal fator de risco de transmissão da IA para as aves domésticas, seja de produção comercial ou subsistência. Estas aves atuam como hospedeiro natural e reservatório dos vírus da IA desempenhando um papel importante na evolução, manutenção e disseminação desses vírus. Essas aves podem apresentar infecção sem adoecer ou, muitas vezes, se recuperam e continuam infectantes, o que lhes permite transportar o vírus a longas distâncias ao longo das rotas de migração. As principais espécies silvestres envolvidas geralmente são aquáticas migratórias marinhas, principalmente das ordens Anseriformes e Charadriiformes.
● Globalização e comércio internacional – O intenso fluxo de pessoas ao redor do mundo, assim como de mercadorias, aumenta consideravelmente o risco de disseminação de doenças, incluindo a IA.
● Mercados/feiras de vendas de aves vivas - Podem facilitar o contato próximo entre diferentes espécies de aves e outros animais, assim como com o homem, o que além de favorecer a transmissão, aumenta a possibilidade de recombinações genéticas entre diferentes subtipos de vírus Influenza.
Portanto, aplicar medidas de biosseguridade nos estabelecimentos avícolas visando limitar a exposição das aves domésticas às aves silvestres, principalmente aquáticas migratórias marinhas, é a principal medida de mitigação de risco para introdução do vírus da IA no plantel avícola nacional e, consequentemente, para diminuir o risco de mutação para formas altamente patogênicas e recombinação com componentes de outros vírus de influenza para formar vírus que podem não apenas infectar aves e humanos, como ser transmitidos entre humanos.
Apesar de nunca detectada no Brasil, a IAAP é uma doença de distribuição mundial, com ciclos pandêmicos e contínuo crescimento no número de países afetados e subtipos circulantes ao longo dos últimos anos e com graves consequências ao comércio internacional de produtos avícolas. De 2005 a 2022, 76 países notificaram a presença de IAAP.
A situação mundial da IA é monitorada continuamente pela OMSA (https://www.WOAH.int/en/disease/avian-influenza/) e pela FAO (https://empres-i.apps.fao.org/diseases )
¶ 2.2. Doença de Newcastle (DNC)
A DNC é uma doença altamente contagiosa e frequentemente grave, causada por cepas virulentas de um vírus da família dos Paramixovírus aviário tipo 1 (APMV-1), encontrada em todo o mundo, que afeta mais de 200 espécies de aves. Pode se apresentar com diferentes formas de severidade, que varia de acordo com a cepa do vírus e a espécie hospedeira:
● Velogênica viscerotrópica - altamente patogênica com manifestação frequente de lesões intestinais hemorrágicas; com doença severa e alta mortalidade em galinhas, com morte súbita, apatia, inapetência, hiperemia conjuntival, sinais respiratórios, cianose, diarreia esverdeada, queda na postura e anomalias nos ovos.
● Velogênica neurotrópica - causa alta mortalidade e, geralmente, está associada a sinais respiratórios e neurológicos, como: espirros, corrimento nasal, ruído nos pulmões, inchaço da cabeça e face, fraqueza, torcicolo, paralisia das pernas e tremores musculares, elevada mortalidade (até 100% das aves não vacinadas). Aves com morte súbita ou sinais neurológicos apresentam poucas ou nenhuma lesão macroscópica. Características das lesões causadas por cepas velogênicas que ocorrem principalmente em frangos/galinhas: Edema na cabeça e região periorbital e pescoço; congestão e hemorragias na mucosa traqueal e faringe; membranas diftéricas na orofaringe, traqueia e esôfago; petéquias e equimoses no proventrículo, lesões hemorrágicas, úlceras e/ou necrose nas tonsilas cecais e tecidos linfóides da parede intestinal (placas de Péter); baço aumentado e friável; necrose pancreática e edema pulmonar; ovários edemaciados ou reduzidos e hemorrágicos.
● Mesogênica - causa, normalmente, baixa mortalidade (< 10%); é mais comum em aves jovens; está associada a sinais respiratórios leves, queda de postura de ovos e, ocasionalmente, a manifestação de sinais neurológicos. Os sinais são mais severos quando há coinfecções.
● Lentogênica ou respiratória - infecção respiratória com sinais leves ou subclínicos, em aves jovens;
● Subclínica ou entérica - infecção entérica, geralmente, subclínica.
As cepas velogênicas do APMV-1 são endêmicas em grande parte da Ásia, África, Oriente Médio e alguns países da América Central e do Sul. Isolados lentogênicos ocorrem em aves domésticas e silvestres em todo o mundo, porém causam poucos surtos. Grande parte das aves infectadas apresenta poucos sinais clínicos ou é assintomática, contribuindo para a manutenção e liberação do vírus no ambiente. Além disso, essas cepas podem sofrer mutações, se tornando altamente virulentas.
Apesar de rara, pode haver infecção em humanos, geralmente de forma leve, causando conjuntivite em pessoas com contato direto com aves infectadas. Não há relatos de infecção por alimentação com produtos originados de aves.
O APMV-1 tem uma variante, que é o Pigeon Paramixovírus - sorotipo 1 (PPMV-1), cujos hospedeiros naturais são os columbiformes, podendo eventualmente infectar aves domésticas e silvestres. Em pombos, o PPMV-1 causa mortalidade variável de 10 a 100%, apresentando sinais clínicos de depressão, diarreia, torcicolo, ataxia e sinais neurológicos. Aves domésticas e silvestres podem apresentar sinais clínicos compatíveis com infecção pelo APMV-1.
A infecção por vírus de DNC faz parte da lista de doenças da OMSA e qualquer suspeita de DNC é de notificação obrigatória imediata no Brasil, conforme estabelecido na IN Mapa nº 50/2013. Para a OMSA, é necessária a notificação de focos de DNC em aves domésticas. A confirmação de um foco no Brasil requer aplicação das medidas de contenção e erradicação previstas no Plano de Contingência da doença.
Conforme padronizado no Manual de Testes Diagnósticos e Vacinas dos Animais Terrestres – OMSA, o DSA/Mapa considera como critério de confirmação de caso de DNC o isolamento e identificação do agente ou detecção do RNA viral específico do APMV-1 caracterizado como de alta patogenicidade (índice de patogenicidade intracerebral-IPIC em pintinhos de um dia, maior ou igual a 0,7 ou com padrão característico de resíduos de múltiplos aminoácidos básicos do sítio de clivagem, demonstrado por sequenciamento molecular) em aves domésticas. A confirmação da infecção pelo mesmo vírus em outros tipos de aves é denominada infecção pelo APMV-1.
A DNC é considerada uma das doenças avícolas mais importantes do mundo. Os surtos podem ter um impacto considerável em países em desenvolvimento, onde essas aves são uma fonte significativa de proteína. Nos países desenvolvidos em que cepas de APMV-1 altamente virulentas foram erradicadas, os surtos causam perdas econômicas graves por embargos e restrições comerciais, além dos custos de contenção e eliminação dos focos.
No Brasil, a avicultura industrial é considerada livre da DNC. Os últimos casos confirmados ocorreram em 2006 e em aves de subsistência nos estados do Amazonas, Mato Grosso e Rio Grande do Sul. A vacinação contra a DNC é obrigatória para os estabelecimentos avícolas de reprodução e de postura comercial.
_(pdf.io).jpg)
¶ 3. JUSTIFICATIVAS
A vigilância de IA e DNC tem como finalidade a prevenção da infecção e manutenção da situação de livre, tanto para fins de segurança da produção avícola e garantias do comércio, como também para proteção da segurança alimentar e saúde pública. Os altos custos para controle de focos das doenças e principalmente as restrições comerciais em consequência da ocorrência de ambas as doenças geram graves prejuízos econômicos, tanto no nível local, com destruições de plantéis e interrupção das várias etapas da produção, quanto no nível nacional, com perdas de mercados, receitas e empregos, e potencial risco para a saúde humana, no caso da IA.
A rápida detecção de casos de IA ou DNC é essencial para o sucesso das ações de resposta a emergências, para o controle e erradicação do foco e para a recuperação rápida da condição sanitária, e a demonstração da situação de livre dessas doenças é requisito importante para garantia de acesso e manutenção do comércio internacional de produtos de origem avícola.
Além disso, a IA tem potencial de causar doença grave em humanos, sendo a exposição direta a aves domésticas infectadas a principal via de transmissão, portanto a vigilância de IA tem papel relevante no contexto da “Saúde Única”. Nesse sentido, a implantação de um sistema de vigilância eficiente é fundamental para subsidiar as análises de risco e para avaliação e revisão das estratégias de prevenção e erradicação de doenças submetidas ao controle do serviço oficial de saúde animal no país.
A vigilância passiva é a estratégia mais adequada para detecção precoce, e deve ser baseada na notificação obrigatória e imediata de casos suspeitos para investigação pelo Serviço Oficial de Saúde Animal, com a adoção das medidas necessárias para confirmação de foco e aplicação das medidas previstas no Plano de Contingência para contenção, erradicação e restituição da condição de livre da doença.
A vigilância ativa é uma estratégia importante para a comprovação da ausência de circulação viral de IAAP e DNC em aves domésticas de produção, para a certificação para comércio internacional de produtos e material genético avícola ou para a identificação de circulação de IABP, visando conter sua disseminação e prevenir a evolução para cepas de alta patogenicidade. Além disso, a vigilância ativa é importante para monitorar a ocorrência de infecção em aves silvestres migratórias, visando direcionar as ações de mitigação de risco e prevenção da introdução em aves domésticas.
Assim, o DSA revisou os atuais componentes do sistema de vigilância de IA e DNC e desenvolveu um Plano de vigilância visando fortalecer a prevenção e a resposta às emergências para estas doenças, além de otimizar o uso de recursos empenhados, com o propósito principal de proteger a avicultura e a economia nacional da ocorrência das doenças mencionadas e de seus impactos econômicos, sociais e na saúde pública, além de garantir a certificação para acesso a mercados.
O presente Plano considera um cenário de ausência de casos no Brasil e as características das doenças para demonstração da condição de livre dessas doenças. Havendo qualquer alteração relevante na situação epidemiológica das doenças no país ou na região, os componentes e delineamentos amostrais deverão ser adequados à nova realidade.
¶ 4. OBJETIVOS DO PLANO DE VIGILÂNCIA
A vigilância de IA e DNC no Brasil tem os seguintes objetivos:
Objetivo 1: detecção precoce de casos IA e DNC nas populações de aves domésticas e silvestres
É o principal objetivo da vigilância de doenças ausentes (erradicadas ou exóticas) no país, permite a pronta reação, erradicação e restituição da condição de livre. A detecção precoce de casos suspeitos de IA e DNC somente é possível com o fortalecimento da vigilância passiva, que se baseia na notificação obrigatória imediata de casos suspeitos, para rápida investigação pelo serviço oficial de saúde animal, que deverá coordenar a aplicação das medidas para diagnóstico, contenção e erradicação previstos no Planos de Contingência.
Objetivo 2: demonstração de ausência de IA e DNC na avicultura industrial de acordo com as diretrizes internacionais de vigilância para fins de comércio.
A demonstração da ausência de IA e DNC por meio do sistema de vigilância ativa dá suporte e permite a certificação da condição sanitária de livre dessas doenças nas populações alvo da vigilância, perante a OMSA e os parceiros comerciais.
Esse objetivo é atendido principalmente por meio dos componentes de vigilância ativa, com a realização de estudos epidemiológicos nas populações alvo selecionadas conforme critérios de risco e impactos na produção e no comércio.
O delineamento amostral proposto permite identificar se houve ou não exposição prévia para IABP ou transmissão viral de cepas de IABP ou DNC lentogênica. Esses dados, associados aos resultados da investigação de suspeitas, permitem dar as garantias de certificação ao comércio internacional de aves e produtos avícolas.
Objetivo 3: monitorar a ocorrência de cepas virais da IA para subsidiar estratégias de saúde pública e saúde animal
A vigilância direcionada para determinados populações alvo de IA permite a identificação e o monitoramento da circulação de cepas do vírus que podem ser introduzidas no país pelo movimento de aves migratórias, possibilitando a contenção de disseminação entre as aves de produção, a prevenção de mutações de vírus de IABP para IAAP e a proteção da saúde pública no enfoque atual de “Saúde Única”.
¶ 5. RESULTADOS E PRODUTOS ESPERADOS
O desenvolvimento das ações previstas nesse Plano está relacionado com o atendimento dos objetivos descritos no item 4.
Todos os dados coletados deverão ser registrados nos sistemas específicos para vigilância passiva e ativa (e-SISBRAVET e SIGEP ou outro sistema definido pelo MAPA).
Os resultados serão apresentados na forma de:
● Registros e bases de dados dos respectivos sistemas de informação utilizados para gestão da vigilância;
● Relatório anual do sistema de vigilância; e
● Análises dos componentes do sistema e avaliação de indicadores de vigilância.
As informações resultantes serão usadas pelos gestores do sistema para a tomada de decisões e ações específicas como:
● Atendimento imediato e investigação no prazo máximo de 12 horas de suspeitas de SRN notificadas ao serviço oficial de saúde animal, para descartar ou confirmar as doenças alvo;
● Avaliação do desempenho na execução da vigilância passiva para orientar os procedimentos durante as investigações;
● Ativação do sistema de resposta rápida em caso de confirmação de foco das doenças;
● Adequação das capacidades de detecção e resposta com base nos resultados dos indicadores da vigilância ou diante de indicação de aumento potencial de risco à população suscetível;
● Subsidiar as garantias de certificações e negociações comerciais que exijam a comprovação da condição de livre das doenças; e
● Revisão de estratégias e procedimentos quando forem detectadas.
O Plano de vigilância de IA e DNC deverá ser avaliado em seus parâmetros e estrutura após o primeiro ano e, em seguida, uma vez a cada 3 anos. Atualizações poderão ser realizadas após as mudanças nas avaliações de riscos ou quando o DSA julgar necessário.
Mudanças significativas nos fatores de risco que aumentem a probabilidade de introdução da IA ou da DNC no país devem levar a uma revisão desse Plano, mesmo que fora da periodicidade estabelecida.
¶
6. PARTES INTERESSADAS
Todos os envolvidos na criação, manejo, transporte, produção, fiscalização, inspeção, diagnóstico, ensino, pesquisa e cuidados com as aves, entre outras atividades, são considerados partes interessadas no Plano de vigilância de IA e DNC, com responsabilidades na execução de partes das atribuições da vigilância.
Entre as principais partes interessadas do Plano estão os integrantes do SVO, que no Brasil é constituído pelos setores das instituições governamentais responsáveis pela regulamentação, planejamento, coordenação, execução e avaliação dos procedimentos relacionados à vigilância em saúde animal, à inspeção de produtos de origem animal, às análises em laboratórios federais de defesa agropecuária e à vigilância agropecuária internacional, com o MAPA, representando a instância central e superior do Sistema Unificado de Atenção à Sanidade Agropecuária - SUASA, e os OESA, representando as instâncias intermediárias e locais do serviço veterinário oficial nos estados.
Também participam de forma importante os produtores e integrantes das agroindústrias, além de prestadores de serviço e fornecedores de insumos, profissionais e instituições envolvidas com aves silvestres. A Tabela 1 demonstra as responsabilidades dos segmentos envolvidos ou interessados no Plano.
Tabela 1. Responsabilidades dos segmentos interessados no Plano de vigilância de IA e DNC.
| Partes interessadas | Descrição | Responsabilidade |
|---|---|---|
| Serviço Oficial de Saúde Animal | Médicos veterinários e pessoal auxiliar sob a autoridade do Serviço oficial de Saúde Animal do MAPA e SVE | Normatização, gerenciamento, manutenção do banco de dados, análises e divulgação de informações, investigação de casos suspeitos, colheita de amostras, conscientização, capacitação, educação, comunicação e financiamento |
| Produtores/ Empresas/Cooperativas | Detentores de aves de produção | Notificação de suspeitas; adoção de boas práticas de produção, compromisso de ter a capacidade de reconhecer as doenças de interesse, medidas de biosseguridade e registros das atividades; financiamento |
| LFDA | Laboratórios Federais de Defesa Agropecuária | Referência para realização de testes diagnósticos de triagem e confirmatórios |
| Embrapa e outras Instituições de pesquisa | Médicos veterinários, biólogos, zootecnistas, agrônomos e auxiliares envolvidos com pesquisa | Pesquisas, notificação de suspeitas; difusão de informações, capacitação |
| Órgãos do meio ambiente | Médicos Veterinários, biólogos e auxiliares envolvidos com gestão ambiental e conservação | Pesquisa; notificação de suspeitas; fornecimento de informações; difusão de informações; colheita de amostras |
| Indústria | Segmento agroindustrial de produtos avícolas e fornecedores de insumos pecuários | Notificação de suspeitas; difusão de informações; fornecimento de informações de vigilância indireta, financiamento, biosseguridade |
| Laboratórios credenciados | Laboratórios públicos ou privados credenciados pelo MAPA para realização dos testes de triagem | Notificação de suspeitas; difusão de informações; realização de testes de triagem |
| Laboratórios privados | Laboratórios privados que realizam testes diagnósticos de doenças do sistema de produção | Notificação de suspeitas; difusão de informações, envio de amostras recebidas de casos suspeitos ou prováveis |
| Médicos Veterinários Habilitados | Médicos veterinários privados com delegação de competência do Serviço oficial de Saúde Animal para execução de ação específica | Notificação de suspeitas; colheita de amostras; gerar informação de interesse (relatórios); biosseguridade; difusão de informações, sensibilização-capacitação-educação, |
| Prestadores de serviços | Serviços eventuais ou permanentes: consultorias, atendimento clínico, revendas agropecuárias, vacinadores, recolhimento de aves mortas | Notificação de suspeitas; difusão de informações, biosseguridade |
| Médicos veterinários e profissionais dos serviços de meio ambiente | Médicos veterinários, biólogos, zootecnistas e outros profissionais que atuam na área de conservação ambiental e gestão de áreas de preservação | Pesquisa; notificação de suspeitas; colheita de amostras; difusão de informações, biosseguridade |
| ABPA | Associação Brasileira de Proteína Animal | Difusão de informações; financiamento |
| CNA | Confederação da Agricultura e Pecuária do Brasil | Difusão de informações |
| AVAL | Associação Brasileira de Avicultura Alternativa | Difusão de informações |
| Fundos de defesa sanitária animal | Fundos privados instituídos com a finalidade de arrecadar fundos para indenizações de apoio às ações de defesa agropecuária | Difusão de informações; financiamento |
| Extensão rural | Médicos veterinários e auxiliares | Notificação de suspeitas; difusão de informações, biosseguridade, educação em saúde animal |
| Instituições de ensino | Médicos veterinários, zootecnistas, agrônomos e auxiliares | Notificação de suspeitas; difusão de informações, pesquisa e capacitação |
| Transportadores de aves | Profissionais que realizam transporte de aves entre propriedades e para abate | Notificação de suspeitas; difusão de informações, biosseguridade |
| Vigilância agropecuária internacional | Médicos veterinários e pessoal auxiliar ligados à vigilância do trânsito internacional de animais e mercadorias | Notificação de suspeitas; difusão de informações, biosseguridade |
¶ 7. DESCRIÇÃO DA POPULAÇÃO-ALVO
O Plano de vigilância de IA e DNC abrange as populações dos diferentes sistemas de produção de aves no país, incluindo as silvestres, nas quais os impactos da doença seriam mais significativos e que apresentam maiores riscos de ocorrência das doenças-alvo. A seguir descrevem-se as principais categorias ou subpopulações-alvo do Plano de vigilância de IA e DNC.
¶ 7.1 Avicultura industrial
De acordo com os dados do MAPA, no Brasil 53,7% dos estabelecimentos avícolas são de aves de corte (frangos e perus), 39,8% de aves de reprodução, 3,4% de aves de postura comercial, 0,1% de aves ornamentais e 2,9% de outras aves.
¶ 7.1.1 Avicultura de Reprodução
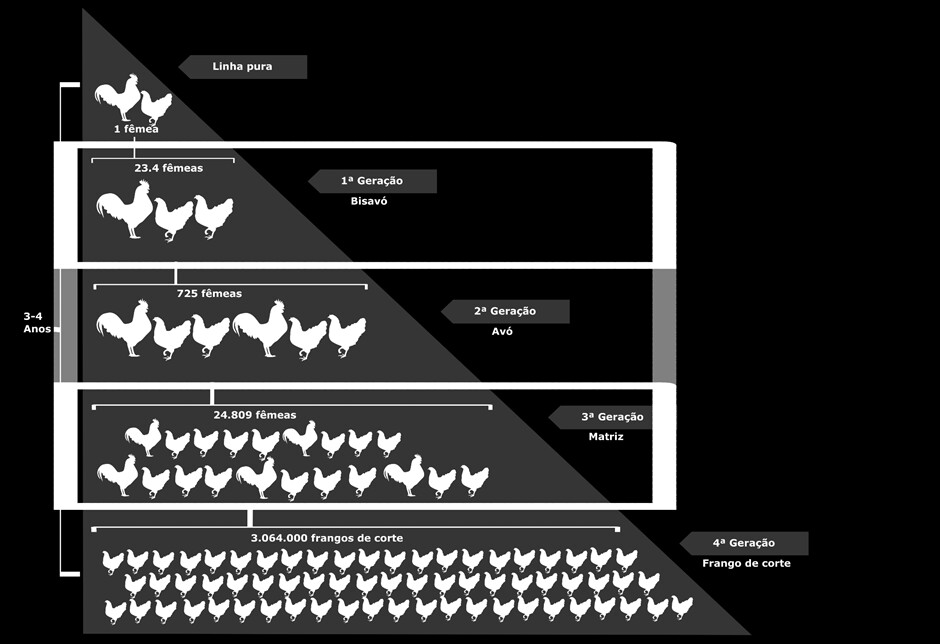
A avicultura de reprodução compreende o material genético de todo o sistema de produção e constitui-se nas aves procedentes de linhas puras ou dos cruzamentos destinados à produção de carne ou ovos. O aumento de desempenho de linhagens se acentuou nas últimas décadas devido aos programas de melhoramento genético, o que tem proporcionado ganhos expressivos de produtividade.
Nesses plantéis é realizada a seleção genética, um processo altamente tecnológico e restrito a poucas empresas multinacionais, localizadas principalmente nos EUA, Canadá, França, Reino Unido, Holanda e Alemanha. Essas granjas criam as linhas puras e bisavós cujos ovos e pintos de um dia são exportados ao Brasil para produção de aves bisavós e avós, respectivamente.
As granjas bisavozeiras produzem aves avós. As granjas avozeiras produzem as aves matrizes. As granjas matrizeiras, por sua vez, têm como produto os híbridos obtidos do cruzamento entre matrizes, que são vendidos como pintos de um dia e tornar-se-ão os frangos de corte ou galinhas de postura. Dessa forma, frangos de corte e poedeiras são híbridos produzidos por meio de cruzamentos entre três ou quatro linhagens. Portanto, a proteção dessa parte da cadeia produtiva é estratégica e essencial para a produção nacional. No Brasil, as granjas de reprodução apresentam altos níveis de biosseguridade e monitoramento sanitário, justamente para evitar o ingresso e a disseminação de doenças nos sistemas produtivos. Atualmente, o Brasil é um grande exportador de genética de aves, principalmente devido aos eficientes sistemas de produção estabelecidos e à condição sanitária, especialmente em relação à IA e DNC.
Dentre os estabelecimentos de aves de reprodução registrados, 71 são bisavozeiros, avozeiros, de aves livres de patógenos específicos (SPF) e de produção de ovos controlados e 1.439 são estabelecimentos matrizeiros produtores de ovos férteis. No ano de 2020, foram alojadas 55,3 milhões de matrizes de corte. Apesar dos bons níveis de biosseguridade, as aves de reprodução são consideradas categorias de maior risco de exposição aos vírus da IA e da DNC por apresentarem longos ciclos de vida e de produção. Dessa forma, o Plano de vigilância inclui as granjas de reprodução entre as categorias prioritárias de risco, embora com um peso que modula seu risco relativo.
¶
7.1.2. Avicultura de frangos de corte
A produção brasileira de carne de frango foi de 14,3 milhões de toneladas em 2021, com mais de 6 bilhões de aves abatidas, o que faz do Brasil o 3º maior produtor de frangos do mundo e o maior exportador mundial, com 4,6 milhões de toneladas exportadas.
A produção está distribuída no país com 35,54% no Paraná; 14,89% em Santa Catarina; 13,65% no Rio Grande do Sul; 8,32% em São Paulo; 8,27% em Goiás; 7,44% em Minas Gerais; 3,76% no Mato Grosso; 2,75% no Mato Grosso do Sul; 1,10% em Pernambuco e o restante em outros estados (ABPA, 2022).
A produção de frangos de corte no Brasil tem vantagens competitivas devido aos baixos custos de produção, ao rápido ciclo produtivo e à predominância dos sistemas de integração, no qual a empresa integradora fornece os pintinhos, a ração, os produtos, o suporte logístico e a assistência veterinária, e o avicultor é responsável pelas instalações e equipamentos e pela mão de obra, manejo zootécnico, pelos cuidados sanitários e bem-estar das aves. Nessa cadeia, a agroindústria exerce diversas funções, sendo a principal responsável por coordenar os elos de produção, de matéria-prima, de industrialização e distribuição de produtos. Esse sistema de integração permitiu a adoção de sistemas modernos de planejamento, organização, coordenação, gestão e incorporação de novas tecnologias que resultaram nos aumentos da produção e da produtividade, na redução dos custos e na diversificação de produtos oferecidos.
Atualmente, além da qualidade genética, a produção de frangos de corte adota modernas técnicas de nutrição, ambiência, manejo, controles sanitários e biosseguridade, permitindo alcançar ciclos de produção cada vez mais curtos e eficientes, possibilitando alcançar pesos de abate com tempos de vida cada vez mais curtos.
Apesar de ser a parcela mais numerosa na população de aves no Brasil, essa população apresenta o menor risco no sistema de vigilância baseada em risco de IA e DNC, devido à boa biosseguridade do sistema e principalmente ao ciclo muito curto de vida das aves, o que diminui a possibilidade de infecção e a detecção de resposta imunológica à IA. Assim, essa categoria foi considerada a de menor risco no Plano de vigilância de IA e DNC.
¶ 7.1.3. Avicultura de postura comercial
O alojamento de aves de postura comercial foi de 114.637.958 galinhas em 2021, com uma produção de 54,9 bilhões de ovos. A produção está distribuída no país, sendo 29,63% em São Paulo; 10,54% em Minas Gerais; 9,17% no Espírito Santo; % 8,19% em Pernambuco; 5,82% Rio Grande do Sul; 5,59% Mato Grosso; 5,26% no Ceará; 4,75% no Paraná; 4,63% em Goiás; 3,15% em Santa Catarina; 1,71% no Mato Grosso do Sul e 1,67% na Bahia e (ABPA, 2022).
Os sistemas de produção e manejo de galinhas poedeiras podem ser classificados em: intensivos (em gaiolas ou sobre o piso, em galpões abertos telados ou fechados), sendo considerados o convencional o mais comum; e extensivos ou alternativos (livres de gaiolas e/ou orgânico), com acesso ao ar livre como principal diferencial de risco em relação ao sistema convencional.
No sistema convencional, a criação é feita em galpões com o uso de gaiolas convencionais, com seções de gaiolas sobrepostas. A criação pode ser realizada em galpões abertos telados, que têm menor custo e utilizam ventilação natural, com auxílio ou não de ventiladores.
Esta forma de criação é mais comum em regiões de clima ameno e apresenta maior possibilidade de exposição ao agente e a fontes de infecção, seja pelo vento ou contatos diretos ou indiretos com aves silvestres. Devido aos menores níveis de biosseguridade, maiores riscos de exposição e ao ciclo de vida longo das aves, esses sistemas são considerados de maior risco e devem ser priorizados para a vigilância.
Já os sistemas de criação em galpões fechados requerem ventilação forçada e resfriamento evaporativo, bem como uma boa vedação. É composto por instalações mais complexas e caras, que oferecem melhores condições de biosseguridade, com menores chances de exposição a agentes infecciosos pelo vento ou aves silvestres, sendo menos priorizados na vigilância quando comparados com os galpões abertos.
Os sistemas de produção alternativos estão em crescimento visando atender as demandas de mercado por oferecer melhor bem-estar às galinhas. Esse tipo de produção é realizada sem gaiolas e com as aves mantidas livres em parte do dia ou em tempo integral com acesso a piquetes de pasto. A criação ainda prevê disponibilidade mínima de ninhos, poleiros e área de camas e pastejo por ave, entre outras especificações. Esse sistema, contudo, é desvantajoso do ponto de vista sanitário em relação aos sistemas de gaiolas, pois aumenta significativamente a exposição das aves e dos ovos a agentes infecciosos, além de dificultar as ações de limpeza e desinfecção das instalações. Portanto, esses sistemas apresentam maior risco de introdução de doenças, em relação aos sistemas convencionais, devendo ser priorizados para a vigilância.
¶ 7.1.4 Avicultura de perus, codornas e patos
Perus: A produção brasileira de carne de peru é pequena e vem decrescendo nos últimos anos, caindo de 442,2 mil toneladas em 2012, para 157,05 em 2021, estando concentrada 56,54% no Rio Grande do Sul,39,45% em Santa Catarina e 3,99% no Paraná (ABPA, 2022).
Na produção comercial de perus, as aves de um dia são enviadas da planta de incubação às granjas para a fase de iniciação, que abrange da chegada até os 35-38 dias. A etapa de terminação para as fêmeas contempla um período de 78-80 dias para abater com cerca de 6,5 a 6,7 quilos; ou até os 90 dias para atingir 8 quilos de peso da ave viva. Para o caso dos machos, o objetivo é alcançar 18-20 quilos aos 128-140 dias de idade. Estes longos ciclos de produção aumentam os custos de produção em relação ao frango e os riscos de exposição dessas aves à IA, DNC e outras doenças, sendo, portanto, categorias consideradas prioritárias para vigilância neste plano.
Codornas: O plantel de codornas no Brasil vem crescendo, alcançando um total de 16,5 milhões de aves, concentradas principalmente na região Sudeste (IBGE,2021). O sistema de produção se assemelha ao sistema de galinhas de postura, com criação em gaiolas em galpões abertos telados ou fechados, com uso de tecnologias e controles produtivos das aves. Também devido ao ciclo longo de vida e ao sistema de produção, as granjas de codornas são consideradas de relevância para a vigilância de IA e DNC.
Patos: A produção brasileira de carne de pato é muito pequena e foi de 5.083 toneladas em 2021, concentrada 99,75% em Santa Catarina; 0,09% em São Paulo; 0,05% no Paraná e 0,03% Rio Grande do Sul; e, sendo 68% destinada à exportação, principalmente ao Oriente Médio (ABPA, 2022).
Por ser uma ave anseriforme, da família dos anatídeos, as criações de patos são consideradas de alta relevância na vigilância da IA, devido à característica da família ser especialmente resistente à doença e as aves poderem se tornar reservatórios do vírus.
¶ 7.2. Avicultura de subsistência
Em todo o território brasileiro existem sistemas tradicionais de criação para produção de ovos e carne de frangos caipiras destinados ao consumo das famílias de produtores. Segundo a OMSA, esses estabelecimentos representam baixo risco para a disseminação de IA e DNC por estarem limitados a um ambiente domiciliar e não possuírem contato direto ou indireto com aves de produção ou seus estabelecimentos. Contudo, sua importância é clara quando se trata da detecção de doenças que circulam em populações naturais de aves silvestres, considerando maior probabilidade de contato.
O comércio local de excedentes criados de forma não tecnificada para complementação da renda familiar de pequenas propriedades rurais é feito de forma irregular e, por isso, requer ações específicas de fiscalização e eventual colheita de amostras de casos prováveis. Em geral, as galinhas, galinhas d’angola, perus e patos são criados soltos ou semiconfinados, com alimentação a pasto e com restos de alimentos, podendo ser suplementada com ração comercial ou milho.
¶ 8. FONTES E USO DE DADOS
A tabela 2 apresenta as principais fontes de dados de interesse para o sistema de vigilância de IA e DNC.
Tabela 2. Principais fontes de dados de interesse para o sistema de vigilância de IA e DNC.
| Tipo de dados | Fonte do dado | Local de registro e acesso | Descrição |
|---|---|---|---|
| Registros de notificações e investigações das suspeitas de doenças de notificação obrigatória em aves | MAPA e OESA | e-Sisbravet | Dados sob responsabilidade dos OESA e gerenciados pelos OESA e MAPA. O PNSA utiliza para acompanhar os atendimentos às ocorrências de casos prováveis de IA e DNC e para avaliar a vigilância passiva. |
| Cadastros de estabelecimentos e plantéis com geolocalização | OESA | Sistema informatizado do OESA | Cadastros dos sistemas informatizados e dos bancos de dados dos OESA, atualizados pelos produtores rurais e utilizados no delineamento da vigilância. |
| Registros da movimentação animal pela emissão da Guia de Trânsito Animal (GTA) | OESA | Sistema informatizado do OESA | Dados de movimentações registrados pelos produtores e médicos veterinários habilitados junto aos OESA e utilizados pelo PNSA para estruturar ações de gestão em saúde animal |
| Cadastros de estabelecimentos de abate e informações de aves abatidas e inspeção oficial | MAPA e OESA | SIGSIF, SIGPOA e Sistema informatizado do OESA | Dados consolidados pelo MAPA (estabelecimentos sob fiscalização federal ou inscritos no SISBI-POA) e pelos OESA (estabelecimentos de abate estadual) utilizados para avaliar a vigilância em abatedouros. |
| Registros de inspeção de estabelecimentos, de vacinações e fiscalizações de uso na gestão do PNSA | MAPA e OESA | Planilhas semestrais de gestão de programas | Dados consolidados pelos OESA e encaminhados ao MAPA, para avaliação do sistema de vigilância das doenças de notificação obrigatória em aves. |
| Dados de recursos humanos, financeiros e estruturais do MAPA, dos OESA, dos fundos de emergência | MAPA e OESA | Planilhas de relatórios anuais | Dados atualizados e consolidados anualmente pelos OESA, SFA e DSA servem de complemento para a realização das análises do PNSA. |
| Registro dos dados da vigilância internacional | MAPA/VIGIAGRO | SIGVIG e planilhas | Dados obtidos do Vigiagro nos pontos de ingresso de pessoas, animais e mercadorias diversas |
| Registro dos dados dos laboratórios oficiais e credenciados | LFDA e laboratórios credenciados | SIGEP ou outro sistema definido pelo MAPA e planilhas | Dados de análises relacionadas à vigilância e monitoramentos utilizados pelo PNSA |
| Registros de dados da vigilância ativa em aves domésticas | MAPA | SIGEP ou outro sistema definido pelo MAPA | Dados registrados pelo OESA e gerenciados pelo DSA. |
| Informações sobre aves silvestres de vida livre, centros de triagem e reabilitação de animais silvestres e criatórios conservacionistas | IBAMA, ICMBio, órgãos estaduais e municipais de meio ambiente | Publicações, planilhas e mensagens do órgão | Dados registrados pelo IBAMA, ICMBio, órgãos estaduais e municipais de meio ambiente e agentes de manejo populacional |
|
Informações sobre locais de agregação ou importantes para aves silvestres migratórias e espécies ocorrentes |
ICMBio
|
Publicações e arquivos do órgão | Registros e compilados pelo ICMBio a partir de diferentes fontes |
| Dados de ocorrências de eventos epidemiológicos relevantes e presença ou ausência de doenças | OMSA e organismos internacionais | Sistema WAHIS/OMSA e outros | Dados utilizados pelo DSA para avaliação de riscos, relatórios e análises específicas |
| Dados da Estação Quarentenária de Cananéia - EQC e quarentenários autorizados para importação de aves silvestres | EQC e empresas | Planilhas e informes | Dados utilizados pelo PNSA para avaliação de riscos, relatórios e análises específicas |
| Registros de dados de ensaios laboratoriais de estabelecimentos alvo de certificação para comércio internacional | Empresas e laboratórios credenciados | Planilhas e informes | Dados utilizados pelo PNSA para avaliação de riscos, relatórios e análises específicas |
¶ 9. COMPONENTES DO SISTEMA DE VIGILÂNCIA
Cada componente do sistema de vigilância compreende uma atividade utilizada para investigar um ou mais perigos na população-alvo. O conjunto dos componentes ou atividades de vigilância capazes de produzir dados sobre a condição da doença em particular, ou sobre a condição de uma população específica, constitui um sistema de vigilância.
Esse Plano fundamenta-se nas diretrizes propostas pela OMSA e pela Organização das Nações Unidas para a Alimentação e Agricultura (FAO) em seus documentos, notadamente o “Código Sanitário dos Animais Terrestres” e o “Manual de Provas de Diagnóstico e Vacinas”, da OMSA, e o “Manual para Vigilância de Doenças, Baseada em Risco”, da FAO.
Levando em consideração as diversidades regionais e os sistemas produtivos, o Plano de vigilância da IA e DNC busca estabelecer um programa com melhor eficácia e custo-benefício, em especial no que diz respeito à existência de riscos diferenciados de ocorrência das doenças, nas diferentes localidades e tipos de estabelecimentos de produção do País.
É importante ressaltar que a execução satisfatória de todos os componentes, de acordo com o preconizado neste Plano, é essencial para que o sistema de vigilância atinja os objetivos esperados e a abrangência da população de aves.
O Plano de vigilância de IA e DNC é composto pelos cinco componentes abaixo, ilustrados na Figura 8:
o de vigilância de IA e DNC é composto pelos cinco componentes abaixo, ilustrados na Figura 8:
1. VIGILÂNCIA PASSIVA: INVESTIGAÇÕES DE CASOS SUSPEITOS DE SRN
2. VIGILÂNCIA PASSIVA: INVESTIGAÇÃO DE MORTALIDADE EXCEPCIONAL DE AVES SILVESTRES
3. VIGILÂNCIA ATIVA EM AVICULTURA INDUSTRIAL
4. VIGILÂNCIA ATIVA EM AVES DE SUBSISTÊNCIA EM ÁREAS DE MAIOR RISCO DE INTRODUÇÃO DE IA
5. VIGILÂNCIA ATIVA EM COMPARTIMENTOS LIVRES DE IA E DNC
¶
9.1 COMPONENTE 1 – VIGILÂNCIA PASSIVA: INVESTIGAÇÕES DE CASOS SUSPEITOS DE SRN
A vigilância passiva é um importante componente para a manutenção da capacidade do sistema de informação em saúde animal, fluxo de envio de amostras para diagnóstico, capacidade laboratorial e de gestão de emergências, condições essenciais para manter a prontidão para resposta rápida. Além disso, os dados resultantes da vigilância passiva contribuem para a comprovação da ausência das doenças no sistema produtivo.
A Instrução normativa MAPA nº 50/2013 determina a notificação imediata obrigatória de qualquer suspeita de IA e DNC, que são as doenças-alvo da vigilância da Síndrome Respiratória e Nervosa das Aves (SRN). Esse é o componente de vigilância mais importante para a detecção precoce da IAAP e da DNC.
Destaca-se a importância da rede de unidades veterinárias locais e escritórios de atendimento à comunidade existente no país, que possibilita um acesso fácil por parte das comunidades e um rápido atendimento às suspeitas notificadas.
A investigação clínica e epidemiológica dos casos suspeitos deve ser realizada em prazo de até 12h pelo médico veterinário do serviço oficial de saúde animal, cuja avaliação deverá definir a necessidade de colheita de amostras para diagnóstico laboratorial no laboratório nacional de referência LFDA/SP, conforme as definições de caso descritas nas respectivas Fichas Técnicas.
http://sistemasweb.agricultura.gov.br/pages/fichas_tecnicas/ficha-tecnica-NEWCASTLE-maio-2021.pdf
¶ 9.1.1 Investigação de suspeitas em aves de produção e subsistência
A maior parte dos esforços da vigilância passiva se direciona para aves domésticas, considerando a avicultura de produção e as criações de subsistência.
Aqueles que mantêm contato diário com as aves, como tratadores, gerentes de granjas ou veterinários locais, bem como o pessoal envolvido no trabalho de campo têm um papel fundamental na detecção precoce e devem ser capazes de reconhecer os sinais da doença e notificá-los imediatamente ao serviço oficial de saúde animal, permitindo a contenção rápida e eficaz de focos.
¶ 9.1.2. Investigação de suspeitas em abatedouros
Os estabelecimentos de abate de aves constituem importante fonte de informações para o sistema de vigilância, por ser um ponto de convergência de grande número de aves oriundas de várias granjas e municípios. Entretanto, as aves que são enviadas a abatedouros tendem a ser jovens e saudáveis, representando um importante viés de amostragem. Além disso, de acordo com dados de focos de IA na Europa, a probabilidade de detecção de IAAP no momento da inspeção é muito baixa, pois a alta mortalidade da doença impede que as aves cheguem ao estabelecimento de abate.
Ainda assim, as inspeções realizadas na rotina ante e post mortem pelos médicos veterinários dos serviços oficiais de inspeção podem eventualmente detectar a presença de sinais clínicos e lesões compatíveis com a IA e DNC. Em caso de detecção de aves com sinais clínicos ou lesões compatíveis com a IA e a DNC ou ao se verificar a presença de aves moribundas ou mortas na plataforma de recepção, o serviço de inspeção oficial deve comunicar imediatamente o serviço oficial de saúde animal mais próximo para realizar a investigação clínica e epidemiológica, conforme previsto no Ofício-Circular Conjunto Nº 3/2021/DSA/DIPOA/SDA/MAPA https://www.gov.br/agricultura/pt-br/assuntos/sanidade-animal-e-vegetal/saude-animal/programas-de-saude-animal/pnsa/2021_03.DSA.DIPOA.SEI_MAPA15035292OfcioCircularConjunto.pdf
¶ 9.1.3 O papel das instituições de ensino ou pesquisa e laboratórios privados de diagnóstico
A inserção das instituições de ensino ou pesquisa e dos laboratórios de diagnóstico privados no sistema de notificação ao SVO possui especial importância para a detecção precoce de casos suspeitos. Nestes laboratórios, profissionais da área e professores de universidades são rotineiramente acionados pelas empresas integradoras, produtores e veterinários responsáveis pelos estabelecimentos de criação para diagnósticos de outras doenças, que não as de controle oficial.
Em caso de ocorrência de IA ou DNC em granjas industriais, é possível que estes laboratórios recebam amostras de casos suspeitos, antes mesmo da notificação ou atendimento do SVO. Uma vez que as amostras provêm de aves clinicamente doentes, podendo incluir casos de IA ou DNC, estas representam um alto valor de vigilância para a detecção precoce. Portanto, em condições que caracterizam casos suspeitos dessas doenças, estes laboratórios devem notificar imediatamente o serviço oficial de saúde animal para investigações, conforme apresentado nas fichas técnicas das doenças. Qualquer detecção de IA ou DNC em aves domésticas ou silvestres, tanto do subtipo de alta quanto de baixa patogenicidade, deve ser imediatamente comunicada ao serviço oficial de saúde animal para que as medidas adequadas possam ser tomadas.
O SVO de cada unidade federativa deve manter atualizado os contatos dos laboratórios de diagnóstico, privados, das universidades ou instituições de pesquisa, e realizar contatos periódicos para intercâmbio de informações, sensibilização, esclarecimentos quanto às obrigações em relação à notificação de doenças.
¶ 9.2 COMPONENTE 2 - VIGILÂNCIA PASSIVA: INVESTIGAÇÃO DE MORTALIDADE EXCEPCIONAL DE AVES SILVESTRES
A infecção por vírus Influenza A, tanto de alta quanto de baixa patogenicidade, e a infecção por paramixovírus aviário tipo-1 (APMV-1) podem causar mortalidade em uma grande variedade de aves silvestres, principalmente nas aquáticas migratórias, que representam os maiores riscos de introdução da IA no país.
A investigação sistemática de eventos de mortalidade excepcional dessas aves na natureza, principalmente em áreas de concentração para aves aquáticas migratórias, , pontos aquáticos de parada e outros corpos d’água, visando determinar se a IAAP ou a DNC está causando as ocorrências, oferece grande oportunidade de detecção dos vírus no País, para conhecimento da situação sanitária de populações silvestres e para que medidas de proteção dos plantéis de produção possam ser intensificadas, mitigando os riscos de introdução.
Entende-se por eventos de mortalidade excepcional em aves silvestres as situações em que são encontradas aves mortas ou doentes em número acima do normalmente observado e por causa desconhecida, excluindo-se, por exemplo, ações antrópicas (envenenamentos, acidentes químicos, morte por armas, bombas, armadilhas, etc.) e fenômenos naturais (tempestades, terremotos, secas, enchentes, furacões e florações de algas nocivas, etc.).
As aves de interesse desse componente da vigilância são, prioritariamente, as aves aquáticas migratórias, ou seja, aquelas que, pelo menos parte de sua população, realizam movimentos cíclicos e sazonais com alta fidelidade aos seus sítios de reprodução, associados a ambientes aquáticos, tais como os anseriformes (patos, gansos e marrecos) e os charadriiformes (gaivotas, jaçanã, maçaricos e trinta-réis).
Órgãos, agências e organizações governamentais e não governamentais que atuam na gestão ambiental e na conservação de recursos naturais são atores essenciais para a detecção de casos suspeitos de IA e DNC a partir de eventos de mortalidade excepcional envolvendo aves silvestres de interesse. Eventos de alta mortalidade envolvendo a vida selvagem são frequentemente observados por diferentes atores, entretanto, a caracterização como casos suspeitos de doenças de controle oficial requer acurada observação de sinais clínicos e verificação de critérios que levem a considerar uma anormalidade digna de investigação clínica, epidemiológica e laboratorial por parte do SVO, sob pena de sobrecarregar os serviços veterinários e os laboratórios com ocorrências não procedentes e sem relevância epidemiológica. A capacitação de agentes em órgãos ambientais das diferentes esferas (federal, estadual e municipal) pode minimizar erros de interpretação de casos de mortalidade em campo, uma vez que são os principais acionados nesses eventos e possuem, em geral, maior compreensão das espécies envolvidas e sua ecologia.
Dessa forma, a definição de critérios para o que deve ser investigado pelo SVO, a partir de eventos de mortalidade excepcional em aves silvestres é difícil, mas deve ser buscada e aperfeiçoada continuamente pelo SVO em conjunto com as instituições e atores que atuam na gestão e conservação do meio ambiente e a sociedade em geral.
Para otimizar a vigilância, elevando as chances de detecção com uso racional de recursos, as localidades prioritárias de investigação de eventos excepcionais, como parte da vigilância de IA e DNC, são as áreas de concentração para aves aquáticas migratórias ou locais próximos a elas, pontos aquáticos de parada e outros corpos d’água. Esses locais são os de maior risco de ocorrência de infecções por vírus Influenza A e paramixovírus aviário tipo-1 em aves silvestres, devido à presença dos principais grupos taxonômicos suscetíveis, à aglomeração e ao fluxo de animais de diferentes origens, que possam carrear os vírus. Nesse sentido, espera-se que a rotina de visualização dessas localidades permita gerar o conhecimento de um histórico mínimo que auxilie na caracterização da excepcionalidade da mortalidade observada, tanto pelos técnicos do setor ambiental quanto por demais membros da sociedade, como ornitólogos, turistas, produtores rurais e comunidades locais.
Essa abordagem pode ser fortalecida por meio de ações de educação e comunicação em saúde animal sendo difundida em diferentes canais de comunicação de acordo com cada público-alvo.
A seguir estão listados alguns critérios que devem ser utilizados para a caracterização dos eventos excepcionais de mortalidade de aves silvestres de relevância para investigação oficial, que visam orientar os atores notificantes e o SVO, considerando o cenário atual das doenças no Brasil. Tais parâmetros são muito úteis, principalmente, nas situações de ausência de histórico da localidade sob notificação.
● Verificar se as espécies envolvidas correspondem ao perfil de maior interesse, ou seja, se são aves aquáticas migratórias: com comportamento gregário (formação de bandos ou colônias), alimentação, descanso, nidificação ou reprodução associados a ambientes aquáticos, anatomia adaptada a ambientes aquáticos (membranas interdigitais para nado ou pernas finas e alongadas para caminhada em ambientes alagados), bico em forma de espátula para apanha de plantas aquáticas ou finos e alongados para pesca. A classificação na Ordem Anseriformes (patos, gansos e marrecos) ou Charadriiformes (gaivotas, jaçanã, maçaricos e trinta-réis) é um bom indicador;
● Verificar se a localidade se trata de ambiente aquático ou próxima a estes: pântano, lago, lagoa, mangue, estuário, rio, córrego, represas, mar, restinga e outros. Uma atenção especial deve ser dada a localidades reconhecidas pelas instituições como sítios de aves aquáticas migratórias ou pontos aquáticos de parada;
● Verificar se houve mortalidade de pelo menos um grupo de aves ou se as mesmas se encontram moribundas (sinais de morte iminente). Uma ou poucas aves encontradas mortas ou moribundas, isoladamente, não caracteriza um evento de mortalidade excepcional;
● Verificar, se disponível, os históricos de investigações anteriores e, a situação epidemiológica da região a fim de se identificar se o relato do notificante corresponde à situação diferente do que poderia ser considerado normal para determinada localidade ou a outra causa já ocorrida anteriormente;
● Descartar, se possível, causas antrópicas de mortalidade, tais como envenenamentos, acidentes químicos e morte por armas, bombas ou armadilhas, verificando informações detalhadas prestadas pelo notificante, rumores, notícias veiculadas na mídia e relatos de outros frequentadores e moradores da região; e
● Descartar, se possível, causas por fenômenos naturais, tais como tempestades, terremotos, secas, enchentes, furacões e florações de algas nocivas, verificando informações prestadas pelo notificante, rumores, notícias veiculadas na mídia e relatos de outros frequentadores da região.
Os órgãos e as entidades estaduais e federais devem desenvolver ações de cooperação para implementação efetiva desse componente da vigilância, com a participação de todos os atores relevantes, de modo que sejam caracterizadas corretamente as situações de suspeitas e realizadas amostragens adequadas e diagnósticos laboratoriais de forma tempestiva e precisa para a confirmação de casos ou o descarte da suspeita de infecções por vírus Influenza A e APMV-1 em aves silvestres. O monitoramento dos vírus da Influenza A também deve ser conduzido para determinar se novos rearranjos ou mutações virais estão ocorrendo, o que pode gerar novos agentes que afetem a saúde humana ou das aves.
As instituições envolvidas devem seguir os fluxos de informação e o Plano de comunicação estabelecidos pelo MAPA e serviços veterinários estaduais, desde a notificação até a confirmação de casos, visando evitar rumores e notícias indevidas que possam causar reações exageradas por parte das comunidades e dos mercados importadores de produtos avícolas. Nesse sentido, está sendo estruturada a “Rede nacional de notificação de doenças de animais silvestres”, na qual as definições de fluxos e comunicações estão sendo tratadas com as instituições participantes.
Para que a vigilância de doenças em aves silvestres de interesse seja realmente efetiva, as instituições em todos os níveis devem facilitar a comunicação e fluxos de amostras entre as instituições estaduais e federais e organizações envolvidas na vigilância, assim como estabelecer previamente as ações a serem adotadas em casos de confirmações de infecção por vírus Influenza A em aves silvestres.
Os registros de investigações dos eventos de mortalidade excepcional de aves silvestres devem fazer parte da avaliação da sensibilidade da vigilância.
Quando da ocorrência de casos prováveis ou confirmados em aves silvestres, não haverá interdição de estabelecimentos próximos ou da área da ocorrência ou qualquer outra ação restritiva. O SVO realizará a investigação nos estabelecimentos próximos da área de ocorrência e adotará medidas de contingenciamento. Devem ser seguidos os procedimentos e orientações das Fichas Técnicas e do Manual de colheita, armazenamento e encaminhamento de amostras do DSA, com adoção das medidas de reforço da biosseguridade nas criações de aves de produção, visando evitar a transmissão a estes estabelecimentos.
A interação com as instituições que trabalham na gestão do meio ambiente e conservação de espécies silvestres constitui um mecanismo fundamental para o intercâmbio de informações, envio de amostras para diagnóstico laboratorial e compartilhamento de ações e recursos, visando a vigilância das doenças. No Brasil, o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (Ibama) e o Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio) constituem os principais atores na gestão e conservação do meio ambiente, sendo de grande relevância para a vigilância de doenças em espécies silvestres.
¶ 9.3 COMPONENTE 3 – VIGILÂNCIA ATIVA EM AVICULTURA INDUSTRIAL
Esse componente do sistema de vigilância visa, através de uma amostragem, robusta e representativa, detectar a presença da DNC e da IA, caso estejam presentes na Avicultura Industrial no Brasil. A não detecção das doenças-alvo, por esse esforço de vigilância ativa, confere segurança à certificação da sua ausência na avicultura industrial.
Caso os serviços oficiais de saúde animal das UF desenvolvam conhecimentos e proponham estudos mais específicos para identificação de áreas ou propriedades de maior risco de introdução de IA, diferentes do proposto neste plano, poderão apresentá-los ao DSA para avaliação e alteração das estratégias de amostragem nos próximos ciclos de vigilância.
Foi planejado estudo transversal com estratégia de amostragem em duas etapas, sendo a primeira referente à seleção das granjas de acordo com os riscos atribuídos às diferentes atividades realizadas nos estabelecimentos avícolas (European Food Safety Authority, 2012; Stärk et al., 2006) e a segunda direcionada para a definição do número de animais a serem amostrados dentro desses estabelecimentos selecionados (Cameron and Baldock, 1998; Humphry et al., 2004).
Para o atendimento dos objetivos deste estudo, a população da avicultura industrial foi definida como o conjunto de estabelecimentos criadores de galinhas, perus, patos e codornas com capacidade de alojamento maior que 1000 aves. O grupo exclui criadores com fins de subsistência, ornamentais ou outros propósitos que não pertençam à cadeia de produção de alimentos (carne e ovos).
Uma vez que o Brasil abriga diversas espécies de aves aquáticas migratórias, foi incluído à primeira etapa da amostragem um critério para seleção de propriedades em municípios nos quais já foi identificada a presença de aves migratórias de importância epidemiológica para as doenças-alvo deste plano de vigilância.
A utilização de fatores de risco adicionais para detecção de IA, se deve ao fato desta doença nunca ter sido detectada no Brasil, à grande disponibilidade de referências na literatura e à sua alta relevância para o país. Considerando as semelhanças dos quadros clínicos agudos dessas doenças que fazem parte da SRN, a estratégia é vantajosa inclusive para a detecção da DNC.
Várias estratégias de delineamento amostral para estudos de detecção da influenza aviária em aves foram consultadas, incluindo, entre outros, os programas de países da União Europeia e dos Estados Unidos. (Castellan, 2012; EUROPEAN COMMISSION, 2010; USDA APHIS VS, 2013)
A população de referência, sobre a qual será realizada a amostragem, será obtida através das bases de dados de cadastros de estabelecimentos rurais, fornecidas pelos Serviços Veterinários Estaduais ao MAPA. O desenho desse componente passou pelas fases descritas a seguir:
a) Definição das áreas de amostragem
b) Cálculo de tamanho amostral
c) Definição de categorias de risco para estabelecimentos avícolas
d) Período de amostragem
a. Definição das áreas de amostragem
A vigilância ativa é voltada a todo o território nacional e, para tanto, a população avícola foi dividida em sete subpopulações de acordo com suas características geográficas, produtivas e considerando os aspectos práticos de gestão e de logística das divisões administrativas dos estados. Cada uma dessas subpopulações ou áreas de vigilância é objeto de uma amostragem independente. As áreas definidas foram:
- Área 1 (Rio Grande do Sul)
- Área 2 (Santa Catarina)
- Área 3 (Paraná)
- Área 4 (região Sudeste)
- Área 5 (região Nordeste)
- Área 6 (região Norte) e
- Área 7 (região Centro-Oeste)
b. Cálculo de tamanho amostral
A população-alvo considerada para o desenho amostral desse componente é formada pelos estabelecimentos criadores de galinhas, patos, perus e codornas cujo total de animais ultrapasse 1000. Dentro de cada área de amostragem, a população de estudo está distribuída de acordo com o risco relacionado ao tipo de atividade avícola praticada e sua proporção na população.
O cálculo do tamanho da amostra foi realizado em dois estágios. Em relação ao primeiro estágio (número de granjas), onde presume-se uma prevalência de 1% entre granjas e um nível de confiança de 95%, esperando-se que, caso a IA ou a DNC estejam presentes nessas áreas, ao menos 1% das granjas estaria infectada.
Em relação ao segundo estágio (número de aves por granja) o tamanho amostral será determinado com base numa prevalência estimada nas granjas de 30% e um nível de confiança de 95%, esperando-se que, caso a IA ou a DNC estejam presentes em uma granja, pelo menos 30% das aves estariam infectadas.
Seguindo esses parâmetros, 11 aves serão amostradas aleatoriamente em cada núcleo da granja. Havendo vários galpões em um núcleo ou granja, as amostras devem ser distribuídas ao máximo entre os galpões, considerando as premissas de que num eventual surto de IA pelo menos 30% dos galpões serão afetados e de que não haverá mais de 50 galpões por estabelecimento (EUROPEAN COMMISSION, 2010; USDA APHIS VS, 2013).
Os parâmetros de diagnósticos considerados para a elaboração do desenho apresentado são 95% e 95% de sensibilidade para os testes “ELISA para IA” e “PCR para DNC”, respectivamente. A especificidade foi considerada de 100% para o protocolo de diagnóstico, associado aos procedimentos de investigação clínica e epidemiológica e aos testes complementares previstos neste Plano.
Os tipos de estabelecimentos e suas categorias de risco foram definidos considerando-se a ausência de IA e DNC no Brasil, o histórico de ocorrência em outros países (European Food Safety Authority, 2017; WAHIS, OMSA), planos de vigilância elaborados por outras entidades de saúde animal, e condições ambientais e produtivas no território brasileiro. Os aspectos de maior relevância para essa categorização foram, nessa ordem de importância: a susceptibilidade das espécies presentes, a duração do ciclo de produção dos animais e o impacto das práticas de manejo, saúde e biosseguridade.
- RISCO MUITO BAIXO → Estabelecimentos criadores de frangos de corte
- RISCO BAIXO → Estabelecimentos criadores de galinhas para reprodução (matrizeiros, avozeiros, bisavozeiros, ou animais de linhagens puras)
- RISCO MODERADO → Estabelecimentos criadores de galinhas de postura
- RISCO ALTO → Estabelecimentos criadores de patos, perus e codornas
c. Amostragem incremental
A amostragem incremental tem o objetivo de aumentar a sensibilidade do componente ao considerar a presença de sítios de aves migratórias nos municípios (Stärk et al., 2006). Dessa forma foi realizada a seleção de mais estabelecimentos, equivalente a 10% da amostragem inicial, exclusivamente nos municípios que foram identificados sítios de aves migratórias neárticas dos grupos de espécies Charadriiformes e Anseriformes (Liang et al., 2020; Velkers et al., 2021).
Os demais critérios e estratégias seguem o mesmo desenho utilizado para a amostragem inicial (mínimo de 1.000 aves no estabelecimento, categorização por tipo de atividade, nível do risco aplicado e desenho amostral).
A relação dos estabelecimentos a serem amostrados será elaborada anualmente pelo DSA, em conjunto com o OESA de cada UF. No entanto, ao avaliar o estabelecimento selecionado, o técnico do OESA, responsável pela colheita, deverá certificar se ele possui as características necessárias para se enquadrar na categoria que lhe foi atribuída, conforme descrito neste Plano.
A tabela 3 apresenta um exemplo da composição do processo de estratificação da amostra entre as categorias de granjas de acordo com o risco para IA e sua frequência e a distribuição da amostra na área epidemiológica.
Tabela 3. Exemplo de estratificação da amostragem entre categorias de granjas de acordo com o risco, a frequência e a proporção na área epidemiológica.
| Itens | Granjas de frangos de corte | Granjas de postura comercial | Granjas de Reprodução | Granjas de patos, perus, codornas | Total |
|---|---|---|---|---|---|
| 1. Risco atribuído às categorias (Peso) | 0.04 | 0.30 | 0.18 | 0.47 | 1 |
| 2. Proporção da categoria na população da área epidemiológica (exemplo) | 0.4 | 0.35 | 0.2 | 0.05 | 1 |
| 3. Peso combinado (1x2) | 0.02 | 0.11 | 0.04 | 0.02 | 0,19 |
| 4. Peso da categoria na distribuição amostral | 0.09 | 0.58 | 0.20 | 0.13 | 1 |
| 5. Distribuição de granjas na área epidemiológica | 30 | 182 | 63 | 41 | 315 |
| 6. Distribuição de granjas na área de maior risco | 3 | 18 | 6 | 4 | 32 |
| 7. Total de granjas a amostrar na área epidemiológica | 33 | 200 | 69 | 45 | 347 |
Todos os cálculos propostos são simulados nos pacotes “epiR” e “base” do programa R. (Nunes et al., 2020; R Core Team, 2019).
d. Período de amostragem
Considerando a sazonalidade das migrações das aves neárticas em relação à América do Sul, que ocorre, historicamente, a partir dos meses de setembro/outubro e termina nos meses de abril/maio, e que o objetivo deste componente é detectar a presença da IA e DNC na avicultura industrial, os meses de junho a novembro devem ser priorizados para a realização das colheitas.
O referido período é imediatamente posterior ao retorno das aves neárticas para seus sítios de reprodução. Assim, as aves já passaram por todo o período de maior probabilidade de contato eventual com aves migratórias e há uma maior probabilidade de se detectar a infecção, caso esteja presente na população de avicultura industrial.
¶ 9.4 COMPONENTE 4 – VIGILÂNCIA ATIVA EM AVES DE SUBSISTÊNCIA EM ÁREAS DE MAIOR RISCO DE INTRODUÇÃO DE IA
As criações de aves de subsistência podem ser consideradas sentinelas para a vigilância de doenças aviárias de interesse para a avicultura nacional, principalmente aquelas localizadas em áreas de maior risco de contato com aves aquáticas migratórias. A priorização da amostragem em criações de subsistência onde possa haver contato com aves aquáticas migratórias é uma importante estratégia a ser adotada para a detecção de IA e DNC, visto que a maioria dos casos de introdução do vírus e de ocorrência de surtos em outros países tinha essa relação.
Dada a condição do Brasil ser habitat de uma vasta população de aves migratórias, que possuem rotas de migração inclusive trans hemisféricas, esse componente é fundamental à busca ativa de doenças das aves.
A vigilância ativa da IA e da DNC em criadouros próximos a sítios de aves aquáticas migratórias é realizada há muitos anos no Brasil, seguindo critérios técnicos para a definição do plano amostral de colheita de amostras que obteve resultados de detecção de anticorpos contra a IA.
Além disso, a presença do SVO nestes locais é uma grande oportunidade para ações de comunicação de risco e educação, visando maior engajamento dos produtores para a notificação de suspeitas de doenças e de mortalidade em aves, considerando que a experiência de outros países demonstrou que a introdução da IAAP em determinadas regiões por aves silvestres normalmente é sinalizada pela mortalidade de aves de fundo de quintal, além da mortalidade de aves silvestres no ambiente natural.
Aproveitando as atividades de vigilância nos estabelecimentos de fundo de quintal, as equipes do SVO também devem vistoriar os sítios de aves migratórias para avaliar a presença de aves mortas ou moribundas. Nestes casos, devem ser realizadas colheitas de amostras dessas aves. Nas aves doentes ainda vivas, que se consiga capturar, devem ser colhidas amostras de sangue para obtenção de soros, suabes de traqueia e de cloaca. Nas aves recentemente mortas, devem ser colhidos órgãos e, quando possível, suabes de traqueia e de cloaca.
Este componente foi reformulado visando dar melhor delineamento, ampliar a abrangência, a sensibilidade e a especificidade das amostragens, além de aperfeiçoar os critérios de regularidade, temporalidades e de seleção dos locais de interesse para a vigilância.
Cabe destacar que a estratégia de amostragem desse componente visa buscar a detecção de IA e DNC em populações de aves de subsistência localizadas em áreas de risco, por maior probabilidade de exposição a aves migratórias, e que apresentem maiores densidades de aves ou estabelecimentos de produção industrial, visando não somente a pesquisa de ocorrência dos vírus, mas também oferecer alertas de ocorrências em locais com impacto aos sistemas de produção do país, permitindo a adoção de medidas de reforço da biosseguridade e proteção da avicultura industrial.
Para isso, foi utilizada uma extensa base de dados cedida pelo CEMAVE/ICMBio sobre locais com registros de presença de aves migratórias, detectadas por meio de avistamento e pesquisas em campo. Devido à grande quantidade de espécies e locais de avistamentos existentes no Brasil, foram adotados quatro critérios para seleção dos locais para realização da vigilância:
1. presença de aves migratórias das famílias de maior importância epidemiológica para a transmissão da IAAP, representadas pelos Anseriformes (Anatidae) e Charadriiformes (Charadriidae);
2. espécies que têm como padrão de migração as rotas oriundas do Hemisfério Norte (neárticas), pois são as que apresentam maior risco de introdução da IA no país, considerando que a América do Sul permanece livre da IAAP.
No caso da Região Sul, foram consideradas também as rotas específicas do continente sul-americano, prevendo a inclusão de municípios com presença de aves migratórias dessa região;
3. concentração de criações de aves na região; e
4. presença de avicultura industrial (estabelecimentos com mais de mil aves) nos municípios de localização dos sítios. Visando otimizar o uso de recursos, a associação entre a detecção precoce de eventual introdução de cepas do vírus da IAAP em criações de fundo de quintal, em municípios onde pudessem ter impactos a sistemas industriais, permite a adoção rápida de medidas sanitárias e de biosseguridade para evitar o ingresso nessas granjas.
A relação de localidades selecionadas para amostragem deverá ser avaliada pelos OESA, permitindo a estes propor inclusões ou substituições de locais, considerando os seguintes critérios para justificar as alterações: 1. municípios com sítios de assentamento de aves migratórias de interesse; 2. presença significativa de aves de subsistência, mesmo com deficiências de cadastros; e 3. existência de relação importante de trânsito de aves para outras regiões com avicultura industrial. Da mesma forma, os OESA podem solicitar a exclusão de municípios selecionados, caso justifiquem que a seleção feita não corresponda aos critérios apresentados.
Período de amostragem e programação da vigilância
As atividades de vigilância devem ocorrer uma vez ao ano nos locais de risco selecionados, na época em que as aves migratórias estejam em maiores agrupamentos com misturas de espécies e em nidificação. Como há no país diferentes rotas migratórias compostas por diferentes espécies, a melhor época para a vigilância é variável de acordo com a região. De forma geral, as aves silvestres neárticas migram no início do inverno do hemisfério Norte e chegam ao Brasil no período de setembro até dezembro e permanecem até março-abril. Assim, a melhor época para realização das amostragens desse componente é de dezembro a abril.
Entretanto, como há muitas variações dentro do país, a definição de períodos mais específicos de amostragem para cada local de risco selecionado pode ser mais bem estabelecida mediante interação dos SVO com as instituições e organizações de gestão e conservação do meio ambiente presentes nas unidades federativas e com as comunidades das proximidades aos sítios.
O Anexo 1 apresenta o detalhamento do delineamento amostral desse componente.
¶ 9.5 COMPONENTE 5 - VIGILÂNCIA ATIVA EM COMPARTIMENTOS LIVRES DE IA E DNC
A vigilância ativa nos compartimentos livres de IA e DNC é necessária para a manutenção da certificação sanitária mediante comprovação de ausência das doenças.
A Instrução Normativa nº 21, de 21 de outubro de 2014, alterada pela Instrução Normativa nº 18, de 09 de junho de 2017, estabelece os procedimentos principais que devem ser realizados:
Nas granjas de reprodução as amostragens devem ser realizadas a cada seis meses e, nas granjas de frangos de corte, deve ser realizada uma vigilância por amostragem de granjas, a cada seis meses.
As atividades devem envolver avaliações clínicas das aves e colheita de amostras para diagnóstico laboratorial de IA e DNC, executada por veterinários responsáveis técnicos da empresa ou veterinários habilitados, sob coordenação do SVO. Os custos de colheita, envio e processamento de amostras, regulares ou aleatórias, são de responsabilidade da empresa do compartimento.
Cabe destacar que, além das colheitas regulares da vigilância ativa, o SVO pode determinar a realização de outras amostragens a seu critério e a qualquer tempo. Ademais, os protocolos podem ser mais intensivos que o recomendado neste Plano quando visam atender demandas de certificação a parceiros comerciais específicos.
Os ensaios laboratoriais para IA e DNC devem ser realizados em laboratórios públicos credenciados pelo MAPA e os relatórios de ensaios devem conter todas as informações exigidas.
Os relatórios de ensaios cujos resultados forem negativos serão enviados pelo laboratório à SFA, ao SVE e ao responsável pela equipe de gestão do compartimento. Quaisquer relatórios de ensaios cujos resultados não forem negativos, em quaisquer dos ensaios, serão enviados imediatamente pelo laboratório somente ao DSA, à SFA e ao SVE.
Os laboratórios credenciados devem encaminhar as amostras ao LFDA nas seguintes situações: positividade no ensaio de ELISA sem realização do exame de IDGA; ou positividade no teste de IDGA; ou positividade no teste de RT-PCR para gene M para IA ou DNC.
O plano amostral para vigilância de IA e DNC deve seguir o protocolo abaixo, entretanto os critérios poderão ser redefinidos pelo DSA a qualquer tempo, considerando avaliações epidemiológicas.
Protocolo amostral:
colher amostras em todos os núcleos da granja que estiverem com aves com pelo menos 30 (trinta) dias de alojamento;
núcleos de aves de recria vacinados com vacina viva para DNC não devem ser testados para esta enfermidade;
distribuir uniformemente a amostragem entre os galpões de cada núcleo colhendo as seguintes quantidade e amostras:
10 (dez) amostras individuais de sangue para obtenção de soro sanguíneo;
10 (dez) suabes de traqueia divididos em dois pools, sendo cada pool com cinco suabes; e
10 (dez) suabes de cloaca divididos em dois pools, sendo cada pool com cinco suabes.
Colher as amostras de suabes das mesmas 10 (dez) aves que foram colhidas as amostras de soro.
Os resultados e dados de vigilância para a emissão de certificado zoossanitário internacional (CZI) para exportação de ovos férteis e aves vivas também devem ser computados e compilados, mantendo um fluxo padronizado de informações da vigilância nesses estabelecimentos.
¶ 10. DIAGNÓSTICO LABORATORIAL
¶ 10.1 VIGILÂNCIA PASSIVA:
Para os casos suspeitos de síndrome respiratória e nervosa das aves (SRN), identificados na vigilância passiva, deve-se proceder conforme o preconizado nas respectivas fichas técnicas de IA e DNC.
A identificação de um caso provável de IA ou DNC, pelo serviço oficial de saúde animal, requer a colheita de amostras para a realização de testes diagnósticos em laboratórios oficiais do MAPA - os Laboratórios Federais de Defesa Agropecuária (LFDA). Atualmente, as amostras da vigilância passiva são enviadas e analisadas no LFDA/SP, em Campinas-SP.
O LFDA/SP, sediado em Campinas, dispõe de laboratório de segurança biológica NB3 e é reconhecido pela OMSA como referência para o diagnóstico da IA e DNC.
Legenda:
IAV: vírus da influenza A
HI: inibição de hemaglutinação
ICPI: índice de patogenicidade intracerebral
IVPI: índice de patogenicidade intravenosa
NDV: vírus da doença de Newcastle
NDV-F: gene F do vírus da doença de Newcastle
NDV-M: gene M do vírus da doença de Newcastle
NI: inibição da neuraminidase
RT-qPCR: reação da transcriptase reversa seguida de reação em cadeia da polimerase em tempo real
¶ 10.2 VIGILÂNCIA ATIVA:
Para realização dos testes da vigilância ativa de IA e DNC, neste primeiro ciclo será utilizado o Laboratório Federal de Defesa Agropecuária – LFDA, em Campinas-SP.
Visando ampliar a rede de diagnósticos de triagem para a vigilância ativa, poderão ser incluídos os laboratórios estaduais oficiais devidamente credenciados junto ao MAPA para as provas definidas nos protocolos de diagnóstico.
O fluxo simplificado e os testes laboratoriais da vigilância ativa podem ser visualizados na figura abaixo.
Legenda:
AGID: imunodifusão em gel de ágar
ELISA: ensaio enzimático imunoadsorvido
IAV: vírus da influenza A
HI: inibição de hemaglutinação
ICPI: índice de patogenicidade intracerebral
IVPI: índice de patogenicidade intravenosa
NDV: vírus da doença de Newcastle
NDV-F: gene F do vírus da doença de Newcastle
NDV-M: gene M do vírus da doença de Newcastle
NI: inibição da neuraminidase
RT-qPCR: reação da transcriptase reversa seguida de reação em cadeia da polimerase em tempo real
Tabela 4. Responsáveis, tipos de amostras, laboratórios, sistemas de registros da vigilância e periodicidade.
| Tipo de Amostragem | Responsável pela colheita | Tipo de amostra | Laboratório | Sistema de registro de dados | Inserção de dados |
|---|---|---|---|---|---|
| Investigações de casos suspeitos de SRN em aves de produção | OESA | Suabes de traqueia e cloaca e órgãos de eleição | LFDA/SP | e-Sisbravet | Imediato e contínuo |
| Investigação de eventos de mortalidade excepcional de aves silvestres | Órgãos ambientais em articulação com o OESA | Suabes de traqueia e cloaca e órgãos de eleição | LFDA/SP | e-Sisbravet | Imediato e contínuo |
| Vigilância ativa em avicultura industrial | OESA | Soro sanguíneo, suabes de traqueia e cloaca | LFDA/SP | SIGEP ou outro | Conforme andamento das atividades |
| Vigilância ativa em aves de subsistência em áreas de maior risco | OESA | Soro sanguíneo, suabes de traqueia e cloaca | LFDA/SP | SIGEP ou outro | Conforme andamento das atividades |
| Vigilância ativa em compartimentos livres de IA e DNC | Médico veterinário RT da empresa | Soro sanguíneo, suabes de traqueia e cloaca | Laboratório público credenciado ou LFDA/SP | Relatórios das empresas enviados às SFA | Conforme andamento das atividades |
¶ 11. AVALIAÇÃO DE DESEMPENHO DOS COMPONENTES
O Plano de vigilância de IA e DNC inclui indicadores e metas objetivas que permitem a avaliação do desempenho do sistema, visando o adequado monitoramento e correções de desvios e deficiências referentes às investigações e eventuais aplicações de medidas.
A avaliação dos indicadores de performance do Plano de vigilância faz parte da compilação e análise dos resultados obtidos em cada um dos componentes e será efetuada pela coordenação do PNSA, com o apoio dos pontos focais nas SFA e OESA em cada unidade federativa. Serão inseridos nos Relatórios Semestrais de cada unidade federativa envolvida, visando avaliar o cumprimento das metas de vigilância e serão encaminhados ao Departamento de Saúde Animal. Esses dados serão compilados pelo DSA e subsidiarão a formulação do relatório anual, conforme descrito no item 15.
Para o presente plano foram propostos indicadores para avaliação dos seguintes aspectos de desempenho, descritos nas tabelas a seguir:
A. representatividade geográfica;
B. representatividade dos tipos de produção/faixa etária;
C. representatividade temporal;
D. consistência dos resultados em relação às definições de caso;
E. oportunidade da vigilância.
Tabela 5. Componentes e indicadores para avaliação da representatividade geográfica da amostragem.
| Componente | Características avaliadas | Indicador | Meta |
|---|---|---|---|
| Investigações de casos suspeitos de SRN em aves de produção | A distribuição geográfica das notificações e investigações de suspeitas deve refletir a distribuição da população de aves | NA | NA |
| Investigação de eventos de mortalidade excepcional de aves silvestres | A distribuição geográfica das notificações e investigações de suspeitas deve refletir a distribuição da população de aves aquáticas migratórias | NA | NA |
| Vigilância ativa em avicultura industrial | A amostragem nas unidades federativas e municípios deve se aproximar da distribuição das unidades de produção selecionadas, com menor grau de substituição. | % de estabelecimentos selecionados com realização de colheita | 95% |
| Vigilância ativa em aves de subsistência em áreas de maior risco | A amostragem em aves de subsistência deve ocorrer em todas as áreas de maior risco descritas nesse Plano de vigilância. | % de áreas de maior risco selecionadas com amostragem | 95% |
| Vigilância ativa em compartimentos livres de IA e DNC | A amostragem envolverá todos os compartimentos | % de compartimentos com colheita | 100% |
Tabela 6. Componentes e indicadores para avaliação da representatividade amostral por tipos de produção/faixa etária
| Componente | Características avaliadas | Indicador | Meta |
|---|---|---|---|
| Investigações de casos suspeitos de SRN em aves de produção | A distribuição das notificações e investigações de suspeitas deve refletir os tipos de produção existentes na respectiva Área de vigilância. | NA | NA |
| Investigação de eventos de mortalidade excepcional de aves silvestres | Não se aplica | NA | NA |
| Vigilância ativa na avicultura industrial |
O número de estabelecimentos amostrados em cada UF deve refletir a proporção de estabelecimentos por tipo de produção na respectiva área de vigilância. A distribuição das amostras colhidas deve se aproximar da distribuição dos diferentes tipos de estabelecimentos selecionados. A amostragem deve ser feita em aves adultas. |
Nº de estab. amostrados corretamente / Nº de estab. selecionados. % de amostras colhidas de aves adultos. |
95% 100% |
| Vigilância ativa em aves de subsistência nas áreas de maior risco |
Os estabelecimentos amostrados em cada UF devem corresponder ao tipo de criação de subsistência atendendo aos critérios definidos para seleção de estabelecimentos a amostrar. A amostragem deve ser feita em aves adultas. |
Nº de estab. amostrados corretamente / Nº de estab. selecionados. % de amostras colhidas de aves adultos. |
95% 100% |
| Vigilância ativa em compartimentos livres de IA e DNC | As unidades amostradas no compartimento devem ser representativas de todos os núcleos do compartimento. | % de unidades amostradas que atendem aos critérios definidos / total de unidades amostradas. | 90% |
Tabela 7. Componentes e indicadores para avaliação representatividade temporal da amostragem
| Componente | Características avaliadas | Indicador | Meta |
|---|---|---|---|
| Investigações de casos suspeitos de SRN em aves de produção | A distribuição das notificações e investigações de suspeitas deve ser distribuída durante o ano todo, podendo ocorrer variações estacionais. | NA | NA |
| Investigação de eventos de mortalidade excepcional de aves silvestres | A distribuição das Investigação de eventos de mortalidade excepcional de aves silvestres deve ter maior concentração nos meses de migrações de aves neárticas no Brasil. | Nº de investigações dentro do período definido / total investigado | 70% |
| Vigilância ativa em avicultura industrial | As amostragens na avicultura industrial devem ser distribuídas de acordo com os meses definidos no Manual, podendo sofrer pequenas variações, mas não se distribuindo em todos os meses. | Nº de estab. amostrados dentro do período definido / total a ser amostrado | 90% |
| Vigilância ativa em aves de subsistência de áreas de maior risco | As amostragens em aves de subsistência de áreas de maior risco devem ser distribuídas nos meses definidos neste Plano, podendo sofrer pequenas variações, mas não se distribuindo em todos os meses. | Nº de estab. amostrados dentro do período definido / total a ser amostrado | 90% |
| Vigilância ativa em compartimentos livres de IA e DNC | As amostragens em compartimentos livres devem ser realizadas a cada seis meses, podendo sofrer pequenas variações. | Nº de núcleos amostrados a cada 6 meses / total de núcleos existentes | 100% |
Tabela 8. Componentes e indicadores para avaliação da consistência dos resultados com definições de caso
| Componente | Característica | Indicador | Meta |
|---|---|---|---|
| Investigações de casos suspeitos de SRN em aves de produção | As notificações recebidas devem ser classificadas pelo SVO de acordo com a definição de caso suspeito. O atendimento e a caracterização de casos prováveis e confirmados devem seguir ao estabelecido nas Fichas Técnicas | Nº de investigações corretamente classificadas como casos prováveis / total de casos prováveis | 100% |
| Investigação de eventos de mortalidade excepcional de aves silvestres | As notificações recebidas de eventos de mortalidade excepcional de aves silvestres devem ser classificadas pelo SVO de acordo com a definição de caso provável e anormalidades descritas nesse Plano. O atendimento deve seguir os procedimentos previstos e a caracterização de casos prováveis e confirmados descrito nas respectivas Fichas Técnicas | Nº de investigações corretamente classificadas como casos prováveis / total de casos prováveis | 100% |
| Vigilância ativa na avicultura industrial | Os procedimentos de levantamento de informações sobre a caracterização dos estabelecimentos de avicultura industrial selecionados, de colheita de amostras e investigações complementares devem seguir o disposto no Manual. O fluxo e as interpretações dos diagnósticos laboratoriais devem seguir o descrito no manual e estar em acordo com os parâmetros estabelecidos pela OMSA. | % de estabelecimentos amostrados em acordo com o previsto no manual | 95% |
| Vigilância ativa em aves de subsistência de áreas de maior risco | Os procedimentos de levantamento de informações sobre as criações de aves de subsistência em áreas de maior risco, colheita de amostras e investigações complementares para a vigilância devem seguir o disposto no Manual. Os fluxos e as interpretações dos diagnósticos laboratoriais devem seguir o descrito no manual e estar em acordo com os parâmetros estabelecidos pela OMSA. | % de estabelecimentos amostrados em acordo com o previsto no manual | 100% |
| Vigilância ativa em compartimentos livres de IA e DNC | Os procedimentos de levantamento de informações sobre as unidades de colheita das amostras, colheita de amostras e investigações complementares para a vigilância, o fluxo e as interpretações dos diagnósticos laboratoriais devem seguir o disposto neste Plano. | % de amostras em acordo com o previsto | 100% |
Tabela 9. Componentes e indicadores para avaliação da oportunidade do plano de vigilância
| Componente | Característica | Indicador | Meta |
|---|---|---|---|
| Investigações de casos suspeitos de SRN em aves de produção |
Os atendimentos às notificações de suspeitas devem ser realizados em até 12 horas após a notificação. As amostras colhidas de casos prováveis devem chegar ao LFDA em até 48 horas após a colheita. No laboratório, as amostras devem ser processadas com urgência e os resultados disponibilizados em até 24h após o recebimento. |
1.Tempo de reação. 2.Tempo entre a colheita e a chegada ao LFDA. 3.Tempo entre o recebimento da amostra e o resultado. |
1. 12h 2. 48h 3. 24h |
| Investigação de eventos de mortalidade excepcional de aves silvestres |
Os atendimentos às notificações de eventos de mortalidade excepcional em aves silvestres devem ser realizados em até 12 horas após a comunicação. As amostras colhidas de casos prováveis devem chegar o mais rápido possível ao LFDA, não ultrapassando as 48 horas após a colheita. No laboratório, as amostras devem ser processadas com urgência e os resultados devem ser disponibilizados em até 24h após o recebimento. |
1.Tempo de reação; 2.Tempo entre a colheita e a chegada ao LFDA. 3.Tempo entre o recebimento da amostra e o resultado parcial |
1. 12h 2. 48h 3. 24h |
| Vigilância ativa na avicultura industrial |
As amostras oriundas da vigilância ativa na avicultura industrial devem ser enviadas em até 15 (quinze) dias após a colheita. As amostras devem ser estocadas em ultra freezer a -80ºC até o envio. No laboratório, as amostras devem ser processadas em até 7 (sete) dias após o recebimento e os resultados devem ser disponibilizados imediatamente. Amostras positivas nos testes de triagem devem ser processadas em testes confirmatórios em até 48h após os resultados da triagem |
1.Tempo entre a colheita e o envio das amostras; 2.Tempo entre o recebimento no lab. e o resultado 3. Tempo entre o resultado positivo do teste de triagem e o início do teste confirmatório |
1. 15 dias 2. 7 dias 3. 2 dias |
| Vigilância ativa em aves de subsistência das áreas de maior risco |
As amostras oriundas da vigilância em aves de subsistência devem ser enviadas em até 15 (quinze) dias após a colheita. As amostras devem ser estocadas em ultra freezer a -80ºC até o envio No laboratório, as amostras devem ser processadas em até 7 (sete) dias após o recebimento e os resultados dos testes devem ser disponibilizados imediatamente. Amostras positivas nos testes de triagem devem ser processadas em testes confirmatórios em até 48h após os resultados da triagem |
1.Tempo entre a colheita e o envio das amostras; 2.Tempo entre o recebimento no lab. e o resultado 3. Tempo entre o resultado positivo do teste de triagem e o início do teste confirmatório |
1. 15 dias 2. 7 dias 3. 3 dias |
| Vigilância ativa em compartimentos livres de IA e DNC |
As amostras colhidas para a vigilância em compartimentos livres devem ser enviadas o mais rápido possível ao laboratório oficial credenciado, não ultrapassando os 10 (dez) dias após a colheita. Ao chegar ao laboratório, as amostras devem ser processadas com brevidade, dentro de 7 (sete) dias após o recebimento e os resultados dos testes de triagem devem ser disponibilizados rapidamente após obtidos. Amostras positivas nos testes de triagem devem ser enviadas imediatamente ao LFDA/SP para serem processadas em testes confirmatórios em até 48h após os resultados da triagem. |
1.Tempo entre a colheita e o envio das amostras; 2.Tempo entre o recebimento no lab. e o resultado da triagem 3. Tempo entre o resultado positivo do teste de triagem e o início do teste confirmatório |
1. 10 dias 2. 7 dias 3. 3 dias |
¶ 12. AVALIAÇÃO DA SENSIBILIDADE DO SISTEMA DE VIGILÂNCIA
A sensibilidade do sistema de vigilância será estimada ao final do período de 12 meses desde a instituição do plano. A realização das atividades preconizadas, como a investigação de casos suspeitos e o cumprimento das metas das amostragens planejadas são os fatores determinantes para que a sensibilidade atinja níveis satisfatórios. Os cálculos serão realizados de maneira independente para cada uma das sete áreas de amostragem definidas, e a contribuição relativa de cada unidade federativa será avaliada.
¶ 13. SISTEMAS DE NOTIFICAÇÃO E REGISTROS
O registro de notificação de suspeitas de IA e DNC pode ser realizado pela internet, por qualquer tipo de usuário, no endereço do e-Sisbravet (http://sistemasweb.agricultura.gov.br/pages/SISBRAVET.html).
Todas as notificações registradas serão direcionadas à UVL responsável pelo município onde a suspeita for registrada. Outras formas de notificação (presencial, por telefone, correio eletrônico etc.) também devem ser incentivadas, e seguir sendo para que, igualmente, o pronto atendimento pelo serviço oficial de saúde animal seja realizado e registrado no e-Sisbravet.
Todos os atendimentos realizados dentro do “Componente 1 - Vigilância passiva - Investigações de suspeitas de SRN ” e “Componente 2 - Vigilância passiva - Investigação de mortalidade excepcional de aves silvestres” deverão ser registrados IMEDIATAMENTE no e-Sisbravet, cuja finalidade é a gestão dos procedimentos e dados de atendimentos das investigações oficiais realizadas pelas instâncias local, intermediária e superior, referentes a vigilância passiva.
Todas as atividades realizadas para o cumprimento do “componente 3 - Vigilância ativa na avicultura industrial” e do “componente 4 - Vigilância ativa em aves de subsistência das áreas de maior risco de introdução de IA devem ser registradas no Sistema de Gerenciamento de Estudos Epidemiológicos (SIGEP) ou outro sistema definido pelo MAPA, que tem por objetivo facilitar o acompanhamento de estudos epidemiológicos e a gestão dos dados de vigilância ativa conduzidas pelos serviço oficial de saúde animal.
Para o “componente 5 - Vigilância ativa em compartimentos livres de IA e DNC”, os dados de colheitas de amostras e resultados laboratoriais devem ser registrados em sistemas das empresas e dos laboratórios credenciados e remetidos às SFA das unidades federativas de localização das granjas para compilações, análises e envio de alertas e relatórios anuais à coordenação do PNSA.
¶ 14. COMUNICAÇÃO DE RESULTADOS
A compilação e análise dos resultados obtidos em cada um dos componentes desse Plano será efetuada pela coordenação do PNSA, com o apoio dos pontos focais nas SFA e OESA em cada unidade federativa. Serão elaborados Relatórios Semestrais para cada unidade federativa envolvida, visando avaliar o cumprimento das metas de vigilância, e que deverão ser encaminhados ao Departamento de Saúde Animal. Essas informações serão compiladas pelo DSA e subsidiarão a formulação do relatório anual das ações de vigilância de IA e DNC.
As partes interessadas deverão receber relatórios ou informes com análises e ações executadas a partir dos dados do Plano de vigilância, sendo de suma importância que permeiem por todos os elos deste sistema, até chegar ao nível local. O DSA/MAPA disponibilizará os relatórios às SFA e aos OESA pelo Sistema Eletrônico de Informações (SEI) e à população pela página eletrônica do Mapa.
A retroalimentação da informação é uma das características do sistema de vigilância e é importante para manter a cadeia de comunicação ativa entre as partes interessadas, informando adequadamente e estimulando a cooperação, pela percepção da sua contribuição ao processo. Dessa forma, garante a sua inserção efetiva e a qualidade dos dados obtidos.
¶ 15. RECURSOS E FINANCIAMENTO DO PLANO
O Plano de vigilância de IA e DNC deve ser financiado de forma compartilhada por diferentes atores interessados nos benefícios gerados. Há que se estabelecer um acordo de cooperação entre as partes envolvidas na cadeia da avicultura do País de forma que o financiamento seja garantido, com complementação dos setores privados ou pelo MAPA, para sustentar cada componente do sistema de vigilância em todas as UF envolvidas.
Os custos envolvem os recursos humanos, físicos e financeiros, públicos e privados, essenciais para o sucesso de cada um dos componentes do Plano. Em cada UF, os atores envolvidos devem organizar reuniões para definição da distribuição dos custos do sistema de vigilância e avaliações da aplicação dos recursos e da execução das atividades previstas.
A tabela 10 ilustra um exemplo de distribuição dos custos entre os principais atores envolvidos, porém, conforme expressado anteriormente, o arranjo a ser estabelecido entre os atores públicos e privados, deve ser construído observando a organização da cadeia produtiva em cada UF.
É importante destacar que o sistema de vigilância apresentado visa a detecção precoce das doenças, mitigando os impactos econômicos e sociais de eventuais ocorrências, e gera dados para comprovação de ausência das doenças na avicultura industrial, oferecendo segurança à manutenção e abertura de mercados aos produtos e material genético avícola do Brasil.
Dessa forma, percebe-se que os custos do sistema de vigilância são muito inferiores aos benefícios gerados à cadeia produtiva, sendo, portanto, o financiamento compartilhado essencial entre os setores público e privado na aplicação de recursos humanos, físicos e financeiros. Ainda assim, futuras análises de custo-benefício do Plano de vigilância de IA e DNC devem ser realizadas visando identificar as ações mais eficientes e prestar contas à sociedade.
Tabela 10. Proposta para distribuição dos custos em recursos humanos, físicos e financeiros de vigilância entre as partes interessadas
_(1)_(pdf.io).jpg)
Obs.: * O envio de amostras e realização de testes somente nos casos prováveis
** O LFDA/MAPA realizará os testes confirmatórios
¶ Base legal e documentos de referência
1. ABPA. Associação Brasileira de Proteína Animal. Relatório Anual 2022. Disponível em https://abpa-br.org/wp-content/uploads/2022/05/Relatorio-Anual-ABPA-2022-1.pdf
2. Antas, P., Antas, Z..1983. Migration of Nearctic Shorebirds (Charadriidae and Scolopacidae) in Brasil-Flyways and Their Different Seasonal Use. New World Secione Editors. The Wader Study Group Bulletin. 39. 52 - 56.
3. APHIS. Animal and Plant Health Inspection Service and United States Geological Survey, Early Detection and Monitoring for Avian Influenzas of Significance in Wild Birds - A U.S. Interagency Strategic Plan, 2015. https://www.aphis.usda.gov/animal_health/downloads/animal_diseases/ai/wild-bird-strategic-plan.pdf
4. APHIS. Animal and Plant Health Inspection Service and United States Geological Survey. Surveillance Plan for High Pathogenic Avian Influenza in Wild Migratory Birds in the United States, 2017. https://www.aphis.usda.gov/animal_health/downloads/animal_diseases/ai/2017-hpai-surveillance-plan.pdf
5. APHIS. Animal and Plant Health Inspection Service. National H5/H7 Avian Influenza Surveillance Plan, United States Department of Agriculture, Animal Plant Health Inspection Service, October 2013. https://www.aphis.usda.gov/animal_health/downloads/animal_diseases/ai/surveillance-plan.pdf
6. APHIS. Animal and Plant Health Inspection Service. Guidelines for Developing an Animal Health Surveillance Plan, USDA – APHIS – VS – Centers for Epidemiology and Animal Health - National Surveillance Unit. https://www.aphis.usda.gov/vs/nahss/docs/Guidelines_for_Developing_Animal_Health_Surveillance_Plan_September_14_2006.pdf
7. Armstrong MP, Xiao N, Bennett DA. Using genetic algorithms to create multicriteria class intervals for choropleth maps. Annals, Association of American Geographers. 2003; 93 (3): 595±623.
8. Bailey, T.C., Gatrell, A.C., 1995. Interactive Spatial Data Analysis. Longman Group, Harlow.
9. Bourscheid, C. L. P. R. Vigilância de doenças virais em aves de subsistência criadas próximas a sítios de aves migratórias no estado de Mato Grosso. Dissertação (mestrado) da Faculdade de Medicina Veterinária, da Universidade Federal de Mato Grosso - Cuiabá – MT, 2019. https://ri.ufmt.br/bitstream/1/3095/1/DISS_2019_Caroline%20Lemes%20Pereira%20Rego%20Bourscheid.pdf
10. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Departamento de Saúde Animal. Manuais Técnicos e Publicações. https://www.gov.br/agricultura/pt-br/assuntos/sanidade-animal-e-vegetal/saude-animal/programas-de-saude-animal/pnsa/manuais-tecnicos
11. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Departamento de Saúde Animal. Legislações. https://www.gov.br/agricultura/pt-br/assuntos/sanidade-animal-e-vegetal/saude-animal/programas-de-saude-animal/pnsa/legislacoes
12. Busani L. et al. Risk factors for highly pathogenic H7N1 avian influenza virus infection in poultry during the 1999–2000 epidemic in Italy/ The Veterinary Journal 181 (2009) 171–177
13. Cameron, A.R., Baldock, F.C., 1998. Two-stage sampling in surveys to substantiate freedom from disease. Prev. Vet. Med. 34, 19–30. https://doi.org/10.1016/S0167-5877(97)00081-0
14. Cameron, A. Manual of Basic Animal Disease Surveillance, African Union Interafrican Bureau For Animal Resources, 2012 https://www.ausvet.com.au/wp-content/uploads/Documents/tmt_20130131_manual_of_basic_animal_disease_surveillance_en.pdf
15. Castellan, D.M., 2012. Official control of poultry diseases: appropriate epidemiological and diagnostic requirements in relation to flock size and export strategy, in: XXIV World´s Poultry Congress. pp. 1–9. http://www.facta.org.br/wpc2012-cd/pdfs/plenary/David_M._Castellan.pdf
16. Central Veterinary Institute, Wageningen University, 2017. Risk factors of primary introduction of highly pathogenic and low pathogenic avian influenza virus into European poultry holdings, considering at least material contaminated by wild birds and contact with wild birds. EFSA supporting publication 2017:EN-1282. 24 pp. doi:10.2903/sp.efsa.2017.EN-1282
17. Embrapa. Central de inteligência de aves e suínos. Disponível em https://www.embrapa.br/suinos-e-aves/cias/mapas
18. EUROPEAN COMMISSION, 2010. 2010/367/EU Commission decision on the implementation by Member States of surveillance programs for avian influenza in poultry and wild birds, Official Journal of the European Union. https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32010D0367&from=EN
19. European Food Safety Authority, 2012. A framework to substantiate absence of disease : the risk based estimate of system sensitivity tool ( RiBESS ) Using data colete according to the EFSA 1–44. https://efsa.onlinelibrary.wiley.com/doi/10.2903/sp.efsa.2012.EN-366
20. FAO. 2014. Risk-based disease surveillance – A manual for veterinarian son the design and analysis of surveillance for demonstration of freedom from disease. FAO Animal Production and Health Manual No. 17. Rome, Italy. https://www.ausvet.com.au/wp-content/uploads/Documents/Risk-based-surveillance-FAO.pdf
21. Gonzaleset al.(2013) Rate of introduction of a low pathogenic avian influenza virus infection in different poultry production sectors in the Netherlands. Influenza and Other Respiratory Viruses 7(1), 6–10. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5780726/
22. Humphry, R.W., Cameron, A., Gunn, G.J., 2004. A practical approach to calculate sample size for herd prevalence surveys. Prev. Vet. Med. 65, 173–188. https://doi.org/10.1016/j.prevetmed.2004.07.003
23. ICMBio - INSTITUTO CHICO MENDES DE CONSERVAÇÃO DA BIODIVERSIDADE, 2016. Relatório anual de rotas e áreas de concentração de aves migratórias no Brasil. Cabedelo, PB: CEMAVE/ ICMBio. 2016. ISSN: 2446-9750
24. ICMBio - INSTITUTO CHICO MENDES DE CONSERVAÇÃO DA BIODIVERSIDADE, 2019. Relatório de Rotas e Áreas de Concentração de Aves Migratórias no Brasil, Cabedelo, PB: CEMAVE/ ICMBio. 2019. ISSN: 2446-9750, 3a Edição, 2019/2020. https://www.icmbio.gov.br/portal/images/stories/comunicacao/relatorios/relatorio_de_rotas_e_areas_de_concentracao_de_aves_migratorias_brasil_3edicao.pdf
25. Lázaro, E., Parnell, S., Vicent Civera, A., Schans, J., Schenk, M., Schrader, G., Abrahantes, J.C., Zancanaro, G., Vos, S., 2020. Guidelines for statistically sound and risk‐based surveys of Phyllosticta citricarpa. EFSA Support. Publ. 17. https://doi.org/10.2903/sp.efsa.2020.en-1893
26. Ledur, M.C., Peixoto, J.O. Material genético- Avicultura de reprodução. https://www.agencia.cnptia.embrapa.br/gestor/frango_de_corte/arvore/CONT000fc66uyih02wx5eo0a2ndxyampko73.html
27. Li, S., He, Y., Mann, D. A., Deng, X., 2021. Global spread of Salmonella Enteritidis via centralized sourcing and international trade of poultry breeding stocks. Nature communications, v. 12, n. 1, p.1-12. doi: 10.1038/s41467-021-25319-7. https://www.nature.com/articles/s41467-021-25319-7
28. Liang, W.S., He, Y.C., Wu, H.D., Li, Y.T., Shih, T.H., Kao, G.S., Guo, H.Y., Chao, D.Y., 2020. Ecological factors associated with persistent circulation of multiple highly pathogenic avian influenza viruses among poultry farms in Taiwan during 2015-17. PLoS One 15, 1–24. https://doi.org/10.1371/journal.pone.0236581
29. Nunes, T., Heuer, C., Marshall, J., Sanchez, J., Thornton, R., Re-, J., Robison-cox, J., Sebastiani, P., Solymos, P., Yoshida, K., Firestone, S., Stevenson, M.M., 2020. Package ‘ epiR .’ Mark Stevenson <mark.stevenson1@unimelb.edu.au> with Contrib. from Telmo Nunes, Cord Heuer, Jonathon Marshall, Javier Sanchez, Ron Thornton, Jeno Reiczigel, Jim Robison-Cox, Paola Sebastiani, Peter Solymos, Kazuki Yoshida, Geoff Jones, Sarah Pirikahu. R Core Team, 2019. R: A language and environment for statistical computing. R Foundation for Statistical Computing. https://www.scirp.org/(S(lz5mqp453edsnp55rrgjct55))/reference/ReferencesPapers.aspx?ReferenceID=2631126
30. Nunes, T., Heuer, C., Marshall, J., Sanchez, J., Thornton, R., Re-, J., Robison-cox, J., Sebastiani, P., Solymos, P., Yoshida, K., Firestone, S., Stevenson, M.M., 2020. Package ‘ epiR .’ Mark Stevenson <mark.stevenson1@unimelb.edu.au> with Contrib. from Telmo Nunes, Cord Heuer, Jonathon Marshall, Javier Sanchez, Ron Thornton, Jeno Reiczigel, Jim Robison-Cox, Paola Sebastiani, Peter Solymos, Kazuki Yoshida, Geoff Jones, Sarah Pirikahu.
31. OMSA - World Organisation for Animal Health. Terrestrial Animal Health Code, Chapter 1.4. Animal Health Surveillance. 2021.. https://www.WOAH.int/en/what-we-do/standards/codes-and-manuals/terrestrial-code-online-access/?id=169&L=1&htmfile=chapitre_surveillance_general.htm
32. OMSA - World Organisation for Animal Health. Animal health surveillance. Terrestrial Animal Health Code, CHAPTER 10.4. Avian Influenza viruses 2021. . https://www.WOAH.int/en/what-we-do/standards/codes-and-manuals/terrestrial-code-online-access/?id=169&L=1&htmfile=chapitre_avian_influenza_viruses.htm
33. OMSA - World Organisation for Animal Health. Terrestrial Animal Health Code, CHAPTER 10.9. Infection with Newcastle Disease Virus 2021. https://www.WOAH.int/en/what-we-do/standards/codes-and-manuals/terrestrial-code-online-access/?id=169&L=1&htmfile=chapitre_nd.htm
34. R Core Team, 2019. R: A language and environment for statistical computing. R Foundation for Statistical Computing,.
35. Reischak, D., Vírus da Influenza Aviária: monitoramento em aves de subsistência criadas no entorno de sítios de aves migratórias no Brasil. Universidade de São Paulo. 2016. https://www.teses.usp.br/teses/disponiveis/10/10134/tde-12012017-084736/publico/DILMARA_REISCHAK_Original.pdf
36. Schmidt, N,S., Silva, C.L. Pesquisa e Desenvolvimento na Cadeia Produtiva de Frangos de Corte no Brasil: Rev. Econ. Sociol. Rural 56 (3) • Jul-Sep 2018 • https://doi.org/10.1590/1234-56781806-94790560307
37. Somenzari, M.; Amaral, P.P., Cueto, V.R.; Guaraldo, A.C.; Jahn, A.E.; Lima, D.M.; Lima, P.C.; Lugarini, C.; Machado, C.G.; Martinez, J.; Nascimento, J.L.X.; Pacheco, J.F.; Paludo, D.; Prestes, N.P.; Serafini, P.P.; Silveira, L.F.; Sousa, A.E.A.; Sousa, N.A.; Souza, M.A.; Telino-Júnior, W.R. & Whitney, B.M. 2018. An overview of migratory birds in Brazil. Papéis Avulsos de Zoologia 58: e20185803. https://www.scielo.br/j/paz/a/Xy5ds9JJYwjX6K4TSVr6CBj/?lang=en&format=html
38. Stärk, K.D.C., Regula, G., Hernandez, J., Knopf, L., Fuchs, K., Morris, R.S., Davies, P., 2006. Concepts for risk-based surveillance in the field of veterinary medicine and veterinary public health: Review of current approaches. BMC Health Serv. Res. 6, 1–8. https://doi.org/10.1186/1472-6963-6-20
39. The RISKSUR Consortium. Best practices for risk-based and cost-effective animal health surveillance in the European Union, Risksur. https://www.fp7-risksur.eu/sites/default/files/documents/publications/riskbasedsurv_BPdoc_FINAL_formatted_03.pdf
40. Thomas M.E. et al. Risk factors for the introduction of high pathogenicity Avian Influenza virus into poultry farms during the epidemic in the Netherlands in 2003/ Preventive Veterinary Medicine 69 (2005) 1–11
41. Velkers, F.C., Manders, T.T.M., Vernooij, J.C.M., Stahl, J., Slaterus, R., Stegeman, J.A., 2021. Association of wild bird densities around poultry farms with the risk of highly pathogenic avian influenza virus subtype H5N8 outbreaks in the Netherlands, 2016. Transbound. Emerg. Dis. 68, 76–87. https://doi.org/10.1111/tbed.13595
42. Ward, M.P. et al. Environmental and anthropogenic risk factors for highly pathogenic avian influenza subtype H5N1 outbreaks in Romania, 2005−2006. Vet Res Comuns (2008) 32:627–634
43. Zuqulm Antas, P.T, Migration of nearctic shorebirds (Charadriidae and, Scolopacidae) in Brasil flyways and their different seasonal use. B.S. Centro de Estudos de Migrações de Aves, January 1983. https://www.researchgate.net/publication/258340967_NEW_WORLD_SECTION_Editors_MIGRATION_OF_NEARCTIC_SHOREBIRDS_CHARADRIIDAE_AND_SCOLOPACIDAE_i-N_BRASIL-FLYWAYS_AND_THEIR_DIFFERENT_SEASONAL_USE/link/0a85e534efd947a927000000/download
¶ Disposições Gerais
AGRADECIMENTOS
Ao Centro Panamericano de Febre Aftosa (Panaftosa) pelo valioso suporte técnico à elaboração deste Plano de Vigilância, em especial ao Dr. Manuel Sanchez, Dra. Lia Buzanovsky e Dr. Daniel Magalhães.
Ao Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio) pela colaboração fundamental no compartilhamento de bases de dados, artigos científicos e relevantes conhecimentos e revisões por parte da equipe do Centro Nacional de Pesquisa e Conservação de Aves Silvestres (CEMAVE), em especial a Dra. Patrícia Serafini.
À equipe do Departamento de Saúde Animal que coordenou os trabalhos de elaboração e revisão do Plano de vigilância de influenza aviária e doença de Newcastle.
¶ Histórico de revisões
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 1.0 | Inclusão dos tópicos: Folha de rosto, Folha resumo, Disposições gerais e Histórico de revisão. | 24/10/2022 | Transcrição do manual para o modelo de manualização validado pela SDA no Projeto de elaboração do modelo de manualização da SDA. |
¶ Anexos
¶
ANEXO 1 - PLANO AMOSTRAL PARA DETECÇÃO DE IA e DNC EM EXPLORAÇÕES DE SUBSISTÊNCIA E ÁREAS DE MAIOR RISCO DE INTRODUÇÃO DE IA – COMPONENTE 4
¶ 1. OBJETIVO
Esse documento descreve as atividades de vigilância ativa para detectar os vírus da IA e da DNC sob a perspectiva da vigilância baseada em risco, de modo que sua não detecção ajuda a comprovar a ausência de exposição aos vírus na população de aves de produção comercial em pequena escala (capacidade de alojamento de até 1000 aves) do Brasil.
¶ 2. DELINEAMENTO DO ESTUDO
¶ 2.1. ESTRATÉGIA METODOLÓGICA
O desenho do estudo incorpora o conceito de vigilância baseada em risco, no qual as amostras serão dirigidas às propriedades e às aves com as maiores chances de exposição à IA, nas diferentes áreas de amostragem no Brasil. Esse é um estudo transversal realizado em dois estágios, sendo que no primeiro será feita a seleção das fazendas a serem amostradas e no segundo, o número de animais dentro das criações. É importante ter em mente que cada área de amostragem representa um estudo independente.
¶ 2.2. METODOLOGIA
O desenho do estudo consiste em cinco fases, listadas abaixo:
I. Seleção de municípios de maior risco considerando a densidade de estabelecimentos de avicultura industrial e a densidade dos principais sítios e rotas de aves aquáticas migratórias
II. Cálculo do tamanho da amostra de unidades epidemiológicas
III. Definição de unidade epidemiológica
IV. Cálculo do número de animais a serem amostrados e do número de pools amostrais a serem analisados por unidade epidemiológica
V. Estruturação para amostragem pela divisão dos municípios em quadrantes
I. Seleção dos municípios de maior risco
Os estudos de vigilância ativa estão previstos para representar todo o território do Brasil, tendo como população-alvo as aves de criações de subsistência ou para comércio local. No entanto, ao usar uma estratégia baseada em risco, a amostragem será direcionada para áreas específicas dentro do país.
Para a seleção dos municípios de maior risco, considerou-se as cinco principais rotas de aves migratórias neárticas descritas no Brasil (Figura 1) (Antas & Antas, 1983; ICMBio, 2016, 2019), tendo como referência o mapeamento de avistamentos desses animais (Figura 2), fornecido pelo ICMBio, além da distribuição e localização de estabelecimentos de criação de aves de produção comercial no país fornecidos pelo MAPA. Os passos seguidos estão apresentados abaixo. No caso da Região Sul, os OESA podem incluir municípios com presença de aves migratórias das rotas específicas do continente sul-americano, conforme os critérios descritos neste plano.
a. Identificação e categorização das principais rotas de aves migratórias
Primeiramente, o país foi dividido em três grandes regiões relacionadas às principais rotas de aves migratórias do Hemisfério Norte, sendo uma região de influência definida como “Rota Amazônica”, outra como “Rota Brasil Central” e a terceira como “Rota Nordeste Atlântica” (Figura 1). Ressalta-se que, de modo geral, estas rotas acompanham alguns dos principais cursos d’água do Brasil.
b. Critérios para a seleção de municípios
A seleção dos municípios de maior risco de cada uma das três regiões foi feita utilizando os seguintes critérios:
Municípios localizados na faixa de 100 (cem) quilômetros ao redor das rotas de migração, que contém sítios de aves migratórias avistadas e que possuem estabelecimentos de criação de aves de produção comercial.
Municípios localizados na faixa de 100 (cem) quilômetros ao redor das rotas de aves migratórias, que contém sítios de aves migratórias avistadas e localizados em áreas de maior densidade de criações avícolas.
Os OESA poderão propor a inclusão ou substituição de municípios com sítios de assentamento de aves migratórias de interesse, ou com presença significativa de aves de subsistência, mesmo com deficiências de cadastros, ou com comércio de aves para exposição e/ou ornamentação, mas com existência de relação importante de trânsito de aves para outras regiões com avicultura industrial.
Com a evolução do cadastramento de propriedades de subsistência e o conhecimento dos locais de assentamento de aves migratórias, a relação de municípios selecionados poderá ser atualizada.
Desenvolvimento metodológico
Critério 1 – Seleção a partir das rotas e estabelecimentos de criação de aves de produção comercial. Uma faixa de influência (buffer) de 100 quilômetros foi traçada ao redor e ao longo das rotas (Figura 2).
Critério 2 - Em seguida foi realizada a seleção dos municípios que contém sítios de aves migratórias avistadas, que possuem granjas comerciais de aves (a partir de 1000 animais) e que se encontram nesta área de influência das rotas de aves migratórias.
A partir do cadastro de granjas e criações avícolas do Brasil foi gerado um mapa de densidade (kernel) utilizando 50 km como raio. A estimativa de densidade de kernel é uma técnica de suavização de distância ponderada onde uma função de densidade de probabilidade bivariada é aplicada para determinar a intensidade de um processo de ponto espacial (Bailey & Cartel, 1995). A intensidade calculada neste caso foi a concentração de granjas avícolas. A densidade de granjas gerada foi classificada em 4 categorias agrupadas por quebras naturais (Armstrong et al, 2003): “Muito alta”, “alta”, “média” e “baixa”.
As áreas com classificação de “muito alta” e “alta” densidade foram escolhidas para representar as áreas de maior concentração de estabelecimentos avícolas (Figura 2). Essas áreas de maior densidade, junto com os critérios de risco indicados (faixa de 100 quilômetros ao redor das rotas de migração e que contém sítios de aves migratórias avistadas), foram adicionadas às áreas identificadas como de risco.
II. Cálculo do tamanho da amostra de unidades epidemiológicas
A estimativa da amostra foi feita a partir de uma estratégia probabilística aplicada a toda a população de aves de produção em pequena escala na área sob risco.
a. Parâmetros usados para o inquérito probabilístico
O cálculo do tamanho da amostra foi realizado considerando uma estratégia em dois estágios. Para esses cálculos, assumimos uma prevalência de 1% entre unidades epidemiológicas e um nível de confiança de 95%. Sendo assim, espera-se que, se a IA estiver presente nessas subpopulações, ela afetaria 1% das granjas.
A sensibilidade intra-rebanho é calculada levando em conta o teste laboratorial utilizado (ELISA). Foram consideradas as estimativas de 95% de sensibilidade e 100% de especificidade.
b. Número de unidades epidemiológicas a amostrar por região de influência de rotas de aves migratórias
Para cada região de influência é necessário amostrar 322 unidades epidemiológicas com criação de aves de produção comercial em pequena escala e/ou subsistência. Esse cálculo leva em conta a existência de um grande número de estabelecimentos de criação de aves de produção comercial, por isso a população foi considerada infinita.
III. Definição de unidade epidemiológica
Nessa primeira etapa da amostragem há de se ter uma perspectiva abrangente para a definição da unidade epidemiológica, pois temos que nos adaptar à realidade da população de aves transnacionais e, assim sendo, as unidades epidemiológicas foram definidas por dois tipos de propriedades avícolas:
● Em alguns casos, a unidade epidemiológica é uma granja avícola com um comércio local limitado (por exemplo, pequenas criações de até 1.000 aves). Nesses casos, é provável que esses locais estejam bem identificados e tenham uma boa delimitação para serem considerados como unidade epidemiológica propriamente dita.
● Em outros casos, as unidades epidemiológicas serão criações de subsistência, que têm um número muito pequeno de aves. Nestes casos, é provável que não haja um bom registro da exploração ou uma delimitação clara da área. Assim, sugere-se usar o agrupamento local deste tipo de exploração, ou seja, considerá-la um cluster definido por um ponto geográfico e as explorações que estão ao seu redor.
IV. Estimativa do número de animais a serem amostrados por unidade epidemiológica
a. Parâmetros usados
O número de aves a serem amostradas por exploração ou cluster deve ser determinado com base em uma prevalência intra-rebanho estimada de 30% com um nível de confiança de 95%. Ou seja, assume-se que se a IA estiver presente em uma fazenda, 30% das aves estariam infectadas. Além disso, presume-se que a sensibilidade do teste de diagnóstico laboratorial é de 95% e a especificidade de 100%.
Quando a propriedade possuir galinhas, perus ou codornas e anseriformes, as aves a serem amostradas devem ser preferencialmente os anseriformes e aves adultas, principalmente, se estiverem mortas ou moribundas. Aves com sinais clínicos sugestivos de IA e DNC também devem ser priorizadas na amostragem.
b. Número de aves para amostrar por unidade epidemiológica
O número de aves a serem amostradas por exploração ou cluster deve ser igual a 11 aves, independentemente do tamanho da unidade epidemiológica. Para cada ave selecionada para colheita de sangue, devem ser colhidos também suabes de traqueia e de cloaca.
Todos os cálculos propostos se realizaram com os pacotes “epiR”, e “base” do programa R. (Nunes et al., 2020; R Core Team, 2019).
V. Estruturação para amostragem pela divisão dos municípios em quadrantes
Propõe-se nesta amostragem dar flexibilidade aos médicos veterinários locais na escolha das unidades epidemiológicas a serem amostradas.
Os municípios selecionados de cada região serão divididos em quadrantes de 10x10 Km, sobre os quais pode-se realizar um sorteio aleatório de quadrantes para facilitar a amostragem das unidades epidemiológicas de criações de aves de produção comercial em pequena escala. Assim, o sorteio indicará uma localização geográfica (como o centróide de um quadrado de 10 Km) e então os serviços locais poderão escolher as unidades epidemiológicas mais próximas daquela localização, utilizando os critérios abaixo.
Critérios na seleção de estabelecimentos a amostrar: com base numa avaliação de risco, a seleção das unidades epidemiológicas deverá priorizar aquelas onde as seguintes situações se apresentem:
existência de pontos de atração de aves silvestres (como lagos, açudes, etc.);
existência de aves anseriformes;
evidência de contato próximo entre as aves migratórias e as aves domésticas de produção comercial;
aves criadas em liberdade (sem estarem presas em galinheiros);
utilização de água superficial para servir de água de bebida às aves; e
presença de mais de uma espécie de aves convivendo na mesma exploração.
Em casos que não se encontre unidades epidemiológicas que atendam a um ou mais critérios acima, deve-se realizar a amostragem no quadrante vizinho que atenda às condições.
Programação do estudo: Previamente ao envio das amostras, o laboratório deve ser comunicado sobre o local da colheita, data prevista das atividades, previsão da quantidade de amostras a serem colhidas e previsão de chegada das amostras ao laboratório, com antecedência mínima de 15 dias, para que o envio seja autorizado, respeitando as demandas do Laboratório Oficial.
¶ 1. Planejamento e organização dos estudos em nível estadual
Coordenador estadual → Cada UF será dirigida por um Coordenador Estadual para o estudo, que constituirá sua equipe de trabalho com equipes de campo e caso necessário, pode instituir coordenadores regionais. As equipes de campo ficarão sob a responsabilidade de um médico veterinário oficial. O total de equipes deverá ser definido pelo serviço veterinário de cada UF, com base no número e na distribuição geográfica das granjas selecionadas e no cronograma de realização do estudo.
Planejamento de colheitas → O DSA fornecerá uma lista com as granjas e os locais selecionados para colheita. Os veterinários responsáveis pelas equipes de campo, de posse desta lista, deverão em conjunto com os coordenadores, indicar para cada região selecionada a estrutura mínima para execução das atividades de campo, dentro do prazo estabelecido. Entre as atividades iniciais, os coordenadores estaduais deverão distribuir para as equipes de campo os formulários de colheita. O planejamento inclui a distribuição dos materiais necessários para registro das informações, colheita das amostras e procedimentos de biossegurança, bem como o treinamento de todos os profissionais envolvidos.
Execução das atividades das equipes de campo→ O médico veterinário responsável pela equipe de campo garantirá o correto uso dos formulários e aplicativo para registro das atividades, incluindo a legibilidade dos mesmos, bem como a correta identificação, armazenamento e conservação das amostras colhidas, até o recebimento pela unidade central do SVE ou Coordenação Regional, quando utilizada. O mesmo profissional é responsável também por garantir a disponibilidade de equipamentos de proteção individual (EPI) e a realização de procedimentos de segurança para toda a equipe.
Unidade central de recebimento → Cada SVE definirá uma unidade central de recebimento e conferência dos formulários e das amostras, garantindo a conservação destas até envio à rede de laboratórios do MAPA.
Equipe central de inserção de dados → Cada SVE terá uma equipe central de inserção dos dados e informações no SIGEP, utilizado para controle do banco de dados do estudo. O LFDA que receberá as amostras de cada UF será informado pela coordenação estadual do estudo, com o conhecimento da equipe da DISAV/DSA.
Identificação dos estabelecimentos → Cada estabelecimento amostrado terá uma identificação única, que será o Código MAPA, mantendo a correlação com o código do estabelecimento no cadastro do OESA. Este código será gerado de acordo com o número de estabelecimentos de criação a serem amostrados, fornecido pelo DSA.
¶ 2. Critérios para seleção de núcleos e galpões nas granjas amostradas na avicultura industrial
Granjas de frangos de corte: devido ao curto ciclo de vida, que resulta em um período muito curto de possibilidade de detecção de anticorpos contra a IA, núcleos e galpões amostrados devem ser aqueles que possuem animais próximos ao envio ao abate, acima de 30 (trinta) dias de vida.
Granjas de postura comercial: amostrar galpões.
Granjas de postura comercial: a amostragem deve priorizar as granjas de galinhas de postura criadas em sistemas de galpões abertos ou em sistemas comerciais alternativos (sem gaiolas), que apresentam maiores riscos de exposição à IA e DNC.
Granjas de aves de reprodução: a amostragem deve priorizar as granjas matrizeiras.
Estabelecimentos de criação de patos, perus e codornas (outros): a amostragem deve priorizar esses estabelecimentos, pois são considerados como de maior risco entre as criações industriais. Portanto deve-se evitar sua substituição por estabelecimentos de outra categoria.
Os quantitativos de estabelecimentos de avicultura industrial para os fins da amostragem em cada UF são classificados segundo o Anexo 3
Para a vigilância ativa em criações de subsistência, as orientações estão disponíveis no Anexo 1.
¶ 3. Critérios para seleção das aves
3.1. Idade das aves: no momento da colheita, é preciso levar em consideração o período de alojamento das aves para garantir maior probabilidade de detecção do agente, tendo em vista o período de incubação dos vírus da IA e DNC. Dessa forma, é sensato verificar com o produtor a idade das aves antes de realizar o deslocamento até a granja.
As aves para colheita de amostras deverão ter pelo menos 30 (trinta) dias de alojamento no núcleo, observando-se as seguintes possibilidades no momento de programação das colheitas:
¶ 3.1.1. estabelecimentos com apenas um núcleo:
3.1.1.1. núcleo com 30 (trinta) dias ou mais de alojamento: fazer a investigação e colher as amostras;
3.1.1.2. com menos de 30 (trinta) dias de alojamento: aguardar o período mínimo de 30 (trinta) dias e reprogramar a investigação para colheita das amostras; e
3.1.1.3. núcleo em vazio sanitário: substituir a granja por outra pertencente à mesma subpopulação da granja selecionada.
¶ 3.1.2. estabelecimentos com mais de um núcleo:
Pelo menos um núcleo deverá ter atendido o prazo de 30 (trinta) dias ou mais de alojamento.
3.1.2.1. Neste caso, colher amostra dos núcleos com mais de 30 dias de alojamento;
3.1.2.2. núcleos em vazio sanitário e núcleos com aves com menos de 30 (trinta) dias de alojamento deverão ser desconsiderados; e
3.1.2.3. no caso de não haver nenhum núcleo com pelo menos 30 (trinta) dias ou mais de alojamento, reprogramar a investigação para atendimento do prazo mínimo em pelo menos um núcleo.
Observações:
a. No caso específico de codornas, considerar como prazo mínimo de alojamento de 15 (quinze) dias.
b. Caso uma ou mais granjas sorteadas na amostragem estiverem desativadas, despovoadas ou a espécie de aves for diferente da esperada, uma nova granja deverá ser escolhida em substituição à sorteada. Para isso deve-se seguir os seguintes critérios: granjas da mesma categoria de risco; granja com aves da mesma espécie da granja selecionada; e, preferencialmente, localizada no mesmo município ou, caso não exista, em município vizinho.
¶ 3.2. Amostras a serem colhidas em cada núcleo:
Todos os núcleos com aves na idade mínima estabelecida, na granja sorteada, até o máximo de 5 (cinco) núcleos.
¶ 3.2.1. Tipo e quantidade de amostras por núcleo
11 (onze) amostras individuais de sangue para obtenção de soro sanguíneo;
11 (onze) suabes de traqueia divididos em dois pools, um com 5 suabes e outro com 6 suabes de traqueia;
11 (onze) suabes de cloaca divididos em dois pools, um com 5 suabes e outro com 6 suabes de cloaca.
Observações:
a. Coletar os suabes das mesmas aves em que serão colhidas as amostras de sangue.
b. O médico veterinário responsável pela colheita das amostras deverá realizar a vistoria geral e o exame clínico das aves da granja, informando suas observações no respectivo formulário de colheita de amostras.
¶ 4. Verificações pré-colheita da vigilância ativa
- Material de colheita recebido;
- Formulários com a identificação das granjas selecionadas, bem como formulários em branco para o caso de substituição de granjas;
- Idade das aves das granjas selecionadas;
- Preenchimento dos formulários com a identificação de cada granja selecionada;
- Informações das etiquetas de identificação;
- Agendamento da investigação com algum responsável pela granja; e
- Atenção para os procedimentos de biosseguridade aplicados a cada tipo de produção de aves, preferencialmente, destinando equipes diferentes para cada tipo de categoria.
¶ 5. Colheita e acondicionamento de amostras da vigilância ativa
As colheitas de material serão realizadas durante a atividade de vigilância nos estabelecimentos avícolas selecionados. No momento da colheita na granja, o médico veterinário deve realizar uma avaliação clínica das aves, avaliação dos índices zootécnicos e parâmetros de consumo de água e ração, e caso sejam constatados sinais clínicos ou evidências de casos prováveis de IA e DNC, deverão ser desencadeados os procedimentos previstos de vigilância passiva, como, por exemplo, interdição da propriedade, colheita de amostras e abertura de FORM-IN.
Além de adotar os procedimentos preconizados para o atendimento de suspeitas, conforme estabelecido pelo PNSA, deverá ser preenchido o Formulário do presente estudo (que deverá ser inserido no SIGEP ou outro sistema definido pelo MAPA), registrando no campo “Observações”: Suspeita de IA e DNC, conforme FORM-IN número XXXXXXXX. As amostras colhidas deverão seguir o protocolo estabelecido para vigilância passiva e deverão ser registradas no e-Sisbravet.
¶ 5.1. Relação dos materiais mínimos necessários para as atividades de campo da vigilância ativa:
Colheita de sangue para obtenção de soros:
a) seringas estéreis descartáveis de 5 (cinco) mL;
b) agulhas 25x7 ou 25x8 mm; e
c) microtubos (tipo Eppendorf), com capacidade de 2 (dois) mL.
Colheita de suabes:
a) suabes com haste plástica de nylon flocado ou de espuma de poliuretano ou de poliéster não flocados;
b) tubos (tipo Falcon) de 15 (quinze) mL; e
c) meio de transporte para conservação viral, conforme as opções especificadas no Anexo 7 deste manual. A quantidade de meio segue a proporção de um suabe/mL de meio de transporte, assim, para cada frasco com um pool de 5 (cinco) ou 6 (seis) suabes deve ser utilizado 5 (cinco) ou 6 (seis) mL de meio.
d) tesoura para cortar as hastes dos suabes.
Observações:
Não é recomendado o uso de suabes com haste de madeira e que tenham a ponta de algodão;
Para o congelamento dos suabes à temperatura de -80ºC, deve-se dar preferência aos tubos (tipo Falcon) de polipropileno, pois os de poliestireno podem quebrar a esta temperatura;
Verificar as opções de meio de conservação descritas no Anexo 7 deste manual, atentando que as formulações são compostas por um meio de cultivo celular somado a uma solução de antibiótico e, no caso do meio de cultivo MEM, a formulação inclui, ainda, soro bovino ou soro fetal bovino ou BSA (soroalbumina bovina); e
O meio de transporte para conservação das amostras deve ser mantido congelado em freezer a -20ºC até antes dos preparativos para a colheita.
Identificação do material:
a) formulários de colheita em branco, conforme modelo definido pelo DSA;
b) etiquetas de identificação de amostras (observar o descrito neste manual);
c) caneta de tinta indelével para preenchimento das informações das etiquetas; e
d) Material de acondicionamento das amostras: fita adesiva; gelo reciclável; caixa isotérmica; suporte para organizar as amostras na vertical e sacos plásticos para agrupar as amostras por núcleo.
¶ 5.2. Procedimento de colheita de amostras da vigilância ativa
Para minimizar possíveis riscos sanitários, recomenda-se que os trabalhos de fiscalização aos estabelecimentos e colheita de amostras obedeçam aos procedimentos usuais de biosseguridade. A adoção de boas práticas no processo de colheita, conservação e remessa de amostras constitui um dos principais fatores para o sucesso na obtenção de material para diagnóstico laboratorial.
5.2.1. Colheita de amostra de sangue para obtenção de soro sanguíneo: será feita de modo a evitar sua contaminação, que pode inviabilizar a realização e interpretação dos testes laboratoriais. Por essa razão, deverá ser utilizado material estéril e descartável.
A colheita de sangue em aves adultas será feita por meio de punção de uma das veias da asa, a veia braquial (localizada na face interna da coxinha da asa), conforme abaixo, ou mesmo por meio da veia jugular:
a) coloque a ave em apoio lateral, contendo-a pelos membros inferiores e pescoço;
b) levante a asa e localize a veia braquial, que se encontra muito superficial;
c) introduza a agulha com o bisel para cima e puxe o êmbolo delicadamente para evitar a ocorrência de hemólise;
d) com a seringa de 5 mil, retire aproximadamente 2,5 mL de sangue o que garantirá pelo menos 1 mL de soro (esse é o mínimo de soro que deve ser enviado ao laboratório);
e) puxe completamente o êmbolo da seringa e deposite-a levemente inclinada sobre uma superfície plana, ao abrigo da luz e em temperatura ambiente, até a completa coagulação e liberação do soro (geralmente de 2 a 3 horas);
f) após dessoração, retire o êmbolo da seringa e verta o soro no microtubo tipo Eppendorf devidamente identificado;
g) a quantidade mínima de soro a ser encaminhada ao laboratório deverá ser de 1,0 mL, observando o preenchimento máximo de 2/3 (dois terços) do tubo Eppendorf, pois, ao congelar, haverá aumento do volume com risco de extravasamento do conteúdo;
h) coloque etiqueta de identificação no microtubo individualmente;
i) fixe o microtubo em isopor ou suporte apropriado para que sejam mantidos em posição vertical (com a tampa para cima); e
j) refrigere imediatamente.
Observações:
- Em codornas, a colheita de sangue pode ser pela veia jugular direita ou da asa (ulnar), podendo ainda coletar do coração ou seio venoso occipital, contudo há risco de morte da ave.
- Em perus e patos, a colheita de sangue pode ser pela veia ulnar ou metatársica medial, podendo ainda ser utilizado o seio venoso occipital.
- Os tubos contendo as amostras de soro deverão ser congelados na vertical (em pé) e mantidos a -20ºC (menos vinte graus Celsius), evitando-se o descongelamento. Nunca congelar amostras de soro com a presença de coágulos, pois ocorrerá hemólise e prejuízo dos testes laboratoriais.
- Caso não se disponha de meios para o congelamento das amostras, estas deverão ser mantidas sob refrigeração e chegar ao laboratório no prazo máximo de três dias.
- As amostras de soro deverão estar em condições adequadas, ou seja, límpidas, congeladas/refrigeradas, identificadas de forma legível e bem acondicionadas.
5.2.2. Colheita de suabes de traqueia:
k) utilize um suabe adequado ao porte da ave. Os suabes de metal são mais finos e, por isso, indicados para aves mais delicadas.
l) abra o bico da ave e introduza o suabe;
m) raspe-o nas paredes da laringe e traqueia para a retirada do maior número de células possível, com cuidado para não machucar as aves;
n) certifique-se de que não existe resto de alimento no suabe o que pode indicar que ele foi introduzido no esôfago;
o) coloque o suabe no tubo tipo Falcon contendo meio de transporte para conservação viral;
p) quebre ou corte a haste do suabe na altura da boca do tubo e feche-o;
q) agite-o, com movimentos giratórios, para liberar as células;
r) acrescente os demais suabes (total de cinco ou seis) no tubo para a formação do pool;
s) coloque etiqueta de identificação no tubo contendo o pool;
t) fixe o tubo em isopor ou suporte apropriado para que sejam mantidos em posição vertical; e
u) refrigere imediatamente.
5.2.3. Colheita de suabes de cloaca:
utilize um suabe adequado ao porte da ave. Os suabes de metal são mais finos e, por isso, indicados para aves mais delicadas.
levante as penas da cauda e introduza o suabe raspando-o em suas paredes;
coloque o suabe no tubo tipo Falcon contendo meio de transporte para conservação viral;
quebre ou corte a haste do suabe na altura da boca do tubo e feche-o;
agite-o, com movimentos giratórios, para liberar as células;
vá acrescentando os demais suabes (total de cinco ou seis) no tubo para a formação do pool;
coloque etiqueta de identificação no tubo contendo o pool;
fixe o tubo em isopor ou suporte apropriado para que sejam mantidos em posição vertical; e
refrigere imediatamente.
6. Identificação das amostras
As amostras serão identificadas com os códigos gerados pelo SIGEP ou conforme orientações definidas previamente pelo MAPA. A identificação da amostra deverá constar no formulário de colheita e no tubo Eppendorf.
Após o trabalho de colheita todo o material utilizado deverá ser recolhido da propriedade.
¶ 7. Preenchimento do formulário
O formulário de colheita de amostras de aves deverá ser preenchido em aplicativo a ser disponibilizado pelo MAPA ou em papel com letra legível e caneta e assinado pelo MVO responsável pela colheita. Esse formulário estará disponível no SIGEP ou outro sistema disponibilizado pelo MAPA e será disponibilizado um guia específico para o preenchimento. Caso seja preenchido no aplicativo, o formulário deverá ser posteriormente impresso e encaminhado ao LFDA acompanhando a amostra.
O formulário original de colheita será arquivado na UVL responsável pelo estabelecimento selecionado. As informações do formulário de colheita deverão ser registradas no SIGEP.
Para colheita de amostras na granja, foi definido o formulário cujo modelo estará disponível previamente. O correto uso destes formulários representa um ponto fundamental para a qualidade e o andamento do trabalho, destacando que todo o esforço de colheita pode ser perdido caso as informações não tenham sido registradas de forma adequada.
¶ 8. Acondicionamento e envio das amostras ao laboratório
Antes do encaminhamento ao laboratório ou à central estadual de recepção e conferência, o MVO responsável pela colheita e pelo preenchimento do formulário de colheita deverá realizar uma última conferência para verificar se todas as informações e devidas identificações estão correlatas às amostras colhidas daquele estabelecimento.
O acondicionamento e o transporte das amostras são muito importantes para a manutenção da qualidade do material coletado e devem obedecer a normas de biossegurança.
O material coletado poderá ser enviado para uma central de triagem, como por exemplo um laboratório estadual, no qual as amostras poderão ser devidamente armazenadas e encaminhadas em conjunto ao LFDA. Ou as amostras poderão ser encaminhadas imediatamente ao laboratório oficial à medida em que forem sendo coletadas.
¶ 8.1. Acondicionamento das amostras:
Colocar as amostras em caixa de isopor com gelo reciclado no fundo, nas laterais e em cima. Recomenda-se a utilização de nove partes de gelo reciclável para cada parte de amostra acondicionada nas caixas de isopor. Calçar as amostras para que fique bem firme dentro da caixa de isopor (espaços vazios poderão ser preenchidos com isopores, papel ou similares) e enviá-las ao laboratório oficial, juntamente com o Formulário de Colheita de Amostras.
Os LFDA que receberão as amostras de cada Unidade da Federação serão definidos e comunicados pelo DSA, em conjunto com a CGAL/DTEC.
Caso as amostras não possam ser enviadas imediatamente, acondicionar os frascos contendo os suabes (de traqueia e de cloaca) e os soros sob refrigeração, até o momento do envio ao laboratório oficial.
As amostras podem ser mantidas sob refrigeração por até 96h (considerando o período de trânsito ao laboratório) ou congeladas a - 80°C se houver necessidade de armazenamento por períodos superiores.
Nunca devem ser utilizados congeladores de refrigeradores domésticos para o armazenamento dos materiais. É preferível manter o material sob refrigeração ou em gelo seco.
Evitar ciclos sucessivos de congelamento-descongelamento.
Quando a distância a ser percorrida para o transporte do material for grande e este puder ser mantido congelado, dar preferência à utilização de gelo seco. Neste caso, deve-se tomar o cuidado de utilizar embalagem dupla, a fim de que o gelo seco não entre em contato direto com as amostras. Lembramos que o transporte de gelo seco possui regulamentações específicas e estas precisam ser observadas.
¶ 8.2. Envio das amostras
Cada Formulário de Colheita de Amostras preenchido deve apresentar 3 (três) cópias:
a) uma acompanha a amostra ao Laboratório Oficial;
b) uma é destinada ao Coordenador Estadual; e
c) uma deve ser arquivada no Unidade veterinária local.
Evitar, salvo em emergências, realizar as remessas de material ao laboratório durante os finais de semana e feriados, pois o tempo de trânsito nestes casos pode ser ainda maior. Programar os envios das amostras ao LFDA para que ocorram, preferencialmente, entre segunda e quarta-feira.
¶ 9. Uso do SIGEP ou outro sistema disponibilizado pelo MAPA para gerenciamento do estudo
Para o acompanhamento e o gerenciamento dos dados dos estabelecimentos e das amostras oriundas de “Avicultura industrial” será utilizado o SIGEP ou outro sistema definido pelo MAPA. A inserção dos dados que constam nos formulários de colheita de amostras no sistema será de responsabilidade da OESA.
¶ 10. Laboratórios
As amostras serão analisadas pelo Laboratório Federal de Defesa Agropecuária de Campinas – SP.
¶ 11. Testes de diagnóstico
Serão utilizados os protocolos de diagnóstico descritos no Plano de vigilância de IA e DNC. Desta forma, ao identificar uma amostra positiva ou inconclusiva no ELISA, o Laboratório deve notificar o DSA para investigação da suspeita.
¶ 12. Resultado laboratorial
Todo resultado laboratorial deverá ser inserido no SIGEP ou outro sistema definido pelo MAPA. Não haverá necessidade da emissão e envio de relatórios de ensaio. Os resultados positivos, além de inseridos no sistema, devem ser enviados para o DSA, para a Unidade Central do OESA e para o serviço de saúde animal da Superintendência Federal de Agricultura, Pecuária e Abastecimento (SISA/SFA). Somente casos positivos serão oportunamente comunicados.
¶ 13. Pagamento dos custos de compra de materiais e remessa das amostras ao LFDA
Os custos referentes à compra de materiais e a remessa das amostras aos laboratórios, para o Plano de vigilância de IA e DNC, deverão ser acordados, preferencialmente, entre o OESA e a iniciativa privada.
¶ ANEXO 3 – Número de estabelecimentos a serem amostrados no componente 3 – VIGILÂNCIA ATIVA EM AVICULTURA INDUSTRIAL, por UF e tipo de produção
_(pdf.io).jpg)
¶ ANEXO 4 – CARACTERIZAÇÃO REGIONAL EM RELAÇÃO À PRODUÇÃO AVÍCOLA
¶ 1.1 Região Sul
A região Sul é responsável por 64% da produção de frangos de corte. O Paraná é líder nacional de produção (35,54%), seguido por Santa Catarina (14,89%) e Rio Grande do Sul (13,65%). Com níveis de biosseguridade elevados, 62,5% das granjas de matrizes de ovos férteis estão localizadas na região Sul (13,9% no PR; 4,5% em SC; e 3,2% no RS).
Os estados da região são responsáveis por 99,8% da produção nacional de patos (99,75% em SC, e 0,03 % no RS e 0,05% no PR) e 99.9% da produção nacional de perus (56,54% no RS, 39,45% em SC e 3,99% no PR). Na região Sul, ainda se encontram 15% dos estabelecimentos produtores de avestruz.
A avicultura de postura comercial no Sul representa 13% do total nacional e o Rio Grande do Sul lidera a produção de ovos para consumo.
Na região sul do Brasil, estão localizados quatro sítios de aves migratórias (Estação Ecológica do Taim - RS, Parque Nacional da Lagoa do Peixe - RS, Foz do Rio Araranguá- SC e Foz do Rio Tijucas - SC), reconhecidos pelo Departamento de Saúde Animal para vigilância ativa dos vírus da influenza aviária e da doença de Newcastle. Nestes sítios já foram identificados, em ensaios sorológicos, os subtipos H1, H3, H4, H5, H6, H7, H8, H10, H11, H12, H13, H14, H15 e H16 do vírus de influenza aviária, sendo que não houve detecção molecular ou isolamento do vírus.
¶ 1.2 Sudeste
A região Sudeste do Brasil (São Paulo, Rio de Janeiro, Espírito Santo e Minas Gerais) destaca-se na avicultura de postura comercial, representando quase metade da produção nacional dos ovos para consumo, com o estado de São Paulo como maior produtor, com 29,63%; seguido de Minas Gerais, com 10,54%; e do Espírito Santo, com 9,17%.
A produção de frangos de corte na região Sudeste representa cerca de 17% do total nacional, com 8,32% em São Paulo; 7,44% em Minas Gerais e 0,68% no Espírito Santo (ABPA,2022). A região ainda possui 29,5 % das granjas de matrizes de ovos férteis do país e, ainda, São Paulo e Minas Gerais concentram 64% dos estabelecimentos produtores de avestruzes.
No estado de São Paulo estão localizados os sítios de aves migratórias (ilha do Cardoso - SP e ilha Comprida - SP), reconhecidos pelo Departamento de Saúde Animal para vigilância ativa dos vírus da influenza aviária e da doença de Newcastle. Nestes sítios foram identificados em ensaios sorológicos os subtipos H3, H6, H8, H12 e H16 do vírus de influenza aviária, porém não houve detecção molecular ou isolamento do vírus.
¶ 1.3 Região Centro-Oeste
A região Centro-Oeste do Brasil (Goiás, Mato Grosso e Mato Grosso do Sul) tem, na abundância de grãos, cenário favorável para crescimento da avicultura. A avicultura dos estados da região é crescente e atualmente responde por 15% da produção nacional de frangos de corte, com 8,272% em Goiás; 3,76% no Mato Grosso e 2,75% no Mato Grosso do Sul.
A produção de ovos para consumo corresponde a 11,5% da produção nacional de ovos, com 5,59% no Mato Grosso; 4,63% em Goiás e 1,71% no Mato Grosso do Sul (ABPA,2022).
O Mato Grosso do Sul ainda possui 2,4% das granjas de matrizes de ovos férteis. Ainda, na região, estão presentes 6% dos estabelecimentos produtores de avestruzes.
Na região Centro-Oeste, estão localizados três sítios de aves migratórias (Praias do Rio Paraguai - MT, Praias do Rio Araguaia – MT e Pantanal - MS), reconhecidos pelo Departamento de Saúde Animal para vigilância ativa dos vírus da influenza aviária e da doença de Newcastle. Nestes sítios foram identificados, em ensaios sorológicos, os subtipos H1, H3, H4, H6 e H14 do vírus de influenza aviária, porém sem detecção molecular ou isolamento do vírus.
¶ 1.4 Região Nordeste
A região Nordeste do Brasil (Bahia, Sergipe, Alagoas, Pernambuco, Paraíba, Rio Grande do Norte, Ceará, Piauí e Maranhão) conta com 2,5% da produção de frangos de corte nacional, destaque para o Pernambuco.
A avicultura de postura comercial é bem expressiva na região, com os estados de Pernambuco (8,19%); Ceará (5,26%) e Bahia (1,67%) representando cerca de 15% da produção nacional de ovos (ABPA,2022).
Na região Nordeste, estão localizados sete sítios de aves migratórias (Mangue Seco - BA, Cacha Pregos - BA, Coroa Vermelha - BA, Cetrel - BA, Coroa do Avião - PE, Fernando de Noronha - PE e Galinhos - RN, Panaquatira - MA, Guará - MA) reconhecidos pelo Departamento de Saúde Animal para vigilância ativa dos vírus da influenza aviária e da doença de Newcastle. Nestes sítios foram identificados em ensaios sorológicos os subtipos H5, H8, H10 EH16 do vírus de influenza aviária, porém não houve detecção molecular ou isolamento do vírus.
¶ 1.5 Região Norte
A região Norte do Brasil (Tocantins, Pará, Amapá, Roraima, Amazonas, Acre e Rondônia) tem avicultura mais expressiva no estado do Pará, seguido de Rondônia e do Tocantins e. A avicultura da região é responsável por 1,5% da produção nacional de frangos de corte e de ovos. Aproximadamente 1,5% da produção nacional de ovos de consumo está na região Norte.
Na região Norte, estão localizados cinco sítios de aves migratórias (Ilha de Marajó - PA, Bahia de Marajó - PA e Salinópolis - PA), reconhecidos pelo Departamento de Saúde Animal para vigilância ativa dos vírus da influenza aviária e da doença de Newcastle. Nestes sítios, não foram identificados, em ensaios sorológicos, os subtipos H do vírus de influenza aviária.
¶ ANEXO 5 – EQUIPAMENTOS DE PROTEÇÃO INDIVIDUAL- EPI
Orientação sobre Equipamentos de Proteção Individual (EPI) para investigações de casos suspeitos de SRN e de mortalidade excepcional de aves silvestres
Considerando a atuação do Serviço Veterinário Oficial (SVO) no atendimento a suspeitas e a possíveis focos de influenza aviária (IA), o DSA orienta o uso dos equipamentos de proteção individual (EPI) que podem ser utilizados por este serviço nessas ações.
Sugere-se que a listagem mínima de EPI a ser utilizado durante essas atividades seja composta de macacão, avental, máscara/respirador, botas, óculos e luvas descartáveis, conforme características a seguir:
I. Macacão para proteção do corpo inteiro em operações em que existam riscos de contaminação por agentes químicos, confeccionado em não-tecido feito de fibras 100% polietileno de alta densidade, com abertura frontal e fechamento com zíper, elástico nos punhos e tornozelos, sem bota e com capuz, costura simples;
II. Avental para proteção contra produtos químicos e microbiológicos, confeccionado em não tecido de 100% polietileno de alta densidade com cobertura de polietileno sobre o tecido, gramatura 71 gramas por metro quadrado, modelo frontal, possuindo alça na cintura com aproximadamente 115 centímetros, alça no pescoço com aproximadamente 55 centímetros, comprimento mínimo 120 centímetros;
III. Máscara PFF2 ou superior - respirador descartável semifacial filtrante para partículas (PFF2 ou superior) para poeiras, névoas, fumos e baixas concentrações de gases ácidos. Constituído por uma concha interna de sustentação de não-tecido moldado em fibras sintéticas, meio filtrante composto por uma camada de microfibras tratadas eletrostaticamente e uma camada de microfibras carregadas com carvão ativado, para retenção de gases ácidos. A parte externa do respirador é composta por uma cobertura de não-tecido para proteção do meio filtrante. O conjunto deve conter duas bandas de elástico, um grampo de ajuste nasal e uma válvula de exalação;
IV. Capuz compatível com respirador purificador de ar motorizado. Confeccionado em poliéster revestido de polipropileno, com aba dupla com comprimento até a altura das costas e peito do usuário, sistema dotado de elástico, para melhor ajuste no pescoço do usuário. Visor frontal transparente em polietileno tereftalato modificado com glicol com formato semicircular. Na parte interna do capuz existe um sistema de fixação à cabeça do usuário através de uma suspensão, dotado de tira absorvedora de suor e com ajuste simples. Abertura traseira com sistema de engate rápido para traqueia, em material plástico;
V. Bota para proteção contra agentes químicos e para operações com água, confeccionada em PVC. Deve possuir alta resistência à abrasão, rasgamento e tração. Com forro, solado antiderrapante. Cano longo, com no mínimo 32 centímetros;
VI. Óculos com boa vedação com a pele, de estrutura de PVC flexível para encaixar facilmente com todos os contornos do rosto, com pressão uniforme, banda ajustável, a fim de não se soltar durante a atividade, e com ventilação indireta para evitar embaçamento. Também é necessário que acomode óculos graduados. Adicionalmente, as lentes devem ser de plástico transparente, antiembaçantes e resistentes a arranhões. Os óculos podem ser reutilizáveis (desde que sejam tomadas as devidas providências para descontaminação) ou descartáveis; e
VII. Luva para proteção contra agentes biológicos, em látex natural, não-estéril, descartável, lubrificada com pó bioabsorvível. Textura uniforme, formato anatômico, ambidestra, com alta sensibilidade táctil, boa elasticidade, resistente a tração, punho com bainha, espessura mínima 0,22 centímetros. Tamanho pequeno / médio / grande / extra grande.
Insta ressaltar que só devem ser adquiridos EPI (seja de fabricação nacional ou importado) com a indicação do Certificado de Aprovação (CA) expedido pelo órgão nacional competente em matéria de segurança e saúde no trabalho do Ministério da Economia.
Cada OESA deve dispor de quantidade suficiente para o atendimento rotineiro de suspeitas de SRN. Para a eventualidade de focos de IA, entende-se que o OESA deve dispor, permanentemente, de quantidade de EPI suficiente para garantir uma resposta adequada durante, pelo menos, 30 dias, de acordo com a realidade do setor produtivo de cada estado. A definição de estratégias de aquisição, logística de armazenamento e distribuição desse EPI fica a cargo de cada OESA.
Vigilância ativa:
Em relação às atividades de vigilância ativa, é esperado que sejam realizadas inspeções e colheitas de amostras em aves sem sinais clínicos de IA. Dessa forma, orienta-se que sejam seguidas as regras de biosseguridade normais das granjas, com a utilização de macacões de uso rotineiro ou aventais descartáveis, luvas descartáveis, propés, máscaras descartáveis e óculos de segurança, não sendo necessário o uso dos EPI indicados para atendimentos a suspeitas de SRN.
¶ ANEXO 6 – FORMULAÇÃO DOS MEIOS DE TRANSPORTE E PREPARO DOS TUBOS PARA COLHEITA
Opção 1: Meio de cultivo celular MEM (“Minimal Essential Medium”) com 10% de soro bovino (ou 10% de soro fetal bovino) e com concentração 0,5X de solução de antibióticos.
Fórmula: . 850 ml meio de cultura de células MEM estéril.
100 ml de soro fetal bovino (ou soro bovino) estéril.
50 ml solução 10X de antibióticos estéril (preparado conforme tabela abaixo).
Distribuir 5 ml por tubo Falcon (1 ml por suabe) e manter congelado até o momento de uso.
Opção 2: Meio BHI (“Brain Heart Infusion”) com solução 0,5X de antibióticos.
Fórmula: . Infusão de cérebro: 200g
Infusão de coração:250g
Peptona proteose: 10g
Dextrose: 2g
Cloreto de sódio: 5g
Fosfato dissódico: 2,5g
Hidratar em 1000 ml de água deionizada e acertar o pH para 7,4±0,2. Autoclavar (121C/15 min). Adicionar 50 ml da solução 10X de antibióticos estéril a 950 ml do caldo BHI estéril. Distribuir 5 ml por tubo Falcon (1 ml por suabe) e manter congelado até o momento de uso.
Opção 3: Caldo Triptose Fosfato Tamponado com solução 0,5X de antibióticos.
Fórmula: . Triptose: 20g
Dextrose:2g
Cloreto de sódio: 5g
Fosfato dissódico: 2,5g
Hidratar em 1000 ml de água deionizada e acertar o pH para 7,3±0,2. Autoclavar (121 oC/15 min). Adicionar 50 ml da solução 10X de antibióticos estéril a 950 ml do caldo Triptose Fosfato Tamponado estéril. Distribuir 5 ml por tubo Falcon (1 ml por suabe) e manter congelado até o momento de uso.
Solução 10X de antibióticos:
Fórmula PBS-Dulbecco:
Cloreto de sódio: 8g
Cloreto de potássio: 0,2g
Cloreto de cálcio: 0,1g
Fosfato de sódio dibásico: 1,03g
Fosfato de potássio monobásico: 0,2g
Cloreto de magnésio: 0,1g
Hidratar em 1000 ml de água deionizada. Autoclavar (121 ºC /15 min) e estocar a 4ºC.