¶ Folha resumo
|
Macroprocesso: 23 - Inspeção de Produtos de Origem Animal e Vegetal |
Objetivo: Orientar e padronizar os procedimentos no âmbito do MoluBiS. Esclarecer os critérios a serem utilizados para a definição de retirada de moluscos bivalves e liberação de área suspensa, de acordo com as normas do Programa e com as metodologias analíticas oficiais. Orientar para a adequada operacionalização da coleta e remessa de amostras destinadas às análises laboratoriais realizadas pelo Programa. Auxiliar a implementação do Programa pelo serviço veterinário oficial. |
|||
|
Processo: 23.05 - Monitorar a qualidade e segurança de produtos de origem animal e vegetal |
||||
|
Entrega: Qualidade e segurança dos produtos de origem animal e vegetal |
Público alvo e demais interessados: Órgão executores de sanidade agropecuária - OESA Serviço veterinário oficial - SVO Setor produtivo de malacocultura |
Versão do documento: 5.0 |
||
|
Setor responsável e responsabilidades Departamento de Saúde Animal: Responsável por elaborar e revisar o manual sempre que houver necessidade para atendimento ou atualização com base nas leis, regulamentações e normas internas aplicáveis. |
||||
¶ 1. Definições e conceitos
I - acabamento: etapa do processamento de moluscos bivalves vivos em ambientes naturais ou instalações de estabelecimentos processadores, com vistas à limpeza de suas conchas, remoção de areia, lama ou lodo, a preservação ou melhoria das suas características organolépticas e alcance de boas condições de vitalidade ao longo do processo produtivo;
II - afinação: etapa do processamento de moluscos bivalves vivos, na qual os animais provenientes de uma área de vigilância com categoria "Liberada sob condição" são transportados para zonas de afinação, onde permanecem em ambiente natural durante o tempo necessário para a eliminação ou redução de micro-organismos contaminantes a níveis aceitáveis para o consumo humano;
III - águas continentais: aquelas que correm ou se acumulam na superfície dos continentes, formando lagos, lagoas e rios;
IV - alerta: condição especial além da vigilância de rotina, deflagrada em áreas de vigilância que tenham resultados de contagem de microalgas nocivas acima do esperado para a região, podendo implicar na intensificação de coleta de amostras de água, de moluscos bivalves e no acionamento de pontos de coleta secundários;
V - área de vigilância: espaço geográfico contemplando extração ou cultivos de moluscos bivalves em ambiente natural, viveiros ou tanques de cultivo, nos quais os procedimentos de retirada encontram-se condicionados a resultados de ensaios laboratoriais microbiológicos, de ficotoxinas, de contaminantes inorgânicos e de hidrocarbonetos policíclicos aromáticos, obtidos de pelo menos um ponto de coleta;
VI - cianotoxinas: grupo de toxinas produzidas principalmente por cianobactérias, também conhecidas como microalgas azuis ou verdes, comumente associadas a ambientes de água doce expostos a altos níveis de matéria orgânica em suspensão que propiciam a multiplicação desordenada dessas espécies e, por conseguinte, a produção de toxinas;
VII - contaminantes: agentes microbiológicos, compostos orgânicos e inorgânicos, ou quaisquer outras substâncias indesejáveis nas partes comestíveis dos moluscos bivalves ou na água que, quando presentes em concentrações acima do limite pré-estabelecido nos alimentos, podem causar intoxicação ou doenças nos humanos ou nos animais;
VIII - depuração: Processo aplicado aos moluscos bivalves com a finalidade de reduzir sua contaminação microbiana a níveis aceitáveis para o consumo humano por meio da manutenção de moluscos bivalves vivos por um período de tempo aprovado, em ambiente controlado da estação depuradora de moluscos bivalves, com água salgada natural ou artificial, tratada ou não tratada, adequada ao processo;
IX - estabelecimento processador: estabelecimento de pescado e derivados registrado no órgão de inspeção oficial no qual são realizadas as etapas do processamento;
X - estação depuradora: estabelecimento processador registrado no órgão de inspeção oficial destinado às etapas de recepção, depuração, acondicionamento, rotulagem, armazenagem e expedição de moluscos bivalves;
XI - eventos excepcionais: situações imprevistas que possam levar à contaminação microbiológica, química ou física de moluscos bivalves, tornando-os impróprios para o consumo;
XII - ficotoxinas: substâncias tóxicas termoestáveis produzidas por variadas espécies de microalgas nocivas que, no processo de filtração, são incorporadas pelos moluscos bivalves, destacando-se dentre elas as saxitoxina e derivados, ácido ocadáico e derivados, yessotoxinas, azaspirácidos, ácido domóico e brevetoxinas;
XIII - laboratórios credenciados: laboratórios públicos ou privados, homologados pelo Ministério da Agricultura e Pecuária para realizar ensaios laboratoriais em atendimento, de forma complementar, às demandas dos programas e controles oficiais do referido Ministério, no âmbito do Sistema Unificado de Atenção à Sanidade Agropecuária - SUASA;
XIV - laboratórios oficiais: Laboratórios Federais de Defesa Agropecuária, incluindo suas unidades avançadas que realizam ensaios laboratoriais necessários para o atendimento às demandas dos programas e controles oficiais do Ministério da Agricultura e Pecuária, no âmbito do Sistema Unificado de Atenção à Sanidade Agropecuária;
XV - manual estadual do Programa: Elaborado pela Superintendência Federal de Agricultura em conjunto com os Órgãos Estaduais de Sanidade Agropecuária nas unidades federativas, aprovado pela Secretaria de Defesa Agropecuária, específico para cada Unidade Federativa e de acordo com as particularidades de cada região, para a orientação de detalhes da vigilância prevista no Programa MoluBiS;
XVI - hidrocarbonetos policíclicos aromáticos: contaminantes químicos de composição orgânica, sendo alguns de alto potencial carcinogênico, originados em ambientes naturais ou gerados durante a combustão incompleta ou pirólise de matéria orgânica em vários processos industriais;
XVII - moluscos bivalves: animais invertebrados aquáticos filtradores, caracterizados pela presença de concha carbonatada composta de duas valvas, tais como ostras, mexilhões, vieiras e berbigões;
XVIII - ponto de coleta: local com coordenadas pré-definidas e raio máximo de 50 metros para tomada de amostras de moluscos bivalves e de água utilizadas no programa;
XIX - processamento: contempla as etapas de recepção, acabamento ou depuração, lavagem, manipulação, industrialização, fracionamento, conservação, armazenamento, acondicionamento, embalagem, rotulagem e expedição de moluscos bivalves ou seus produtos, realizadas em estabelecimentos processadores;
XX - retirada: ato de remover, extrair, coletar moluscos bivalves de locais de cultivo ou bancos naturais com a finalidade de consumo humano ou animal;
XXI - serviço oficial de saúde animal: autoridades governamentais nas instâncias federal e estadual, pertencentes ao Ministério da Agricultura e Pecuária e aos Órgãos Estaduais de Sanidade Agropecuária nas unidades federativas, responsáveis pela coordenação, regulamentação, execução ou supervisão dos planos de vigilância oficial em saúde animal, planos nacionais de vigilância para detecção precoce, planos de contingência e dos programas nacionais de controle de doenças animais;
XXII - tratamento pelo calor: utilização das técnicas de cocção, esterilização pelo calor úmido ou demais processos aprovados pelo órgão de inspeção oficial que garantam a inocuidade dos moluscos a serem consumidos;
XXIII - zona de acabamento: área de ambiente natural marinho, lagunar, estuarino ou de águas continentais, claramente delimitada por boias, postes ou quaisquer outros meios fixos, utilizada exclusivamente para o acabamento; e
XXIV - zona de afinação: área de ambiente natural marinho, lagunar, estuarino ou de águas continentais, claramente delimitada por boias, postes ou quaisquer outros meios fixos e utilizada exclusivamente para a afinação.
¶ 2. Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário pelo Departamento de Saúde Animal (DSA/SDA).
A gestão desse manual está sob a responsabilidade do Departamento de Saúde Animal (DSA/SDA), que prestará auxílio ao público-alvo leitor. Dúvidas e/ou sugestões quanto a aplicação deste manual deve ser submetida ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da Secretaria de Defesa Agropecuária (SDA) para acesso pelo público-alvo será de responsabilidade da Secretaria representada pelo Departamento de Saúde Animal (DSA/SDA).
¶ 3. Objetivo
O presente manual inclui orientações sobre a coleta e remessa de amostras oficiais do MoluBiS, utilizadas para a classificação de áreas monitoradas e para a definição da retirada de moluscos bivalves provenientes de extração ou cultivo, com o objetivo de orientar e padronizar os procedimentos no âmbito do Programa.
Neste sentido, o manual apresenta o detalhamento dos procedimentos, a saber:
- Amostras para Análise de contaminantes microbiológicos em moluscos bivalves;
- Amostras para Análise de microalgas nocivas produtoras de toxinas na água;
- Amostras para Análise de ficotoxinas contaminantes em moluscos bivalves;
- Amostras para Análise de contaminantes inorgânicos e hidrocarbonetos policíclicos aromáticos (HPAs) em moluscos bivalves;
- Orientações para a classificação das áreas de vigilância;
- Orientações para a Definição da Retirada de Moluscos Bivalves nas áreas monitoradas; e
- Roteiro para Implementação do Programa Nacional Moluscos Bivalves Seguros - MoluBiS.
¶ 3.1. Apresentação
O Programa Nacional Moluscos Bivalves Seguros - MoluBiS (PORTARIA SDA/MAPA N°884 de 06/09/2023) - é um programa, sob a abordagem em saúde única, de monitoramento periódico de contaminantes em áreas primárias de produção de ostras, mexilhões, vieiras e berbigões, ou outros moluscos bivalves, se houver, com o objetivo de assegurar a saúde pública. O MoluBiS estabelece, em âmbito nacional, o controle higiênico-sanitário dos moluscos bivalves destinados ao consumo humano ou animal, de acordo com requisitos mínimos necessários para a garantia de inocuidade e qualidade, bem como monitora e fiscaliza o atendimento destes requisitos.
A execução da vigilância de contaminantes do Programa MoluBiS deve ocorrer nas áreas de vigilância, baseando-se na determinação da concentração de:
- contaminantes microbiológicos em moluscos bivalves;
- microalgas nocivas produtoras de toxinas na água;
- ficotoxinas contaminantes em moluscos bivalves;
- contaminantes inorgânicos em moluscos bivalves; e
- hidrocarbonetos policíclicos aromáticos em moluscos bivalves;
Os resultados da vigilância devem condicionar a estratégia de novas coletas e o controle da retirada de moluscos bivalves. A critério da Secretaria de Defesa Agropecuária do Ministério da Agricultura e Pecuária, poderão ser publicadas normas complementares que incluam a vigilância de outros contaminantes ou patógenos específicos que possam representar risco à saúde humana ou animal.
Na água do mar são monitoradas de forma quantitativa e qualitativa as microalgas produtoras de toxinas, enquanto na parte comestível dos moluscos bivalves são monitoradas:
- a concentração de Escherichia coli (E. coli)
- as toxinas específicas que provocam intoxicação paralisante PSP (Paralytic Shellfish Poisoning), intoxicação diarreica DSP (Diarrhetic Shellfish Poisoning), intoxicação amnésica ASP (Amnesic Shellfish Poisoning) e intoxicação por consumo de azaspirácidos – AZP;
- as concentrações de cádmio, chumbo e mercúrio; e
- as concentrações de benzo(a)pireno e da soma de benzo(a)pireno, benzo(a)antraceno, benzo(b)fluoranteno e criseno.
A vigilância de contaminantes microbiológicos, baseada na concentração de Escherichia coli (E. coli) na parte comestível do molusco bivalve, é utilizada também como indicador indireto de contaminação por outras enterobactérias de interesse em saúde pública e de poluição por ação antrópica ao meio ambiente de cultivo dos animais.
Cabe ressaltar que a implementação do programa é fundamental em função do impacto gerado para a saúde pública. Apesar de os moluscos bivalves advindos de locais sem o monitoramento do MoluBiS estarem impedidos de serem comercializados, a população local consome esses animais e está exposta aos riscos advindos das ficotoxinas e demais contaminantes microbiólogicos, inorgânicos e HPAs.
O Programa MoluBiS possui uma página específica dentro do site do Ministério da Agricultura e Pecuária, para acessar clique https://www.gov.br/agricultura/pt-br/assuntos/sanidade-animal-e-vegetal/saude-animal/programas-de-saude-animal/vigilancia-de-contaminantes-em-moluscos-bivalves/vigilancia-de-contaminantes-em-moluscos-bivalves
¶ 3.2. Introdução
O Programa Nacional de Moluscos Bivalves Seguros - MoluBiS, instituído pela Portaria SDA/MAPA N° 884, de 6 de setembro de 2023, foi elaborado para monitorar áreas onde ocorre a extração ou produção de moluscos bivalves (ostras, berbigões, vieiras, mexilhões e etc.) destinada ao consumo humano ou animal. Este programa substitui o antigo PNCMB.
Os moluscos bivalves se alimentam retirando partículas orgânicas por processo de filtração da água. Por essa razão, além do alimento, composto de matéria orgânica e microalgas, esses animais podem acumular substâncias tóxicas ou organismos patogêncios que estejam presentes na água.
No ambiente aquático existem naturalmente alguns organismos microscópicos capazes de produzir substâncias denominadas biotoxinas marinhas. Tais substâncias são perigosas para a saúde humana e de outros animais. As biotoxinas são resistentes ao calor e não são eliminadas com o cozimento, ou em outro tipo de processamento.
O consumo de moluscos bivalves contaminados com biotoxinas pode levar a sérias complicações à saúde, tais como diarréia, vômitos, dores abdominais, amnésia, distúrbios cardíacos, nervosos e respiratórios, convulsão e, em casos extremos, a coma e morte. Além de biotoxinas marinhas, outros perigos a serem monitorado são a presença de metais pesados, HPAs e microrganismos patogênicos que eventualmente possam estar presentes na água e que também podem ser acumulados. O monitoramento destes organismos reduz o risco de transmissão de doenças, infecções e intoxicações ao consumidor e garante a segurança alimentar desses produtos. O monitoramento dos bivalves é realizado justamente para verificar se é seguro ou não proceder à retirada ou consumo dos moluscos.
O MoluBiS abrange as etapas de retirada, trânsito e processamento de moluscos bivalves destinados ao consumo humano ou animal. Ao MAPA cabe a gestão nacional do Programa e a fiscalização e a inspeção industrial dos processadores de moluscos bivalves registrados no Serviço de Inspeção Federal - SIF. A fiscalização das etapas de retirada e trânsito, no que concerne à saúde animal, cabe aos Órgãos Estaduais de Sanidade Agropecuária - OESA nas unidades federativas. A fiscalização da etapa de processamento cabe ao órgão de inspeção oficial, no âmbito do regulamento de inspeção industrial e sanitária de produtos de origem animal.
O programa foi estruturado para garantir a qualidade e inocuidade de moluscos bivalves, desde a produção primária, por meio de:
- coleta de amostras;
- classificação de áreas;
- definição das condições de retirada e trânsito desses animais; e
- Definição da destinação dos mesmos quando do beneficiamento em estabelecimento sob supervisão dos diferentes níveis do serviço oficial de inspeção.
Neste sentido, o OESA elabora um Manual Estadual do Programa contendo: a definição de áreas, o plano amostral de coletas periódicas, os sitemas de alerta e os mecanismos de fechamento e abertura de áreas. A amostragem é realizada em locais georreferenciados de cultivo e/ou extração de moluscos bivalves. Ao MAPA cabe a validação do Manual Estadual do programa, elaborado pelas Unidades Federativas, contendo a orientação de detalhes da vigilância prevista no Programa MoluBiS.
Após a classificação de áreas e, conforme os resultados das análises, a retirada dos moluscos poderá ser suspensa ou liberada. Há ainda a possibilidade de a retirada ser liberada sob condição, o que significa que os moluscos deverão passar por um processo de depuração e/ou tratamento térmico, conforme determinação do serviço oficial de inspeção.
¶ 4. Procedimentos
¶ 4.1. Instruções Gerais
¶ 4.1.1. Áreas de Vigilância
Cabem aos OESAs o mapeamento e identificação de áreas estaduais de interesse onde ocorre a extração ou cultivo de moluscos bivalves (fig 1) para posterior delimitação e nomeação (fig 2). As Áreas de Vigilância delimitadas devem considerar as características limnológicas ou oceanográficas da região, com o objetivo de garantir que as amostras coletadas sejam representativas de toda a área monitorada. Deve-se nomear todas as áreas de vigilância de maneira clara e objetiva (exemplo: Praia vermelha ou Área de vigilância I).
As coletas serão realizadas em todas as áreas de vigilância listadas no Manual Estadual do Programa, respeitando o número e a periodicidade previamente estabelecidos.
Cada área de vigilância deve ter coletada amostras para a análise de todos os contaminantes previstos na norma, utilizando a espécie sentinela e/ou aquela utilizada para vigilância de espécies.
Figura 1. Exemplo de identificação de área onde ocorre extração ou cultivo.
Figura 2. Delimitação de uma Área de Vigilância
¶ 4.1.2. Pontos de Coleta
As amostras devem ser coletadas nos pontos de coleta estabelecidos no Manual Estadual do Programa de acordo com os critérios definidos nos procedimentos de amostragem. É aceitável uma variação posicional de mais ou menos 50 m, com exceção dos moluscos bivalves fossoriais colhidos no fundo, onde admite-se maior variação posicional, desde que registrada a observação no formulário de envio de amostras.
Em cada área de vigilância devem ser definidos vários pontos de coleta, que podem ser classificados como primários ou secundários, a depender do plano amostral estabelecido em cada região. Serão considerados primários os pontos de coleta de rotina e secundários aqueles adicionais, acionados quando do acompanhamento em situações de alerta ou de ocorrência de eventos excepcionais.
Os pontos de coleta para análise de contaminantes microbiológicos, ficotoxinas, microalgas potencialmente produtoras de toxinas, contaminantes inorgânicos e HPAs poderão coincidir entre si dentro de uma mesma área de vigilância.
Para a realização das análises previstas em norma são necessários a delimitação de, no mínimo:
- 5 (cinco) pontos primários para coleta de amostras de todos os contaminantes, coincidentes ou não; e
- 2 pontos secundários para coleta de amostras de ficotoxinas e microalgas potencialmente produtoras de toxinas.
¶ 4.1.3. Amostras
As amostras destinadas ao monitoramento previsto no Programa são de dois tipos: PARTE COMESTÍVEL DE MOLUSCOS BIVALVES e ÁGUA DO AMBIENTE.
As amostras da parte comestível de moluscos bivalves são utilizadas para a determinação da concentração de:
I - contaminantes microbiológicos (E. coli);
II - ficotoxinas contaminantes (saxitoxina (eq-STX.2HCL), ácido ocadáico (eq-AO), ácido domóico (AD) e azaspirácidos (AZP));
III - contaminantes inorgânicos (cádmio, chumbo e mercúrio); e
IV - hidrocarbonetos policíclicos aromáticos (benzo(a)pireno e (benzo(a)pireno + benzo(a)antraceno + benzo(b)fluoranteno + criseno)
As amostras de moluscos bivalves devem ser compostas de indivíduos vivos, de tamanho comercial e da espécie considerada sentinela para a vigilância de contaminantes. Os animais definidos como sentinelas são os mexilhões da espécie Perna perna, admitindo-se, na sua ausência, a espécie presente no local que, de acordo com estudos técnico-científicos, acumula os maiores níveis de contaminantes e atua como indicadora de contaminação. Além das espécies consideradas sentinelas de cada área de vigilância, podem também ser selecionadas outras espécies cultivadas ou extraídas no local para vigilância por espécie ou tomada de decisão para controle de retirada.
Deve-se estabelecer um rodízio entre os pontos primários de coleta definidos no Manual Estadual do Programa, de modo que cada nova coleta ocorra em um ponto diferente da coleta anterior e de que todos os pontos primários tenham amostras coletadas ao longo do ano.
Recomendamos que em áreas onde não haja o cultivo de mexilhões, sejam colocadas pencas destes moluscos para coleta de amostras, devendo ser alternados os pontos para evitar a viciação da amostragem.
As amostras de água do ambiente são utilizadas para identificação e quantificação das microalgas potencialmente produtoras de toxinas, eventualmente presentes nas áreas de cultivo de moluscos, por meio de análise qualitativa e quantitativa, respectivamente.
Recomenda-se que seja realizada a higienização do material a ser utilizado para coleta, bem como das mãos do responsável pela coleta antes do início dos procedimentos descritos nesse manual.
A coleta e a remessa das amostras da vigilância devem ser realizadas por:
I - médicos veterinários do serviço oficial de saúde animal;
II - demais servidores do serviço oficial de saúde animal mediante treinamento e publicação de ato normativo; ou
III - profissional privado, desde que devidamente habilitado, mediante treinamento e publicação de ato normativo.
As amostras para análises contaminantes mircobiológicos deverão ser remetidas ao laboratório separadas daquelas destinadas às demais análises previstas no Programa.
¶ 4.1.7. Material necessário para coleta de amostras
Considerando o volume das amostras necessárias e a frequência respectiva, torna-se necessário assegurar a existência do seguinte conjunto de equipamentos e materiais auxiliares:
- GPS portáteis
- Termômetro ou sonda multiparâmetro
- Máquinas fotográficas
- Redes de fitoplâncton de 20 µm de abertura de malha
- Mangueiras de colheita de água com válvula
- refratômetro de salinidade ou sonda multiparâmetro
- disco de Secchi
- Balde plástico
- Caixa térmica para transporte
- Caneta permanente ou lápis para identificação
- Etiquetas
- Formulário Padrão
- Funil
- Garrafas (250mL e 500mL)
- Gelo
- Lacres numerados
- Sacos plásticos transparentes (Esterilizados)
- Solução de lugol*
- Balança digital portátil
- Prancheta
*Solução de lugol neutro (100%), 20 g de iodeto de potássio (IK), 10 g de iodo (I2), 200 ml de água destilada.
¶ 4.1.4. Não conformidade das amostras
Durante a recepção pelo laboratório, caso detectado que as amostras estão inaptas ou com não conformidade elas serão descartadas adequadamente.
Em seguida, o laboratório comunicará ao OESA sobre a necessidade de realização de nova coleta, por motivo de não conformidade.
¶ 4.2. Análise de contaminantes microbiológicos
¶ 4.2.1. Frequência
A vigilância de contaminantes microbiológicos (E. coli) é baseada na concentração de Escherichia coli (E. coli) por meio da determinação do número mais provável - NMP em amostras de moluscos bivalves
Para as análises deve ser coletada pelo menos uma amostra por espécie de cada área de vigilância, de acordo com as seguintes frequências:
- quinzenal onde ocorre vigilância oficial há menos de 18 (dezoito) meses; ou
- mensal onde ocorre vigilância oficial há mais de 18 (dezoito) meses.
¶ 4.2.1 Amostras
Para a análise de contaminantes microbiológicos é necessária a coleta de 1 (uma) amostra de 100g (cem gramas) cada da parte comestível de moluscos bivalves, obtida em um mesmo dia e de um único ponto de coleta em cada Área de vigilância.
Nos pontos de coleta em que forem identificadas, ou haja suspeita da presença, de fontes de contaminação da água, a coleta de amostras para análise de contaminantes microbiológicos poderá ser dirigida a esses locais com o intuito de identificar possíveis contaminações. Enquanto não haver indícios de contaminação da água, a coleta das amostras deverá permanecer aleatória e por meio de rodízio entre os pontos primários de coleta.
¶ 4.2.2 Coleta, preparo e acondicionamento (Figura 3)
Passo 1 – Trazer a bordo da embarcação uma “penca” de mexilhões em cada ponto de coleta.
Passo 2 – Coletar aleatoriamente de diferentes partes da penca, para compor 100g de parte comestível dos moluscos, aproximadamente 12 unidades de mexilhões com média de 7cm de comprimento, conforme Tabela 1.
| Média de comprimento | Quantidade | Peso aproximado da parte comestível |
|---|---|---|
| 5 – 6cm | 14 unidades de mexilhões | 100g |
| 6 – 7cm | 12 unidades de mexilhões | 100g |
| 7 – 8cm | 10 unidades de mexilhões | 100g |
| - | 500g de berbigões | 100g |
Tabela 1. Quantidade aproximada de moluscos necessários para compor 100 gramas da parte comestível.
Passo 3 – Lavar os moluscos com água do mar limpa, retirando o máximo possível do material aderido às conchas.
Passo 4 – Embalar em saco plástico devidamente etiquetado e fechado (embalagem primária).
Passo 5 - Embalar novamente em saco plástico e lacrar o pacote (embalagem secundária)
Passo 6 - Acondicionar em caixa térmica com gelo (até 10°C).
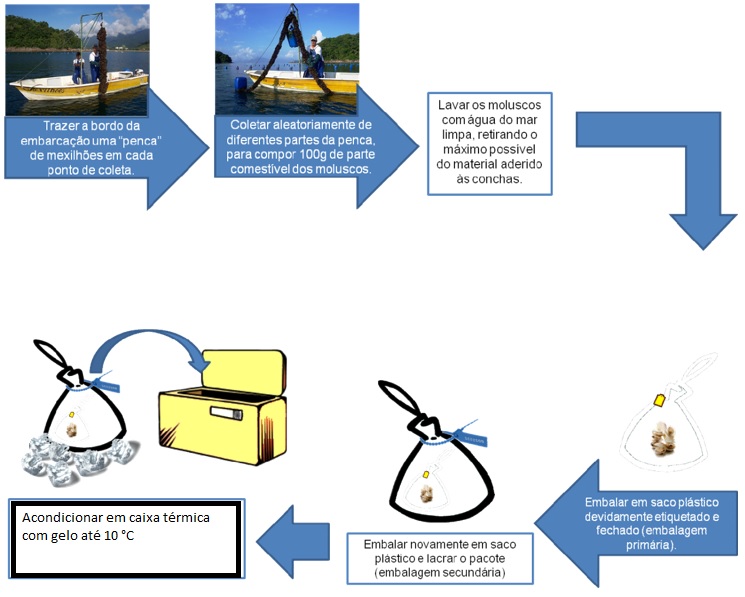
Figura 3. Procedimento de coleta de moluscos para pesquisa de micro-organismos contaminantes.
¶ 4.2.3 Remessa e transporte
Para a remessa, as amostras de moluscos devem ser devidamente embaladas, lacradas, acondicionadas e encaminhadas aos laboratórios com as respectivas vias do formulário de coleta e envio (Anexo B) preenchido e assinado pelo responsável pela coleta. As amostras de moluscos bivalves deverão ser embaladas individualmente e posteriormente reunidas em uma embalagem única que deverá ser lacrada.
As amostras destinadas às análises de contaminantes microbiológicos deverão ser transportadas até o laboratório de rede oficial responsável pela análise (LFDA ou laboratório credenciado) sob refrigeração constante, assegurando a manutenção da temperatura entre 0 °C (zero grau Celsius) e 10°C (dez graus Celsius) durante o transporte.
O acondicionamento e o transporte das amostras destinadas às análises de E. coli devem ser realizados de modo a evitar o congelamento, respeitando-se o intervalo ideal de até de 24 (vinte e quatro) horas entre a coleta e o início da análise laboratorial e não se execedendo o prazo máximo permitido de 48 (quarenta e oito) horas.
¶ 4.3 Análise de microalgas nocivas produtoras de toxinas
¶ 4.3.1. Frequência e níveis de alerta
A vigilância de microalgas nocivas deve ser realizada por meio da identificação morfológica no nível taxonômico de gênero e, se possível, de espécie, além da contagem de células em amostras de água das áreas de vigilância.
Devem ser coletadas amostras de água, para identificação morfológica e contagem de microalgas nocivas, das áreas de vigilância e dados ambientais, com periodicidade mínima quinzenal, juntamente com a coleta de moluscos bivalves para a determinação da concentração de ficotoxinas contaminantes.
A observação de incremento significativo das populações de microalgas nocivas implica no aumento da frequência de coleta de água e de moluscos bivalves para a determinação da concentração de ficotoxinas contaminantes, a depender de diferentes níveis de alerta estabelecidos no manual estadual do Programa.
Devem ser estabelecidos, no mínimo, dois níveis de alerta diferentes em relação a intervalos de valores de contagem de microalgas nocivas e definidos no manual estadual do Programa.
O primeiro nível de alerta, considerado mais baixo, implica na intensificação da coleta de amostras de água. Níveis de alerta posteriores, considerados mais altos que o primeiro nível de alerta, implicam na intensificação da coleta de amostras de moluscos e no acionamento de pontos de coleta secundários de vigilância.
Em cultivos de moluscos de água doce, deve ser implementada a vigilância de cianobactérias e cianotoxinas, respeitando-se os limites establecidos em legislação específica de qualidade da água para consumo humano e seu padrão de potabilidade.
Quando a contagem de células de cianobactérias exceder 20.000 células/mL, deve-se realizar análise das cianotoxinas microcistinas, saxitoxinas e cilindrospermopsinas no ponto de captação com frequência no mínimo semanal, de modo que as análises de cianotoxinas no ponto de captação devem permanecer enquanto se mantiver contagem de células de cianobactérias superior a 20.000 células/mL (Portaria GM/MS N° 888/2021).
¶ 4.3.2 Amostras
Para as análises de microalgas potencialmente produtoras de toxinas são necessárias, no mínimo, a coleta de 1 amostra de 250 (duzentos e cinquenta) mL de água marinha para análise quantitativa e 1 (uma) amostra concentrada de rede de fitoplâncton para análise qualitativa, por área de vigilância (Figura 4).

Figura 4. Rede de fitoplâncton. Fonte. Mathias Schramm. IFSC.
Em cada área de vigilância, deve ser coletada pelo menos uma amostra utilizando amostrador tubular tipo Bailer ou mangueira de coleta de água e pelo menos uma utilizando rede de fitoplâncton (fig 4) , devendo ambas serem fixadas com lugol neutro (fig 5).
.png)
Figura 5. Fixação de amostras com lugol neutro. Fonte. Mathias Schramm. IFSC
Os dados ambientais, referentes às amostras de água, a serem coletados e registrados nos formulários de coleta são:
- temperatura (ºC), utilizando-se um termômetro ou sonda multiparâmetro;
- salinidade, utilizando-se um refratômetro de salinidade ou sonda multiparâmetro; e
- transparência (m), utilizando-se um disco de Secchi (figura 6)

Figura 6. Disco de Secchi. Fonte. Mathias Schramm. IFSC
¶ 4.3.3 Coleta, preparo e acondicionamento
¶ 4.3.3.1. Coleta de amostras para análise qualitativa (rede de fitoplâncton) (Figura 7)
Passo 1 – Lançar na água a rede de fitoplâncton previamente limpa e deixar afundar sem que toque o fundo.
Passo 2 – Recolher a rede lentamente na vertical para que filtre a água, concentrando o material em suspensão. Repetir esse procedimento por duas ou três vezes, dependendo da profundidade do local até que seja visível a concentração do material. Drenar o excesso de água para que o material filtrado seja retido no copo.
Passo 3 – Passar o conteúdo do copo para garrafa (embalagem primária) de amostra devidamente identificada com o termo REDE.
Passo 4 - Caso necessário, completar o volume da garrafa com água do local.
Passo 5 – Lavar a rede com água do local em fluxo contrário ao de filtração.
Passo 6 - Fixar com lugol 1%, sendo considerada amostra fixada (adicionar 2,5mL de lugol na garrafa de 250ml de água para alcançar a concentração de 1%).
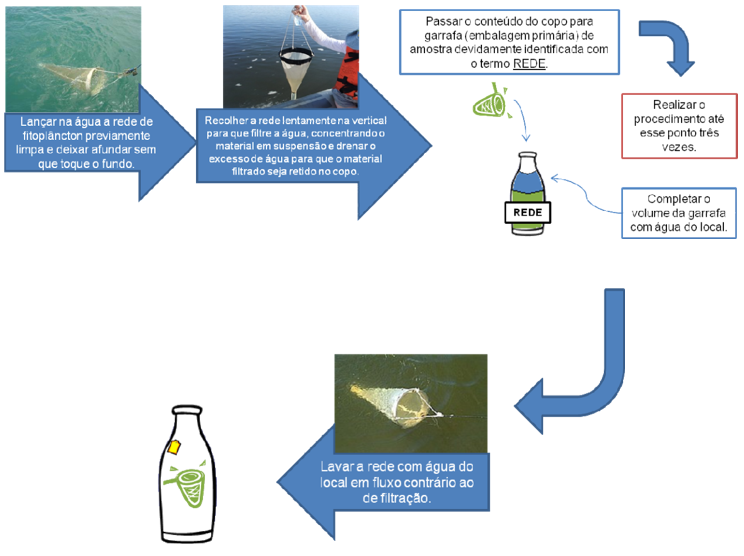
Figura 7. Procedimento de coleta de amostras utilizando rede de fitoplâncton.
¶ 4.3.3.2. Coleta de amostras para análise quantitativa (fig 8)
Passo 1 – Lançar lentamente na água a mangueira previamente limpa com a válvula superior aberta e deixar afundar sem que toque o fundo.
Passo 2 – Com o espaço interno da mangueira preenchido com água, fechar a válvula superior e recolher a mangueira.
Passo 3 – Drenar o conteúdo da mangueira em balde, previamente limpo.
Passo 4 - Realizar os passos de 1 a 3, pelo menos três vezes.
Passo 5 – Passar uma parte do conteúdo do balde para garrafa (embalagem primária) de amostra de 250mL devidamente identificada com o termo MANGUEIRA com o auxílio de um funil.
Passo 6 - Fixar a amostra com solução de lugol neutro a 1%. (ex: 2,5 ml em 250 ml de amostra)
Passo 6 – Lavar a mangueira e demais utensílios com água do local.
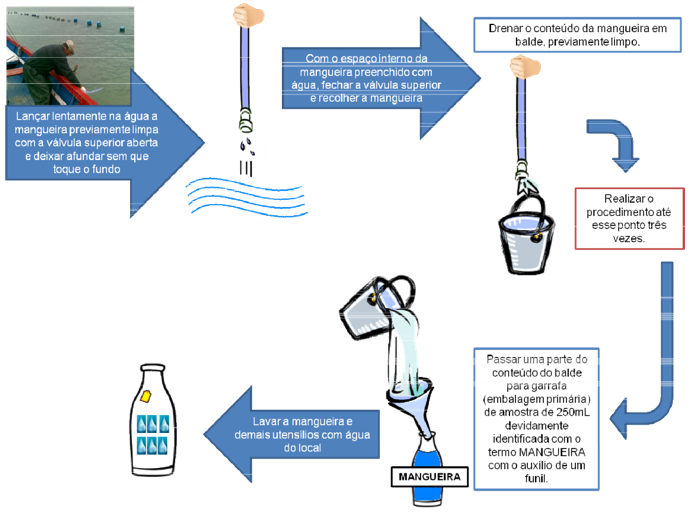
Figura 8. Procedimento de coleta de amostras de água para análises de microalgas.
¶ 4.3.4 Remessa e transporte
Para a remessa, as amostras de água devem ser devidamente embaladas, lacradas, acondicionadas e encaminhadas aos laboratórios com as respectivas vias do formulário de coleta e envio (Anexo B) preenchido e assinado pelo responsável pela coleta. As amostras de água marinha e de rede de fitoplâncton, estas deverão ser lacradas individualmente em garrafas destinadas ao armazenamento da amostra.
As amostras destinadas às análises de água deverão ser transportadas até o laboratório de rede oficial responsável pela análise (LFDA ou laboratório credenciado) sob temperatura ambiente durante o transporte.
O intervalo entre a coleta e o processamento das amostras no laboratório não deverá exceder 72 (setenta e duas) horas
¶ 4.4 Análise de ficotoxinas contaminantes
¶ 4.4.1 Frequência e níveis de alerta
A vigilância de ficotoxinas contaminantes deve ser baseada na determinação ou estimativa da concentração de ficotoxinas (saxitoxina (eq-STX.2HCL), ácido ocadáico (eq-AO), ácido domóico (AD) e azaspirácidos (AZP)) produzidas por microalgas nocivas nas partes comestíveis dos moluscos bivalves.
Para as análises de ficotoxinas contaminantes, deve ser coletada pelo menos uma amostra por espécie de cada área de vigilância com periodicidade quinzenal.
Conforme item 4.3.1. o estabelecimentos de níveis de alerta posteriores ao primeiro nível de alerta implicam na intensificação da coleta de amostras de moluscos e no acionamento de pontos de coleta secundários de vigilância.
¶ 4.4.2. Amostras
Para a análise de ficotoxinas contaminantes é necessária a coleta de 1 (uma) amostra composta da parte comestível de moluscos bivalves, obtidas em um mesmo dia e do mesmo ponto de coleta em uma mesma Área de vigilância.
Deve-se estabelecer o rodízio entre os cinco pontos de coleta delimitados no Manual Estadual do Programa.
O número de indivíduos que compõe uma amostra varia de acordo com a espécie e tabela 2 abaixo.
¶
| Espécie | Quantidade mínima da amostra |
|---|---|
| Mexilhão (Mytilus spp.) | 30 unidades |
| Ostra (Crassostrea spp.) | 10 a 15 unidades |
| berbigão ou sarnambi (Anomalocardia spp.) | 70 unidades |
| sururu (Mytella falcata) | 100 unidades |
|
Vieira (Pecten maximus) |
10 a 15 unidades |
Tabela 2. Quantidade aproximada de moluscos necessários para compor uma amostra da parte comestível.
¶ 4.4.3 Coleta, preparo e acondicionamento
Passo 1 – Trazer a bordo da embarcação uma “penca” de mexilhões.
Passo 2 – Coletar aleatoriamente de diferentes partes da penca, para compor o número de animais da amostra, conforme Tabela 2 acima.
Passo 3 – Lavar os moluscos retirando o máximo possível do material aderido às conchas.
Passo 4* – Opcional: Desconchar os animais.
Passo 5 - Embalar em saco plástico devidamente etiquetado e fechado (embalagem primária).
Passo 6 - Embalar novamente em saco plástico e lacrar o pacote (embalagem secundária)
Passo 7 - Acondicionar em caixa térmica com gelo para resfriamento.
* O desconchamento não é obrigatório; é uma alternativa aos coletores para facilitar o congelamento, embalagem e envio das amostras ao laborátório, especialmente a partir daquelas regiões mais distantes.
¶ 4.4.4 Remessa e transporte
Para a remessa, as amostras de moluscos devem ser devidamente embaladas, lacradas, acondicionadas e encaminhadas aos laboratórios com as respectivas vias do formulário de coleta e envio (Anexo B) preenchido e assinado pelo responsável pela coleta. As amostras de moluscos bivalves deverão ser embaladas individualmente e posteriormente reunidas em uma embalagem única que deverá ser lacrada.
As amostras destinadas às análises de ficotoxinas contaminantes deverão ser transportadas até o laboratório de rede oficial responsável pela análise (LFDA ou laboratório credenciado)sob refrigeração constante, assegurando a manutenção da temperatura entre 0 °C (zero grau Celsius) e 10°C (dez graus Celsius) durante o transporte, ou congeladas.
O intervalo entre a coleta e o processamento das amostras no laboratório não deverá exceder 72 (setenta e duas) horas.
¶ 4.5 Análise de contaminantes inorgânicos e hidrocarbonetos policíclicos aromáticos (HPAs)
¶ 4.5.1 Frequência
A vigilância de contaminantes inorgânicos (COI) deve ser estabelecida por meio da determinação das concentrações de cádmio, chumbo e mercúrio nas partes comestíveis dos moluscos bivalves.
A vigilância de hidrocarbonetos policíclicos aromáticos (HPAs) deve ser estabelecida por meio da determinação das concentrações de benzo(a)pireno e da soma de benzo(a)pireno, benzo(a)antraceno, benzo(b)fluoranteno e criseno nas partes comestíveis de moluscos bivalves.
Para as análises de contaminantes inorgânicos e hidrocarbonetos policíclicos aromáticos (HPAs), deve ser coletada pelo menos uma amostra por espécie de cada área de vigilância com periodicidade anual. A frequência de coletas deve ser aumentada em regiões com histórico de contaminação.
¶ 4.5.2 Amostras
Para as análises de contaminantes inorgânicos e hidrocarbonetos policíclicos aromáticos, cada amostra deve conter a quantidade de indivíduos suficiente para se obter 500 g de partes comestíveis de moluscos bivalves.
¶ 4.5.3 Coleta, preparo e acondicionamento
Passo 1 – Trazer a bordo da embarcação uma “penca” de mexilhões.
Passo 2 – Coletar aleatoriamente de diferentes partes da penca, para compor 500g de partes comestíveis.
Passo 3 – Lavar os moluscos retirando o máximo possível do material aderido às conchas.
Passo 4 – Opcional: desconchar* os animais.
Passo 5 - Embalar em papel alumínio (embalagem primária)**.
Passo 6 - Embalar novamente em saco plástico, devidamente etiquetado e lacrar o pacote (embalagem secundária)
Passo 7 - Acondicionar em caixa térmica com gelo para resfriamento.
*O desconchamento não é obrigatório; é uma alternativa aos coletores para facilitar o congelamento, embalagem e envio das amostras ao laborátório, especialmente a partir daquelas regiões mais distantes.
**A mesma amostra colhida para a análise de ficotoxinas pode ser utilizada para a análise anual de HPAs e COI; entretanto, caso se decida usar essa alternativa, a embalagem primária deverá ser, obrigatoriamente, papel alumínio. Caso contrário, a amostra será rejeitada pelo laboratório.
¶ 4.5.4 Remessa e transporte
Para a remessa, as amostras de moluscos devem ser devidamente embaladas, lacradas, acondicionadas e encaminhadas aos laboratórios com as respectivas vias do formulário de coleta e envio (Anexo B) preenchido e assinado pelo responsável pela coleta. O envio de amostras para a realização da análise de HPAs e COI sem a embalagem primária em papel alumínio acarretará na rejeição da amostra pelo laboratório responsável. As amostras de moluscos bivalves deverão ser embaladas individualmente e posteriormente reunidas em uma embalagem única que deverá ser lacrada.
As amostras destinadas às análises contaminantes inorgânicos e hidrocarbonetos policíclicos aromáticos deverão ser transportadas até o laboratório de rede oficial responsável pela análise (LFDA ou laboratório credenciado)sob refrigeração constante, assegurando a manutenção da temperatura entre 0 °C (zero grau Celsius) e 10°C (dez graus Celsius) durante o transporte, ou congeladas.
O intervalo entre a coleta e o processamento das amostras no laboratório não deverá exceder 72 (setenta e duas) horas.
Quando do envio de amostras para as análises de contaminantes inorgânicos e hidrocarbonetos policíclicos aromáticos, pode-se aproveitar a quantidade enviada para as análises de ficotoxinas contaminantes. Nesses casos, deve-se assinalar no formulário a realização de todas as análises previstas, utilizar a embalagem primária de papel alumínio e enviar as amostras para o SLAV-SC, o qual se responsabilizará pelo envio posterior das amostras, a partir do SLAV-SC para o LFDA-RS.
¶ 4.6. Orientações para a classificação das áreas de vigilância
¶ 4.6.1. Informações gerais
Todas as áreas de vigilância devem ser classificadas de acordo com o nível de contaminação, com base na série temporal de resultados de análises (E. coli) de amostras de moluscos bivalves. Essa classificação pode ser feita de maneira independente para diferentes espécies de moluscos bivalves, devendo, na ausência de vigilância por espécie, prevalecer a classificação baseada naquela considerada sentinela de cada área respectiva.
O serviço oficial de saúde animal pode excluir da série temporal utilizada para determinar a classificação de uma área de vigilância, os resultados considerados fora do intervalo esperado, desde que ocasionados por eventos excepcionais de duração máxima de 30 (trinta) dias.
¶ 4.6.2. Classificação inicial
Para as áreas de vigilância onde não existe histórico de resultados de análises para E. coli, ou que tiveram a sua classificação suspensa, a classificação deve ser feita após a obtenção de, pelo menos, 12 (doze) resultados obtidos mediante inspeções com coleta e envio de amostras para análise laboratorial, com frequência mínima quinzenal e tolerância máxima de três dias úteis nos casos fortuitos que determinem a impossibilidade de coleta ou envio de amostras. A contagem de resultados será reiniciada sempre que a frequência mínima e sua tolerância máxima não forem respeitados.
As áreas de vigilância devem ser classificadas considerando-se intervalos pré-definidos de número mais provável - NMP de E. coli por 100 (cem) g de partes comestíveis, de acordo com as seguintes categorias:
| Categoria de Classificação | Condições |
|
Classe A |
todos os resultados da série temporal menores ou iguais a 700 (setecentos) NMP de E. coli e 80% (oitenta por cento) dos resultados menores ou iguais a 230 (duzentos e trinta) NMP de E. coli. |
|
Classe B |
todos os resultados da série temporal sejam menores ou iguais a 46.000 (quarenta e seis mil) NMP de E. coli e 90% (noventa por cento) das amostras tenham resultado menor ou igual a 4.600 (quatro mil e seiscentos) NMP de E. coli. |
|
Classe C |
todos os resultados da série temporal sejam menores ou iguais a 46.000 (quarenta e seis mil) NMP de E. coli |
¶ 4.6.3. Reclassificação de áreas
A partir da classificação inicial, as áreas de vigilância devem ter a sua classificação revisada com base em série temporal contendo 24 (vinte e quatro) resultados a cada novo resultado de análise obtido, observando-se a frequência de coleta estabelecida.
Nos 24 (vinte e quatro) resultados mencionados no caput deste artigo, não se incluem os 12 (doze) resultados considerados na classificação inicial da área.
Após a obtenção de 24 (vinte e quatro) resultados, a revisão da classificação deve sempre considerar os últimos 24 (vinte e quatro) resultados obtidos, observando-se a frequência mínima quinzenal de coleta até o 18º (décimo oitavo) mês e mensal a partir do 19º (décimo nono) mês de vigilância e tolerância máxima de três dias úteis nos casos fortuitos que determinem a impossibilidade de coleta ou envio de amostras. A contagem de resultados será reiniciada sempre que a frequência mínima e sua tolerância máxima não forem respeitados.
¶ 4.6.4. Áreas de Vigilância com Classificação suspensa
As áreas de vigilância que não atenderem aos critérios de classificação pré-definidos devem ser denominadas como Classificação Suspensa. Quando o resultado NMP de E. coli por 100 (cem) g de partes comestíveis de moluscos bivalves em uma amostra for superior ao limite estabelecido para a Classe C, a área de vigilância será denominada como Classificação Suspensa e deverá ser iniciado novo processo de classificação.
¶ 4.7. Orientações para a Definição da Retirada de Moluscos Bivalves nas Áreas de Vigilância
¶ 4.7.1. Resultados das Análises e Definição da Retirada de Moluscos Bivalves
Os resultados da vigilância de contaminantes devem ser utilizados para a determinação da situação de retirada de moluscos bivalves, sendo possíveis as seguintes categorias:
- liberada;
- liberada sob condição; ou
- proibida.
Para a definição de retirada de moluscos bivalves serão considerados os seguintes valores das Tabelas 3 e 4 abaixo:
| Classificação de áreas (E.coli) | Limites máximos de ficotoxinas* em 1 quilograma (Kg) da parte comestível dos moluscos bivalves | Limites máximos de contaminantes inorgânicos (IN ANVISA N° 160/2022) | Limites máximos de HPAs | |||||||
| moluscos bivalves provenientes de áreas: | PSP | DSP | ASP | AZP | Cádmio | Chumbo | Mercúrio | benzo(a)pireno | (benzo(a)pireno + benzo(a)antraceno + benzo(b)fluoranteno + criseno) | |
| Retirada liberada |
Classe A Zonas de Acabamento Zonas de Afinação |
<0,8mg (eq-STX.2HCL) |
<0,16mg (eq-AO) |
<20mg (AD) |
<0,16mg (eq-AZA1) |
<2,00 (mg/kg) | <1,5 (mg/kg) | <0,5 (mg/kg) | < 5 μg/kg | < 30 μg/kg |
| Retirada liberada sob condição |
Classe B Classe C |
<0,8mg (eq-STX.2HCL) |
<0,16mg (eq-AO) |
<20mg (AD) |
<0,16mg (eq-AZA1) |
<2,00 (mg/kg) | <1,5 (mg/kg) | <0,5 (mg/kg) | < 5 μg/kg | < 30 μg/kg |
| Retirada proibida |
Classificação Suspensa Não classificadas |
≥0,8mg (eq-STX.2HCL) |
≥0,16mg (eq-AO) |
≥20mg (AD) |
≥0,16mg (eq-AZA1) |
≥ 2,00 (mg/kg) | ≥ 1,5 (mg/kg) | ≥ 0,5 (mg/kg) | ≥ 5 μg/kg | ≥ 30 μg/kg |
Tabela 3. Critério para a definição de retirada de moluscos bivalves *Aplicáveis aos moluscos bivalves marinhos
| Classificação de áreas (E.coli) | Limites máximos de contaminantes inorgânicos (IN ANVISA N° 160/2022) | Limites máximos de HPAs | Padrão de Cianotoxinas da água para consumo humano - VMP (Portaria GM/MS N° 888/2021) | ||||||
| moluscos bivalves provenientes de áreas: | Cádmio | Chumbo | Mercúrio | benzo(a)pireno | (benzo(a)pireno + benzo(a)antraceno + benzo(b)fluoranteno + criseno) | Cilindrospermopsinas | Microcistinas (Eq-MCYST-LR) | Saxitoninas(Eq-STX) | |
| Retirada liberada |
Classe A Zonas de Acabamento Zonas de Afinação |
<2,00 (mg/kg) | <1,5 (mg/kg) | <0,5 (mg/kg) | < 5 μg/kg | < 30 μg/kg | < 1 μg/L | < 1 μg/L | < 3 μg/L |
| Retirada liberada sob condição |
Classe B Classe C |
<2,00 (mg/kg) | <1,5 (mg/kg) | <0,5 (mg/kg) | < 5 μg/kg | < 30 μg/kg | < 1 μg/L | < 1 μg/L | < 3 μg/L |
| Retirada proibida |
Classificação Suspensa Não classificadas |
≥ 2,00 (mg/kg) | ≥ 1,5 (mg/kg) | ≥ 0,5 (mg/kg) | ≥ 5 μg/kg | ≥ 30 μg/kg | ≥ 1 μg/L | ≥ 1 μg/L | < 3 μg/L |
Tabela 4. Critério para a definição de retirada de moluscos bivalves *Aplicáveis aos moluscos bivalves de água doce
A situação de retirada proibida pelo resultado de análises de ficotoxinas contaminantes, contaminantes inorgânicos, hidrocarbonetos policíclicos aromáticos e cianotoxinas acima dos limites estabelecidos pode retornar à situação de liberada ou liberada sob condição, após a obtenção de dois resultados consecutivos que comprovem a mudança de categoria, respeitando-se o intervalo mínimo de 72 (setenta e duas) horas entre as coletas e observando-se as respectivas espécies de referência.
Na situação de retirada proibida devido à presença de ficotoxinas contaminantes identificada exclusivamente nas espécies de moluscos bivalves consideradas sentinelas, as demais espécies podem ser retiradas, desde que os resultados decorrentes da realização diária de testes rápidos, executados previamente à retirada, estejam conformes.
¶ 4.8 Vídeos orientativos
¶ 4.8.1 Desconchamento de mexilhões /desconchamento_mexilhão.mp4
¶ 4.8.2 Desconchamento de ostras /desconchamento_ostras.mp4
¶ 4.8.3 Fluxo das amostras de ficotoxinas /vídeo_fluxo_amostras_biotoxinas.mp4
¶ 5. Base legal e documentos de referência
Decreto Nº 5.741/2006.
Decreto N° 9.013/2017.
Portaria N° SDA/MAPA 884/2023.
Instrução Normativa ANVISA N° 160/2022.
Portaria GM/MS N° 888/2021
¶ 6. Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ 7. Histórico de revisão
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 2.0 | Inclusão dos tópicos: Folha de rosto, Folha resumo, Disposições gerais e Histórico de revisão. | 08/10/2021 | Transcrição do manual para o modelo de manualização validado pela SDA no Projeto de elaboração do modelo de manualização da SDA. |
| 3.0 | Revisão de texto e inclusão do Anexo: Roteiro para Implementação do Programa Nacional de Controle Higiênico-Sanitário de Moluscos Bivalves em Áreas Primárias de Produção | 25/01/2022 | Revisão da transcrição pela área técnica responsável |
| 4.0 | Revisão de texto | 26/12/2023 | Adequação completa do Manual após a Publicação da Portaria SDA/MAPA 884/2023 |
| 4.1 | Inclusão de tópicos: Vídeos orientativos e anexo B. | 05/03/2024 | Inclusão de modelo de formulário de coleta e envio de amostras do Programa e de vídeos orientativos |
| 4.2 | Revisão dos procedimento de coleta, preparo e acondicionamento de amostras para HPAs e COI. | 25/06/2024 | Inclusão da orientação do uso de embalagem primária de papel alumínio nas amostras desconchadas para análise de HPAs e COI. |
| 5.0 | Inclusão de observações nos itens 4.4.3 e 4.5.3 (Coleta, preparo e acondicionamento) | 07/03/2025 | Sanar divergências nos procedimentos de coleta, preparo e acondicionamento |
¶ 8. Anexos
¶ ANEXO A - Roteiro para Implementação do Programa Nacional Moluscos Bivalves Seguros em Áreas Primárias de Produção
1) Para o início das atividades do MOLUBIS é fundamental o cadastro de todos os locais de cultivo de moluscos bivalves e áreas de extração. Para tanto, as seguintes atividades devem ser executadas:
- Cadastrar todas as malacoculturas;
- Cadastrar todas as áreas de extração de moluscos bivalves
- Obs: O cadastro deverá obedecer às instruções definidas no Manual do Programa Aquicultura com Sanidade - versão orientada ao Órgão Executor de Sanidade Agropecuária;
2) Delimitar e georreferenciar as áreas de vigilância do Programa.
3) Definir e georreferenciar os pontos de coleta (primários e secundários) em cada área de vigilância.
4) Providenciar equipamentos e meios necessários à coleta, preparo e envio das amostras tempestivamente e na frequencia estabelecida.
3) O OESA ficará responsável em enviar à Superintendência Federal de Agricultura (SFA/UF) o Manual Estadual do Programa. Após parecer favorável do responsável pelo MoluBiS na SFA/UF e do chefe do SISA na SFA/UF, o Manual deverá ser remetido à Divisão de Saúde Única (DSU-CSBP), que avaliará e encaminhará para validação do Departamento de Saúde Animal (DSA/SDA/MAPA).
O Manual Estadual do Programa deverá minimamente:
a) Demonstrar a distribuição espacial dos cultivos e áreas de extração de moluscos bivalves marinhos no estado; O cadastro georreferenciado é indispensável para o cumprimento desta etapa. Os órgãos de meio ambiente poderão ser consultados acerca da disponibilidade de dados de localização das áreas passíveis a atividade legal ou não de moluscos de extrativismo.
b) Demonstrar a distribuição espacial e identificar nominalmente as áreas de vigilância
c) apontar e justificar a escolha dos locais georreferenciados de coleta de amostras de moluscos e água; Os pontos de coleta para detecção de contaminantes microbiológicos e ficotoxinas não precisam, necessariamente, ser coincidentes e deverão ser baseados em fatores de risco (ex: locais de cultivo sujeitos à contaminação por atividades antrópicas tais como aqueles próximos a balneários turísticos, à região portuária, a emissários de esgoto doméstico e industrial; condições geográficas, oceanográficas, meteorológicas que predisponham a multiplicação de fitoplâncton e incorporação de toxinas pelos animais de aquicultura etc).
d) apontar e justificar a periodicidade da coletas, se for diferente da indicada no MoluBis (Portaria SDA/MAPA nº 884/2023);
e) Apontar claramente a(s) espécie(s) utilizadas na vigilância por espécies em cada área de vigilância, quando couber.
f) Descrever os níveis de alerta de ocorrência de mircoalgas nocivas na água e as ações realizadas em cada nível.
g) apresentar a estratégia operacional para cumprir a coleta e remessa de amostra de animais e água conforme proposto. Para isso, deverá ser descrito:
⇒ estimativa do número total de amostras anuais de:
- contaminantes microbiológicos em moluscos bivalves;
- microalgas nocivas produtoras de toxinas na água;
- ficotoxinas contaminantes em moluscos bivalves;
- contaminantes inorgânicos em moluscos bivalves; e
- hidrocarbonetos policíclicos aromáticos em moluscos bivalves;
⇒ detalhamento da logística da coleta (como e quem coletará as amostras);
⇒ como será custeada a remessa das amostras aos laboratórios;
- O OESA poderá contratar uma empresa especializada com embarcação para realizar as coletas, desde que haja um responsável apto a realizar a coleta oficial;
- O OESA poderá solicitar aditivo no convênio SUASA para custear a realização da coleta e remessa das amostras;
⇒ Qual a rede laboratorial utilizada em cada análise. Definir se serão laboratórios da Rede Nacional de Laboratórios Agropecuários - LFDA do MAPA, da Rede Brasileira de Laboratórios Analíticos em Saúde (REBLAS) da ANVISA/Ministério da Saúde ou credenciados por estas redes;
h) apontar como será feita a interdição das áreas de vigilância classificadas como “retirada suspensa”, de acordo com o estabelecido na legislação do MoluBiS;
i) descrever como será feito o alerta rápido de fechamento de áreas para conhecimento dos produtores, autoridades do serviço de inspeção oficial, autoridades do serviço estadual e federal de sanidade animal, autoridades da vigilância sanitária estadual e municipal e consumidores;
j) listar as estratégias de educação sanitária para assegurar conscientização e apoio dos produtores de bivalves na condução do MoluBiS assim como a comunicação de risco à sociedade sobre o consumo de bivalves sem inspeção. A estratégia de educação continuada deverá ser conduzida e realizada pelo OESA que poderá estabelecer parcerias com outros órgãos como a vigilância sanitária do estado/municípios entre outros.
k) Apontar como será garantida a publicidade dos pontos de coleta e resultados das análises laboratoriais na internet (Mapas, comunicados, etc.).
4) A DSU/CSBP/CGASV/DSA poderá endossar o dossiê ou solicitar ajustes.
5) Uma vez endossado pelo DSA, o documento será encaminhado: para a Coordenação Geral de Apoio Laboratorial (CGAL/SDA) com a previsão do número total de amostras anuais para comunicação aos laboratórios envolvidos e planejamento logístico da realização dos ensaios e análises; e para a Secretaria de Defesa Agropecuária (SDA/MAPA) para aprovação.
6) Após aprovação da SDA, o OESA poderá iniciar a execução do MoluBIS.
¶ ANEXO B - FORMULÁRIO DE COLETA E ENVIO DE AMOSTRAS DO PROGRAMA (baixe aqui: /formulário_molubis.docx)

