¶ Folha de rosto
©2021 Ministério da Agricultura, Pecuária e Abastecimento. Todos os direitos reservados. É permitida a reprodução parcial e ou total desta obra, desde que citada a fonte e que não seja para venda ou qualquer fim comercial. A responsabilidade pelos direitos autorais de textos e imagens desta obra é do autor.
Elaboração, distribuição, informações:
Ministério da Agricultura e Pecuária - MAPA
Secretaria de Defesa Agropecuária - SDA
Departamento de Inspeção de Produtos de Origem Animal - DIPOA
Coordenação Geral de Programas Especiais – CGPE/DIPOA
Coordenação de Caracterização de Risco – CRISC/CGPE/DIPOA
Esplanada dos Ministérios, Bloco D, 4º andar, sala 408
CEP: 70043-900, Brasília-DF
Tel.: (61) 3218-2506
www.agricultura.gov.br
E-mail: cgpe.dipoa@agro.gov.br
Organização:
Divisão de Aperfeiçoamento Técnico – DIAT/CGPE/DIPOA
Coordenação de Caracterização de Risco – CRISC/CGPE/DIPOA
Equipe de Elaboração:
Adriana de Cassia Neves, Alfredo Bianco Junior, Caroline Del Negri Sartoretto de Oliveira, Juliana do Amaral Moreira Conforti Vaz, Karine Bordignon, Leila Aparecida Mussi, Michel Tavares Quinteiro Milcent Assis, Pedro Henrique Salgado Bueno; Robério Alves Machado, Rodrigo Gasparoto Mabília
Colaboradores:
Adriana Aguiar Oliveira; Carla Susana Rodrigues, Claudia Valéria Gonçalves Cordeiro de Sá, Josinete Barros de Freitas, Mayara Souza Pinto, Paulo Humberto de Lima Araújo, Paulo Marcel Armendaris Rodriguez, Priscilla Bagnatori Rangel, Beatriz Vivancos Lago, Carolina Araújo Resende Xavier, Juliana Pires, Mitie Kawano, Cristina Mara Teixeira e Letícia Goulart Desordi.
¶ Folha resumo
|
Macroprocesso: 23 - Inspeção de produtos de origem animal e vegetal |
Objetivo: O objetivo do presente manual é orientar sobre os procedimentos para coleta de amostras de produtos de origem animal, detalhando o passo a passo para preenchimento de formulários importantes para a atividade de coleta. Neste sentido, o manual apresenta orientações gerais, sendo possível observar:
|
|||
|
Processo: 23.05 - Monitorar a qualidade e segurança de produtos de origem animal e vegetal |
||||
|
Entrega: Segurança e Qualidade dos Alimentos |
Público alvo e demais interessados: Público interno: destinado a Secretaria de Defesa Agropecuária. |
Versão do documento: 9.0 |
||
|
Setor responsável e responsabilidades A Coordenação Geral de Programas Especiais do Departamento de Inspeção de Produtos de Origem Animal é responsável pela elaboração, atualização e envio para aprovação deste manual, tendo responsabilidade quanto aos procedimentos descritos no documento. |
||||
¶ 1. Definições e conceitos
- Amostra oficial: Amostra coletada por serviço oficial do MAPA, por servidor público competente que esteja em exercício em um Serviço de Inspeção ou Unidade Técnica da estrutura do MAPA. Deve ser sempre acompanhada de documento oficial de requisição de análise;
- Amostra de prova: Amostra oficial que será utilizada para a realização de análise exploratória ou pericial;
- Amostra de contraprova: Amostra oficial que pode ser utilizada quando solicitada a análise pericial, no âmbito do direito à defesa do fiscalizado;
- Análise exploratória: Análise efetuada em amostra coletada pela autoridade fiscalizadora competente com objetivos distintos da tomada de ações fiscais, como levantamento de dados, mapeamento, observação de perfis e tendências na produção, apuração de denúncias ou suspeitas;
- Análise fiscal: Análise efetuada pela Rede Nacional de Laboratórios Agropecuários do Sistema Unificado de Atenção à Sanidade Agropecuária (SUASA) ou por autoridade laboratorial competente, desde que as amostras coletadas sejam realizadas por servidores competentes do MAPA;
- Análise pericial: Análise laboratorial realizada a partir da amostra oficial de contraprova, quando o resultado da amostra da análise fiscal for contestado por uma das partes envolvidas, para assegurar amplo direito de defesa do interessado, quando pertinente;
- Limite microbiológico: Limite estabelecido para um dado micro-organismo, suas toxinas ou metabólitos, utilizado para classificar unidades amostrais de um alimento em “Qualidade Aceitável”, “Qualidade Intermediária” ou “Qualidade Inaceitável”;
- Limite microbiológico m (m): Limite que, em um plano de três classes, separa unidades amostrais de “Qualidade Aceitável” daquelas de “Qualidade Intermediária” e que, em um plano de duas classes, separa unidades amostrais de “Qualidade Aceitável” daquelas de “Qualidade Inaceitável”;
- Limite microbiológico M (M): Limite que, em um plano de três classes, separa unidades amostrais de “Qualidade Intermediária” daquelas de “Qualidade Inaceitável”;
- Lote: Conjunto de produtos de um mesmo tipo, processados pelo mesmo fabricante ou fracionador, em um espaço de tempo determinado, sob condições essencialmente iguais;
- Plano de amostragem: Define o número de unidades amostrais a serem coletadas aleatoriamente de um mesmo lote e analisadas individualmente (n), o tamanho da unidade analítica e a indicação do número de unidades amostrais toleradas com qualidade intermediária;
- Plano de amostragem de duas classes: Tipo de plano que classifica a amostra analisada em apenas duas categorias, “Qualidade Aceitável” ou “Qualidade Inaceitável”, considerando se o resultado está acima ou abaixo do limite microbiológico estabelecido (m);
- Plano de amostragem de três classes: Tipo de plano que, com base em um limite microbiológico “m” e um limite microbiológico “M”, classifica a amostra analisada em três categorias, que são “Qualidade Aceitável”, “Qualidade Intermediária” ou “Qualidade Inaceitável”;
- Programas oficiais: Cronogramas de coletas de amostras para controle e monitoramento com fins fiscalizatórios ou exploratórios, os quais obedecem a delineamento amostral e procedimentos estabelecidos pelo DIPOA; e
- Unidade amostral: Porção ou unidades coletadas aleatoriamente de um lote, contendo a quantidade necessária para a realização dos ensaios.
¶ 1.1 ABREVIATURAS
CGI – Coordenação Geral de Inspeção
CGPE - Coordenação Geral de Programas Especiais
CMP – Caseínomacropeptídeo
CPP – Contagem Padrão em Placas
CRISC - Coordenação de Caracterização de Risco
DIPOA - Departamento de Inspeção de Produtos de Origem Animal
DSA – Departamento de Saúde Animal e Insumos Pecuários
EEB - Encefalopatia Espongiforme Bovina
EET – Encefalopatias Espongiformes Transmissíveis
FAO – Organização das Nações Unidas para a Alimentação e a Agricultura
GTA– Guia de Trânsito Animal
LFDA - Laboratório Federal de Defesa Agropecuária
MAPA - Ministério da Agricultura e Pecuária
MVO – Médico Veterinário Oficial
OIE – Organização Mundial da Saúde
OMC – Organização Mundial do Comércio
OMS – Organização Mundial da Saúde
PACPOA – Programa de Avaliação de Conformidade de Produtos de Origem Animal Comestíveis
PNCP – Programa Nacional de Controle de Patógenos
PNCRC – Plano Nacional de Controle de Resíduos e Contaminantes
PNEEB - Programa Nacional de Prevenção e Vigilância da Encefalopatia Espongiforme Bovina
PNQL – Plano Nacional de Melhoria da Qualidade do Leite
RAM – Resistência a Antimicrobianos
RBQL - Rede Brasileira de Qualidade do Leite
RIISPOA – Regulamento de Inspeção Industrial e Sanitária de Produtos de Origem Animal
RAL – Requisição de Análises Laboratoriais
RTIQ – Regulamentos Técnicos de Identidade e Qualidade
RUP – Relação Umidade: Proteína
SDA - Secretaria de Defesa Agropecuária
SFA– Superintendências Federais de Agricultura
SIF - Serviço de Inspeção Federal
SIPOA –Serviço de Inspeção de Produtos de Origem Animal
SISA– Serviço de Fiscalização de Insumos e Saúde Animal
SISRES– Sistema de Controle de Resíduos e Contaminantes
SLAV – Seção Laboratorial Avançada
SSA – Serviço de Saúde Animal
STEC – Escherichia coli produtora de Shiga toxina
SUASA - Sistema Unificado de Atenção à Sanidade Agropecuária
SVE – Serviço Estaduais de Defesa Sanitária Animal
SVO – Serviço Veterinário Oficial
TE - Tronco Encefálico
¶ 2. Responsabilidades
O presente manual possui vigência e prazo indeterminado e será revisado sempre que necessário, no mínimo anualmente, pela Coordenação Geral de Programas Especiais do Departamento de Inspeção de Produtos de Origem Animal (CGPE/DIPOA) e aprovada pela Secretaria de Defesa Agropecuária (SDA).
A gestão desse manual está sob a responsabilidade da CGPE/DIPOA, que prestará auxílio ao público-alvo leitor. Dúvidas e/ou sugestões quanto a aplicação deste manual deve ser submetidas ao Departamento responsável.
A publicação e atualização das versões na plataforma oficial da SDA para acesso pelo público-alvo será de responsabilidade da Secretaria representada pelo DIPOA.
¶ 3. Objetivo
O objetivo do presente manual é orientar sobre os procedimentos para coleta de amostras de produtos de origem animal, detalhando o passo a passo para preenchimento de formulários importantes para a atividade de coleta.
Neste sentido, o manual apresenta orientações gerais, sendo possível observar:
a. Requisitos gerais para coleta, acondicionamento e remessa de amostras de produtos de origem animal e água de abastecimento para análises físico-químicas e microbiológicas; e
b. Requisitos específicos de coleta, acondicionamento e remessa de amostras.
¶ 4. Procedimentos
¶ 4.1 REQUISITOS GERAIS PARA COLETA, ACONDICIONAMENTO E REMESSA DE AMOSTRAS DE PRODUTOS DE ORIGEM ANIMAL E ÁGUA DE ABASTECIMENTO PARA ANÁLISES FÍSICO-QUÍMICAS E MICROBIOLÓGICAS
¶ 4.1.1. Introdução
Os programas de controle oficial, previstos no art. 82 do Decreto nº 9.013, de 29 de março de 2017, tem como objetivo avaliar a inocuidade, a identidade, a qualidade e a integridade dos produtos e de seus processos produtivos e contemplam a coleta de amostras para análises físicas, microbiológicas, físico-químicas, de biologia molecular, histológicas e demais que se fizerem necessárias para a avaliação da conformidade.
O art. 477 do Decreto nº 9.013 de 2017 estabelece que os procedimentos de coleta, de acondicionamento e de remessa de amostras para análises fiscais serão estabelecidos pelo Ministério da Agricultura e Pecuária (MAPA).
O desempenho dos programas oficiais estabelecidos pelo DIPOA depende diretamente da observação de alguns aspectos durante as fases de coleta, acondicionamento e remessa das amostras de produtos de origem animal. É importante observar a programação estabelecida pelo DIPOA. Em seguida, para a escolha do produto a ser coletado, deve-se conferir a categoria de produto definida nos programas oficiais e quais são os produtos elegíveis para a coleta.
Os cronogramas de coletas oficiais devem ser de conhecimento apenas dos SERVIDORES, evitando comunicação a auxiliares (inclusive os administrativos cedidos conforme art. 73 do Decreto nº 9.013 de 2017) ou outros colaboradores do estabelecimento. Os cronogramas não devem ser anotados em quadros ou tabelas os quais tenham acesso de terceiros.
Outro aspecto importante que deve ser considerado, anteriormente à coleta propriamente dita, é a busca de informações para o preenchimento parcial prévio da documentação de requisição de análises laboratoriais, atualmente conhecida como Requisição de Análises Laboratoriais (RAL). Trata-se de um formulário oficial no qual são fornecidos os dados necessários ao processamento e análise de amostras nos laboratórios. Ressalta-se que a RAL possui uma parte destacável conhecida como cinta de identificação da amostra, na qual devem ser repetidas as informações dispostas no corpo do documento. A cinta de identificação acompanha a amostra e deve ser inserida no saco-lacre devidamente protegida, de forma a assegurar sua integridade e legibilidade durante todo o armazenamento e transporte da amostra.
É importante que sejam consultados os planos de amostragem definidos nos Regulamentos Técnicos de Identidade e Qualidade (RTIQ) dos produtos amostrados e nas tabelas do DIPOA, sempre se baseando na legislação específica sobre o tema.
As amostras fiscais a serem coletadas são definidas por levantamento estatístico realizado pelo DIPOA, sendo periodicamente comunicado aos serviços de inspeção, de acordo com o programa a ser executado.
Para escolha do produto a ser amostrado, deve-se escolher o lote de forma aleatória, exceto nas seguintes situações:
- Produtos com prazo de validade exíguo: deve-se coletar amostras de lotes com datas de fabricação mais recentes, de forma a viabilizar a realização de análise de contraprova, caso necessária; e
- Amostragem decorrente de investigações ou ações sobre lotes específicos: devem ser coletados apenas os lotes envolvidos.
Ao realizar a coleta, deve-se garantir que seja obtida a quantidade mínima de amostra indicada pelo laboratório contidas nos “MANUAL 1 Disposições Gerais sobre o Recebimento de Amostras” e “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal” ou em instruções específicas, de acordo com o tipo de produto ou metodologia de análise.
Em regra, é coletada uma única amostra de prova (indicativa ou representativa) para a realização de análises microbiológicas e são coletadas 3 (três) amostras (uma amostra de prova, uma amostra de contraprova SIF/Laboratório e uma amostra de contraprova empresa), para a realização de análises físico-químicas.
Amostras que compõem a triplicata devem ser do mesmo lote e podem, no caso de produtos fracionados, ser coletadas a partir da mesma unidade do produto (mesma peça, mesma embalagem etc.) desde que a quantidade de produto permita a obtenção do mínimo amostral.
Não caberá execução da análise de contraprova quando:
- A quantidade de produto for insuficiente para a obtenção das 3 (três) amostras;
- A natureza do produto não permitir realização de contraprova, a título de exemplo tem-se a amostra de leite cru para análise de composição centesimal; ou a amostra de produtos para pesquisa de analitos como nitritos ou nitratos, ou as amostras de produtos lácteos para quantificação de lactose;
- O prazo de validade do produto amostrado for exíguo, sem haver tempo hábil para a realização da análise de contraprova. Considera-se que o produto apresenta prazo de validade exíguo quando for igual ou inferior a 45 (quarenta e cinco dias), contados da data da coleta;
- Houver realização de análises fiscais decorrentes de procedimentos de inspeção rotineiros; e
- Houver realização de análises microbiológicas, pois não há garantia de repetibilidade dos resultados devido à distribuição heterogênea e possível multiplicação dos microorganismos no alimento, bem como inviabilização no intervalo entre as análises.
Ademais, deve-se priorizar a coleta da amostra em sua embalagem original, a não ser em situações em que o volume for excessivamente grande para o envio ao laboratório, ou quando houver instruções específicas de acordo com o tipo de produto e análise.
De acordo com os critérios de recebimento de amostras adotados pelos laboratórios da Rede Nacional de Laboratórios Agropecuários do SUASA, somente serão aceitas amostras que chegarem aos laboratórios nas seguintes condições:
a. Adequadamente lacradas e sem sinais de violação;
b. Em embalagens e recipientes adequados;
c. Em estado de conservação aceitável, sendo respeitado dentro do possível a temperatura de conservação estipulada no rótulo do produto, quando couber;
d. Dentro do prazo de validade do produto;
e. Em quantidade suficiente;
f. Acompanhadas de documentação adequada e devidamente preenchida;
g. Em conformidade com os critérios de recebimento de amostras estipulados pelos “MANUAL 1 Disposições Gerais sobre o Recebimento de Amostras” e “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal”; e
h. As Requisições de Análises Laboratoriais (RAL) devem ser preenchidas por meio do aplicativo MAPA LABs para os programas PNCP-Salmonela aves (IN20/2016), PNCP-Salmonela suínos (IN60/2018-suíno), PNCP-STEC/Salmonela bovinos (IN60/2018-bovino) e PNQL (IN76/2018), ou outros programas a serem informados pelo DIPOA, conforme orientações dispostas nos tutoriais disponíveis no site do MAPA https://www.gov.br/agricultura/pt-br/assuntos/defesa-agropecuaria/plataforma-sda/mapa-labs/coleta-de-amostras. Para estes programas, as amostras acompanhadas da RAL manual (documento físico preenchido manualmente) serão rejeitadas.
Alguns conceitos importantes sobre planos de amostragem devem ser abordados para maior entendimento:
- n = número de unidades amostrais analisadas individualmente provenientes de um mesmo lote;
- m e M = limites microbiológicos inferior e superior; e
- c = número de amostras aceitáveis entre os limites m e M.
Os planos de amostragem são classificados como planos de duas ou três classes, de acordo com os resultados. Nos planos de duas classes os resultados possíveis são apenas aceitáveis ou inaceitáveis, por ser estabelecido um único limite. Normalmente esses planos são referenciados com resultados de “presença” ou “ausência” e são aplicáveis a patógenos que causam doenças mesmo em contagens baixas ou para os quais existe um nível muito baixo de tolerância.
Nos planos de três classes os resultados possíveis são “aceitável”, “marginal” e “inaceitável”, devido a existência de dois padrões de limites: m (limite inferior) e M (limite superior). O resultado “marginal” encontra-se entre esses limites. Esse plano é utilizado para a avalição de patógenos que não causam doença quando presentes em níveis baixos (valores abaixo de m) ou onde haja um limite superior (M) claro que não deva ser ultrapassado.
Normalmente, quando o número de amostras aceitáveis (c) é igual a zero, o plano é caracterizado como de duas classes e quando maior ou igual a um, o plano é caracterizado como de três classes.
Também existem diferentes tipos de amostragem: representativa e indicativa. A amostra representativa deve ser utilizada pelos estabelecimentos produtores de alimentos com tantas unidades amostrais (n) quantas forem necessárias para garantir a representatividade do lote, as quais usualmente ficam compreendidas entre 5 (cinco) e 10 (dez) unidades, podendo ser diferentes dependendo o tamanho do lote.
As amostras indicativas são constituídas por um número de unidades amostrais (n) inferior ao estabelecido no plano de amostragem representativo, conforme a finalidade de coleta. Usualmente é utilizada apenas uma amostra, mantendo-se os limites (m e M) assim como o critério de aceitabilidade (c).
Importante também é diferenciar amostras indicativas e representativas de amostras de prova e contraprova. Quando se coletam amostras para análises microbiológicas, elas podem ser tanto indicativas (n=1), quanto representativas (n=5, n=10, outras amostragens) e se constituirão em apenas amostras de prova, pois nesses casos não há contraprova. Já quando se coletam amostras para análises físico-químicas, elas também podem ser tanto indicativas (n=1), quanto representativas (n=5, n=10, outras amostragens), mas haverá amostras de prova, contraprova empresa e contraprova SIF/Laboratório, compondo a triplicata. A exemplo quando a amostra for indicativa (n=1), serão realizadas 3 (três) coletas e no caso da amostra representativa, utilizando-se como exemplo n=5, serão realizadas 15 (quinze) coletas, sendo 5 (cinco) para a amostra de prova, 5 (cinco) para a amostra de contraprova SIF/Laboratório e 5 (cinco) para a amostra de contraprova empresa. É importante ressaltar que todas as amostras deverão ser obtidas de um mesmo lote.
Assim, com a finalidade de melhorar o aproveitamento das amostras encaminhadas aos laboratórios, apresentaremos a seguir os procedimentos gerais de coleta de amostras. Abordaremos os materiais necessários às coletas, a escolha e o número de amostras a serem coletadas, os métodos de coleta e acondicionamento de amostras e o tratamento das amostras de contraprova.
¶ 4.1.2. Coleta e acondicionamento de produtos em embalagens originais
Antes da coleta propriamente dita, você deverá certificar-se da disponibilidade dos materiais necessários nas etapas de coleta, acondicionamento e remessa das amostras que serão coletadas em atendimento aos programas oficiais e ou demandas extraordinárias.
Para coleta de amostras devem ser preparados os seguintes materiais:
a. Materiais necessários:
- Mesa ou bancada;
- Termômetro calibrado (quando aplicável);
- Balança;
- Embalagens íntegras e limpas (verificar a necessidade de solicitar as embalagens ao laboratório);
- Sacos-lacre. Esse tipo de invólucro reúne as características necessárias à identificação e inviolabilidade das amostras, por isso deve ser prioritariamente utilizado. Caso não haja disponibilidade de saco-lacre, excepcionalmente, como medida de contingência, será permitida a sua substituição por saco plástico transparente com aposição de lacre plástico. Neste caso, o lacre a ser utilizado deverá possuir codificação unívoca e indelével, sem identificação do SIF ou empresa;
- Envoltório plástico para a proteção da cinta de identificação da amostra;
- Material refrigerante (para amostras refrigeradas ou congeladas);
- Caixas para o transporte das amostras;
- Envelope para a proteção do documento de RAL; e
- Cola, tesoura e fita adesiva.

Figura 01: Materiais necessários.
b. Número de amostras e quantidade mínima
Os planos de amostragem para definição do número de amostras a serem coletadas dependerão se a amostragem será realizada de forma indicativa ou de forma representativa.
Quando a quantidade de produto a ser coletado não estiver expressamente definida, deve ser coletada uma amostra de no mínimo 200g, 200mL ou conforme o “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal”. Caso a embalagem do produto tenha peso ou volume inferior ao requerido, devem ser coletadas quantas embalagens forem necessárias para a obtenção da quantidade mínima. Nessa situação, as embalagens devem pertencer ao mesmo lote. Para produtos que são apresentados em peso ou volume superior, por exemplo, pescado em embalagem de 400g, recomendamos que o produto seja coletado como se apresenta, preservando a integridade da embalagem original. Deve ser priorizada a coleta dos produtos em sua embalagem original, a não ser em casos em que o volume for excessivamente grande para o envio ao laboratório.
Na hipótese de produtos de alto valor agregado, como queijos finos, geleia real, cera de abelhas, entre outros, a quantidade de amostra pode ser inferior, desde que previamente acordada com o laboratório.
c. Procedimentos de coleta e acondicionamento
i. Escolher aleatoriamente o lote a ser amostrado (respeitadas as exceções acima mencionadas);
ii. Mensurar temperatura (quando aplicável);
iii. Inserir as amostras em embalagem original no saco-lacre até completar o peso mínimo amostral;
iv. Inserir no saco-lacre a cinta de identificação da amostra, devidamente protegida; e
v. Lacrar o saco.
Quando a amostra se destinar à realização de análises físico-químicas, o procedimento de coleta deve ser repetido 3 (três) vezes, obtendo-se a triplicata. Já para as análises microbiológicas é realizada apenas a coleta da amostra de prova.
¶ 4.1.3 Fracionamento de produtos para obtenção de amostras
O fracionamento de um produto para obtenção de amostras pode ser necessário quando a embalagem primária possuir dimensões que inviabilizem a sua remessa aos laboratórios, ou em produtos com embalagens destinadas à comercialização a granel. É importante que o procedimento seja realizado em condições que permitam a manutenção das características originais do produto e que a nova embalagem garanta as mesmas condições de segurança da embalagem original. Por isso, o SIF deve verificar se existem instalações, utensílios e embalagens em boas condições higiênicas e condizentes com a realização do procedimento de fracionamento, sempre considerando as características de cada produto. O ambiente deve ser limpo, livre de poeira e de correntes de ar. Caso as condições não sejam satisfatórias, o produto deve ser coletado em sua embalagem original.
O fracionamento deve ser realizado, preferencialmente, pelo detentor do produto ou por seu representante, sempre sob supervisão do SIF. Se o servidor do SIF realizar o fracionamento, também deve haver acompanhamento do detentor do produto ou de seu representante. Sempre que possível, o rótulo da embalagem original, ou cópia deste, deve ser encaminhado ao laboratório conjuntamente à amostra.
A depender da análise solicitada para o produto, diferentes materiais de coleta serão necessários, conforme demonstram os procedimentos a seguir:
¶ 4.1.3.1 Coleta de amostras fracionadas para análises físico-químicas
Materiais necessários:
- Mesa ou bancada;
- Termômetro calibrado (se aplicável);
- Balança;
- Embalagens limpas e íntegras, adequadas ao produto que será fracionado;
- Sacos-lacre;
Caso não haja disponibilidade de saco-lacre, excepcionalmente, como medida de contingência, será permitida a sua substituição por saco plástico transparente com aposição de lacre plástico.
- Álcool 70%;
- Facas, tesouras, conchas e ou outros utensílios limpos necessários para fracionamento ou homogeneização de amostras, conforme a natureza do produto;
- Envoltório plástico para a proteção da cinta de identificação da amostra;
- Material refrigerante (para amostras refrigeradas ou congeladas);
- Caixas para o transporte das amostras;
- Envelope para a proteção do documento de RAL; e
- Cola e fita adesiva.
¶ 4.1.3.2 Coleta de amostras para análises microbiológicas:
Materiais necessários:
- Mesa ou bancada;
- Termômetro calibrado (se aplicável);
- Balança;
- Embalagens limpas, íntegras, de primeiro uso ou estéreis;
- Sacos-lacre;
Caso não haja disponibilidade de saco-lacre, excepcionalmente, como medida de contingência, será permitida a sua substituição por saco plástico transparente com aposição de lacre plástico.
- Álcool 70%;
- Luvas estéreis ou, na indisponibilidade, luvas de procedimento sanitizadas com álcool 70%;
- Facas, tesouras, bisturis, conchas e ou outros utensílios adequados à natureza do produto e necessários para a abertura das embalagens e para a homogeneização ou fracionamento do produto. Esses materiais deverão estar estéreis, sanitizados ou flambados previamente ao uso;
- Material refrigerante (para amostras refrigeradas ou congeladas);
- Caixas para o transporte das amostras;
- Envoltório plástico para a proteção da cinta de identificação da amostra;
- Envelope para a proteção do documento de RAL; e
- Cola e fita adesiva.
¶ 4.1.3.3 Número de amostras e quantidade mínima
Amostras devem ser coletadas em triplicata, respeitadas as exceções normativas. Para determinar a quantidade de amostra, consulte as tabelas de quantidade mínima de amostra a ser obtida conforme o “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal”. Não havendo indicação específica, a quantidade mínima de amostra será de 500 g ou 500 mL para análises físico-químicas e 200g ou 200mL para análises microbiológicas, salvo exceções previamente acordadas com o laboratório.
¶ 4.1.3.4 Procedimentos de coleta e acondicionamento
a. Escolher aleatoriamente o lote a ser amostrado (respeitadas as exceções já mencionadas) e selecionar uma embalagem (peça, caixa, balde etc.) do produto;
b. Higienizar e sanitizar a mesa ou bancada a ser utilizada para o fracionamento do produto, utilizando o álcool 70%. Da mesma forma, a embalagem primária do produto a ser amostrado também deve ser higienizada com o álcool 70% antes de ser aberta;
c. Higienizar as mãos com água e sabonete. Posteriormente, enxaguar e secar com toalha descartável;
d. Calçar as luvas estéreis. Na ausência destas higienizar as mãos com água a sabão e, posteriormente, realizar a sanitização das mãos com álcool 70% ou produto equivalente, garantindo que se encontrem completamente secas previamente ao início do procedimento;
e. Abrir a embalagem utilizando o utensílio estéril ou previamente sanitizado ou flambado;
f. Retirar porções de diversos pontos do produto com auxílio de utensílios esterilizados, sanitizados ou flambados, adequados ao tipo de produto (colher, concha, faca etc.). Verificar a necessidade de homogeneização do produto previamente à obtenção da porção;
g. Transferir a amostra para embalagens adequadas (sacos ou frascos limpos, íntegros, de primeiro uso ou estéreis) até obter a quantidade requerida;
h. Pesar a amostra para verificação do peso, garantindo a obtenção da quantidade mínima determinada para o tipo de produto;
i. Fechar cuidadosamente a embalagem ou frasco imediatamente após a coleta;
j. Inserir a embalagem com a amostra em saco-lacre;
k. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
l. Lacrar o saco.
Quando realizadas coletas com amostragem representativa para análises microbiológicas, cada unidade amostral deve ser acondicionada individualmente. A RALdeve ser preenchida e emitida separadamente para cada unidade. No caso de uma amostra representativa composta por cinco unidades amostrais (n=5), deve-se elaborar cinco RALs (em duas vias) e cinco cintas de identificação.
¶ 4.1.4 Preenchimento do documento oficial de requisição de análise
Após a realização da coleta, deve ser completado ou preenchido o documento oficial de requisição de análise (RAL).
O modelo do documento oficial de requisição de análise e as instruções para o seu preenchimento encontram-se descritas no “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal” O arquivo editável desse documento está acessível no ANEXO XI deste Manual.
Lembramos que a RAL possui uma parte destacável, a cinta de identificação da amostra, que deve ser preenchida com as mesmas informações já indicadas no corpo da RAL. É necessário a proteção de cada cinta individualmente em uma embalagem plástica transparente ou por meio da “plastificação” com fita adesiva transparente. Essa proteção visa evitar que a cinta sofra qualquer tipo de dano causado por umidade ou atrito durante o transporte da amostra. É importante ressaltar que a amostra somente será aceita no laboratório se a cinta estiver íntegra e visível.
Seguem abaixo orientações sobre como realizar os preenchimentos dos campos da RAL:
- Campo 1 – Assinalar a qual tipo de análise destina-se a amostra: se é uma amostra destinada à análise físico-química, análise microbiológica ou uma amostra direcionada à Rede Brasileira de Qualidade do Leite (RBQL);
- Campo 2 – Informar a Unidade do MAPA responsável pela coleta da amostra (SIF, SIPOA, Unidade do VIGIAGRO etc.);
- Campo 3 – Informar a identificação da solicitação. O preenchimento desse campo usualmente é padronizado pelo SIPOA junto aos SIFs. Com o intuito de evitar conflito de dados nos sistemas informatizados dos laboratórios, no “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal” é sugerida a utilização do seguinte modelo: SIF ou SERVIÇO/UF/Nº SEQUENCIAL/ANO;
- Campo 4 – Informar o número do SIF, ER ou EE do estabelecimento produtor da amostra. Estabelecimentos estrangeiros habilitados a exportar para o Brasil podem ser identificados por seu número de registro;
- Campo 5 – Informar, se aplicável, a qual programa do DIPOA pertence a amostra.
- Como exemplos temos o Programa de Avaliação de conformidade de Produtos de Origem Animal (PACPOA), o Programa Nacional de Controle de Patógenos (PNCP) (que inclui a IN 20/2016, a IN 60/2018 e a IN 09/2009), o Plano Nacional de Controle de Resíduos e Contaminantes (PNCRC), o Plano Nacional de Melhoria da Qualidade do Leite (PNQL), dentre outros programas que possam ser instituídos. Quando se tratar de amostra decorrente de ações de fiscalização ou procedimentos de reinspeção, este campo não precisa ser preenchido. Entretanto, quando se tratar de outras ações determinadas pelo DIPOA, como operações especiais, este campo deve ser preenchido conforme as instruções específicas do Departamento;
- Campos 6 e 7 – Informar a categoria e nome do produto de acordo com a classificação fornecida pelo DIPOA. Essas informações podem ser acessadas na página web do DIPOA;
- Campos 8, 9 e 10 – Informar o nome comercial do produto, conforme denominação constante no rótulo, o nº de registro (se aplicável) e marca (se aplicável);
- Campos 11, 12 e 13 – Informar o CNPJ (se aplicável), nome e endereço do estabelecimento fabricante.
Atenção: Não utilize esses campos para informações sobre o detentor do produto. Quando pertinente, estas devem ser fornecidas no campo de Observações.
- Campos 14, 15 e 16 – Informar a data de fabricação, validade e nº do lote da amostra;
- Campo 17 – Informar o tamanho do lote amostrado;
- Campo 18 – Informar a data e hora da coleta da amostra;
- Campos 19, 20 e 21 – Informar os números dos lacres utilizados para cada uma das amostras (amostra prova, contraprova SIF/Laboratório e contraprova empresa) nos casos em que a colheita em triplicata seja realizada. Da mesma forma, quando houver amostras de contraprova, estas devem ser registradas na mesma RAL da amostra de prova. Ao preencher esses campos, é importante que contenha o número completo do lacre, com todos os dígitos, incluindo os zeros;
- Campo 22 – Quando aplicáveis, informar os dados relativos aos programas de controle de patógenos, como a Instrução Normativa MAPA nº 20, de 21 de outubro de 2016 (Salmonela spp. em aves) e a Instrução Normativa MAPA nº 60, de 20 de dezembro de 2018 (Salmonella spp. em bovinos e suínos e E. coli STEC em bovinos). Nesses casos, é importante preencher o campo 22 de forma mais completa, com o ano, número do ciclo, número da amostra no ciclo, hora do início do turno da coleta, número do turno e linha de abate da amostra coletada, bem como o volume de abate no dia;
- Campo 23 – Informar a temperatura e estado de conservação da amostra na coleta;
- Campo 24 – Informar a data de remessa da amostra ao laboratório;
- Campo 25 – Informar quais são as análises solicitadas, com respectivos códigos de ensaios, para o produto amostrado;
Atenção: As análises solicitadas dependem dos programas oficiais estabelecidos pelo DIPOA. Recomenda-se a consulta da lista de Parâmetros Físico-Químicos e Microbiológicos para Produtos de Origem Animal Comestíveis divulgadas pelo DIPOA disponíveis na página web do DIPOA.
- Campo 26 – Este campo destina-se à inserção de informações adicionais a serem repassadas ao laboratório, como: justificativa(s) para pedido de urgência nas análises, ou para o acréscimo de análises a serem realizadas, comunicação de situações de apreensão ou deflagração de operações especiais etc.;
- Campo 27 – Assinatura e identificação do responsável pela coleta. A identificação pode ser feita por meio de carimbo ou texto impresso previamente na RAL;
- Campo 28 – Assinatura e identificação do responsável pelo estabelecimento. Este campo pode estar em branco caso a coleta seja realizada no varejo ou em caso de RAL em substituição a uma anterior por solicitação do laboratório;
- Campo 29 – Informar o e-mail para contato. É obrigatório o registro de pelo menos 1 (um) e-mail com domínio “@agro.gov.br”, podendo ser o do SIPOA, do responsável pela coleta ou da equipe integrante do SIF que fiscaliza o estabelecimento da amostra coletada;
- Campos 30, 31, 32, 33 e 34 – Preenchidos pelo laboratório no recebimento da amostra. Ao final do preenchimento da RAL, encontra-se a cinta de identificação da amostra, que deve ser preenchida com as mesmas informações já fornecidas nos campos da RAL;
- Campo 35 – Deve ser replicado o número da RAL que foi informado no campo 3. É imprescindível que seja feita essa vinculação;
- Campo 36 – Devem ser replicadas as informações já apostas nos campos 6, 7 e 8, referentes à categoria do produto, nome padronizado e nome comercial. Essas informações podem ser separadas por barras;
- Campo 37 – Informar o número do SIF (replicando a informação do campo 4);
- Campo 38 – Informar o número do lacre da amostra. Cada cinta deve conter apenas um número de lacre. Destaca-se que uma cinta corresponde à amostra de prova (devendo ser replicado o número do lacre informado no campo 19 da RAL), e quando aplicável, outra cinta corresponderá à amostra de contraprova SIF/Laboratório (com o número do lacre informado no campo 20) e a terceira cinta corresponderá à amostra de contraprova/empresa (com o número do lacre informado no campo 21 da RAL). Quando não houver coleta de amostra em triplicata, mantenha apenas a cinta da amostra de prova, descartando as demais.
- Campo 39 – Informar códigos de análises requeridas, repetindo as informações colocadas no campo 25;
- Campo 40 – Fornecer identificação e assinatura do servidor a serviço do SIF. A identificação poderá ser realizada por carimbo ou por digitação dos dados. Vale ressaltar que a cinta de identificação destacável deve ser encaminhada ao laboratório junto à amostra, dentro do saco-lacre, devidamente protegida e de forma que suas informações fiquem visíveis, preferencialmente não encobrindo o rótulo do produto, quando houver.
Após preparo da cinta de identificação, insira-a no saco-lacre junto à embalagem primária da amostra. A cinta deve ser posicionada de forma a manter legíveis tanto as suas informações, quanto as informações do rótulo do produto, quando houver.

Figura 02: Amostra e cinta de identificação em saco-lacre.
Além das indicações citadas, destacamos os seguintes pontos:
a. Todas as informações deverão estar legíveis, incluindo o carimbo (ou identificação) do responsável pela coleta;
b. É imprescindível que haja compatibilidade nas informações dos campos "número do lacre", "número do SIF", "número do lote do produto", "número da requisição de análise", "data e hora da coleta", "nome do produto";
c. Deve ser informado, além da denominação de venda do produto amostrado, o seu nome padronizado e respectiva categoria conforme normas do DIPOA (Norma Interna n° 06/DIPOA, de 10 de dezembro de 2014, alterada pela Norma Interna n° 02/DIPOA, de 28 de janeiro de 2016, e Resolução DIPOA nº 1, de 9 de janeiro de 2003);
d. Os números dos lacres devem ser transpostos para o documento oficial de requisição de análise tais como constam nos lacres (incluindo todos os zeros e demais características na numeração); e
e. O campo "observações" deve ter as seguintes informações:
i. Correio eletrônico do responsável pela coleta;
ii. Nome do programa oficial ao qual a amostra pertence ou justificativa para a solicitação das análises de amostras não pertencentes a nenhum programa; e
iii. Justificativa para a requisição de análise de parâmetros que não estejam previstos nas tabelas de parâmetros publicadas pelo DIPOA em sua página eletrônica:
- O documento oficial de requisição de análise deverá ser assinado pelo responsável pela coleta e também pelo responsável pelo estabelecimento; e
- Uma via do documento oficial de requisição de análise deve ser enviada na lateral externa da caixa de transporte.
¶ 4.1.5 Aplicação do lacre
A aplicação do lacre é fundamental para a garantia da inviolabilidade da amostra e deve ser executada com critério, mesmo aparentando ser um procedimento simples. Os sacos-lacre fornecidos pelo MAPA possuem alto nível de segurança e sistema indicativo de violação, devendo sempre ser utilizados.
A coleta e o acondicionamento das amostras nos sacos lacres oficiais devem ser exclusivamente realizadas por servidores em exercício nos SIFs e com atribuições para tal execução. Em caso de necessidade de acompanhamento, que se limite a atividades não relacionadas diretamente ao procedimento de coleta.

Figura 03: Saco-lacre oficial.
Para o correto procedimento de lacração utilizando os sacos-lacre, as etapas abaixo descritas devem ser seguidas:
a. Com a amostra e a cinta já inseridos no saco-lacre (e, se necessário, o rótulo do produto), deve-se proceder o fechamento do saco, garantindo que todas as pequenas aberturas (furos) da boca do saco estejam devidamente colocadas nas respectivas presilhas; e
b. Feche todas as presilhas e verifique o travamento. Apenas em caráter excepcional, mediante indisponibilidade momentânea de sacos-lacre, pode ser admitida a utilização de sacos plásticos transparentes e lacres plásticos. Não deverão ser utilizados lacres metálicos, em especial em amostras para teste de contaminantes inorgânicos.

Figura 04: Sacos e lacres.
Nessas situações, o procedimento de aplicação de lacre deve ser realizado com cuidado redobrado, a fim de manter a inviolabilidade da amostra.
Por isso é importante que seja adotado o procedimento descrito a seguir:
I. Antes de utilizar o saco plástico transparente, sugere-se realizar dobraduras no mesmo para aprimorar a segurança e facilitar a aposição do lacre. Faça diversas dobras no sentido do comprimento do saco (Figura 5) e faça duas dobras na extremidade do saco onde fica a sua abertura (Figura 6);
II. Realize uma ou duas perfurações por onde o lacre passará (Figura 7). Faça com que os furos fiquem próximos à extremidade lateral do saco e que o distanciamento entre eles inviabilize a remoção da amostra;
III. Coloque a amostra e a cinta (e eventualmente o rótulo do produto) dentro do saco plástico transparente, e feche a sua abertura com uma dobra, fazendo coincidir os furos realizados (Figura 8);
IV. Posteriormente, transpasse o lacre nos furos realizados e feche bem o saco (Figura 9); e
V. Dê algumas voltas com o lacre em torno da embalagem (Figura 10) o mesmo e feche, certificando-se que ficou devidamente preso.
Adicionalmente, verifique se as dobraduras na extremidade do saco ficam completamente vedadas, conferindo maior segurança à amostra (Figura 11).

Figura 05: Dobras longitudinais no saco plástico.

Figura 06: Dobras transversais no saco plástico

Figura 07: Perfurações no saco plástico.

Figura 08: Fechamento da extremidade do saco plástico.

Figura 09:Transpasse do lacre.

Figura 10: Fechamento do lacre.

Figura 11: Verificação da embalagem lacrada.
¶ 4.1.6 Remessa de amostras aos laboratórios
A última etapa do processo de coleta de amostras é o preparo da caixa para remessa ao laboratório.
A amostra já lacrada deve ser colocada na caixa de transporte, utilizando-se, se necessário, um sistema de calços para impedir que a amostra se movimente na caixa durante o transporte e sofra eventuais danos. Para produtos muito frágeis, sujeitos à quebra, recomenda-se proteger bem a amostra.
Para amostras mantidas em temperaturas de resfriamento ou congelamento devem ser utilizadas caixas isotérmicas e materiais refrigerantes em quantidade proporcional ao volume da amostra, garantindo a sua conservação conforme as recomendações do fabricante indicadas no rótulo do produto ou de atos legais com especificação de temperaturas. Ressalta-se que a amostra não deve ficar em contato direto com o material refrigerante, nem em contato com a água do degelo.

Figura 12: Amostra em meio refrigerante.
Atenção: O meio refrigerante deve ser suficiente para manter a temperatura da amostra. Sugere-se que tanto as amostras quanto o meio refrigerante possam ser resfriadas ou congeladas conjuntamente, sem deixar espaços vazios entre amostra e meio refrigerante.
É importante que este não seja utilizado em excesso nas amostras refrigeradas, a fim de que não provoque o congelamento da amostra durante o transporte.
Amostras de produtos resfriados devem ser acondicionadas de forma a permitir a manutenção da temperatura de conservação indicada no rótulo do produto. Caso a amostra não esteja acompanhada da rotulagem, serão admitidos no laboratório produtos que apresentem temperatura entre 2 a 8º C.
Para amostras que devem chegar congeladas ao laboratório, é preferível a utilização de gelo seco. No entanto, na ausência deste, deve ser utilizado gelo reciclável, composto por material cujo ponto de congelamento seja abaixo de 0º C, preferencialmente de -18ºC.
As amostras congeladas devem ser acondicionadas separadamente das amostras refrigeradas, uma vez que requerem condições diferenciadas de conservação.
Oportuno se torna destacar que há situações em que a amostra requer congelamento prévio ao envio ao laboratório. Nessas situações, a amostra já lacrada deve ser congelada junto ao meio refrigerante, antes de ser acondicionada para envio ao laboratório, caso seja mantida em túnel de congelamento. Em demais casos, sugere-se que a caixa isotérmica com os meios refrigerantes e a amostra sejam mantidos em ambiente na mesma temperatura, com o fechamento e lacração da caixa somente no momento de entrega da amostra para transporte.
A caixa deve ser fechada e vedada com fita adesiva. Uma via da RAL deve ser inserida em um envelope contendo uma etiqueta de identificação do laboratório de destino. Este envelope deve ser afixado na caixa transportadora, preferentemente na lateral, objetivando a prevenção de perda do mesmo por empilhamento durante o transporte. O envelope deve ser posicionado abaixo da linha de abertura da caixa, a fim de que a documentação nele contida não seja danificada quando a caixa for aberta. Para melhor fixação, deve ser utilizada fita adesiva em todas as arestas do envelope. A outra via original da RAL deve ser arquivada pelo SIF.

Figura 13: Envelope com RAL fixado na lateral da caixa transportadora com etiqueta indicativa da temperatura de conservação da amostra.
Na caixa também deverá ser afixada etiqueta contendo os dados do remetente, incluindo o nome e contato do responsável pela coleta, conforme o modelo:
Para amostras que requeiram temperaturas especiais de conservação, também deve ser afixada, no envelope ou na caixa, uma etiqueta indicativa da condição de conservação da amostra, conforme o modelo:
Nessa etiqueta deve constar a identificação do produto e a data e horário da coleta (Figura 13).
Atenção: A identificação é do produto, não da empresa!
Amostras destinadas à realização de análises físico-químicas devem ser acondicionadas separadamente das amostras destinadas à realização de análises microbiológicas, assim como a documentação que acompanha essas amostras deve ser preenchida e emitida separadamente.
É importante que as duas amostras da contraprova, quando coletadas, tenham destinação correta: uma dessas amostras deve ficar sob responsabilidade do fabricante ou detentor do produto. Essa amostra de contraprova somente deve ser encaminhada ao laboratório caso haja requisição de análise pericial. A outra amostra de contraprova pode ou não ser encaminhada ao laboratório, de acordo com os seguintes critérios:
Se o laboratório de destino for um laboratório credenciado, a amostra de contraprova deve permanecer sob custódia do SIF, em condições adequadas de conservação.
Se o laboratório de destino for um dos LFDA, a amostra de contraprova deve ser encaminhada juntamente com a amostra de prova, na mesma caixa de transporte. A RAL que acompanha as amostras de contraprova deve ser uma cópia do documento original gerado para a amostra de prova. Não deve ser emitido outro documento!
¶ 4.2 REQUISITOS ESPECÍFICOS DE COLETA, ACONDICIONAMENTO E REMESSA DE AMOSTRAS
¶ 4.2.1 Requisitos específicos de coleta, acondicionamento e remessa de amostras realizadas em estabelecimentos sob SIF com inspeção permanente
¶ 4.2.1.1 Amostragem em estabelecimentos de abate de aves
¶ 4.2.1.1.1 Coleta de amostras para análise de Dripping test
A Portaria MAPA n° 210, de 10 de novembro de 1998, estabelece o controle do índice de absorção de água pelas carcaças de aves submetidas ao pré-resfriamento por imersão em água. Entende-se por índice de absorção o percentual de água adquirido pelas carcaças de aves durante o processo de matança e demais operações tecnológicas, principalmente no sistema de pré-resfriamento por imersão, uma vez que um pequeno percentual de água absorvida ocorre durante a escaldagem, depenagem e as lavagens de carcaças na linha de evisceração.
O sistema de controle da absorção de água em carcaças de aves submetidas ao pré-resfriamento por imersão deve ser eficiente e efetivo, sem margem a qualquer prejuízo na qualidade do produto final. Dessa forma, a análise dripping test (teste de gotejamento) é o método oficial utilizado para determinar a quantidade de água resultante do descongelamento de carcaças de aves congeladas. Se a quantidade de água resultante, expressa em percentagem do peso da carcaça, com todos os miúdos e partes comestíveis na embalagem, ultrapassar o valor limite de 6%, considera-se que as carcaças absorveram um excesso de água durante o pré-resfriamento por imersão em água.
a. Materiais necessários
- Luvas de procedimento;
- Embalagens plásticas transparentes sem inscrições;
- Termômetro calibrado;
- Saco-lacre;
- Caixa isotérmica e material refrigerante;
- Martelinho e furador;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra; e
- Tesoura, cola e fita adesiva.
b. Número de amostras e quantidade mínima
As amostras devem ser coletadas em triplicata. Cada uma das três amostras deve ser composta por seis (6) carcaças congeladas de aves. Uma amostra, composta por seis (6) carcaças, deve ser encaminhada ao LFDA para análise, e as demais devem ser armazenadas como contraprova. Uma amostra de contraprova deve ser entregue ao detentor ou ao responsável pelo produto e a outra amostra de contraprova deve ser enviada juntamente com a amostra de prova, sendo, portanto, mantida em poder do laboratório conforme § 1° do art. 470 do Decreto nº 9.013 de 2017.
A escolha das amostras deve ser realizada ao acaso. Atente-se que as amostras devem pertencer ao mesmo lote, podendo, inclusive, ser coletadas na mesma unidade do produto, como por exemplo, na mesma caixa ou pallet.
c. Procedimentos de coleta e acondicionamento
i. Selecionar as amostras ao acaso;
ii. Coletar 3 (três) amostras (prova, contraprova SIF/Laboratório e contraprova da empresa) do produto obedecendo a quantidade mínima de 6 (seis) carcaças por amostra. As amostras devem ser coletadas em sua embalagem primária original, após o congelamento ou em câmaras de estocagem;
iii. Aferir a temperatura de um dos produtos a ser coletado, sendo que esta temperatura deve ser registrada, posteriormente, na RAL. A temperatura das amostras deve ser igual ou inferior a -12°C, sendo mantida assim até o momento da análise;
iv. Em seguida, as seis unidades que compõem cada uma das amostras devem ser acondicionadas em um mesmo saco-lacre;
v. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida;
vi. Lacrar o saco.
Atenção: Caso as 6 (seis) amostras não caibam no mesmo saco-lacre, devem ser utilizados sacos adicionais. Nessa hipótese, cada saco-lacre deve conter, além da amostra, uma cópia da cinta de identificação. Se utilizados sacos plásticos em substituição ao saco-lacre, cada saco deve receber um lacre individual. Na RAL e na cinta devem ser informados os números dos lacres correspondentes de cada amostra.
Os sacos lacrados contendo as amostras e as cintas identificadoras devem ser congelados junto ao meio refrigerante. Em seguida, acondicionados em uma caixa isotérmica adequada, com material refrigerante suficiente.
¶ 4.2.1.1.2 Coleta de amostras para análise do teor total de água
O controle oficial do teor total de água contida em frango resfriado é realizado com base nos parâmetros para avaliação de umidade (%), proteína (%) e a relação umidade/proteína nos produtos, conforme a Portaria MAPA nº 557, de 30 de marco de 2022. Foram estabelecidos parâmetros para carcaças de frango refrigeradas ou congeladas e para cortes, resfriados ou congelados, a saber: coxa, com pele e osso; coxa com sobrecoxa, com pele e osso; peito, com pele e osso; peito, sem pele e sem osso; sobrecoxa, com pele e osso. Conforme Ofício-Circular nº 4/2022/CGPE/DIPOA/SDA/MAPA (SEI 21612919), no caso de carcaças de frango congeladas deverá ser realizado o Dripping test em detrimento à determinação da Relação Umidade: Proteína (RUP).
Oportuno se torna dizer que estão abordados neste tópico os procedimentos de coleta, acondicionamento e envio de amostras para esta análise, a qual contribui para a averiguação adequada da presença de desvios dos parâmetros de qualidade do produto, como limites acima do permitido de umidade (%) e da relação umidade/proteína.
a. Materiais necessários
- Balança;
- Luvas de procedimento;
- Embalagens plásticas transparentes sem inscrições;
- Termômetro calibrado;
- Caixa isotérmica e material refrigerante;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Tesoura, cola e fita adesiva; e
- Saco-lacre.
b. Número de amostras e quantidade mínima
Para produtos resfriados (carcaças ou cortes) deve ser coletada apenas amostra de prova, em decorrência do prazo de validade exíguo, conforme versa o Decreto nº 9.013 de 2017 em seu art. 470, inciso II. A amostra deve ser composta por 3 (três) unidades do produto do mesmo lote em sua embalagem original, independentemente da quantidade em cada embalagem.
Para cortes congelados deve ser coletada amostra em triplicata, composta por amostra de prova, contraprova empresa e contraprova LFDA/SIF, sendo que cada amostra deverá conter 3 (três) unidades do produto do mesmo lote.
c. Procedimentos de coleta e acondicionamento
i. Escolher aleatoriamente as amostras, que devem ser coletadas em sua embalagem original e pertencer ao mesmo lote. A carcaça resfriada ou os cortes resfriados ou congelados devem ser coletados após o resfriamento ou congelamento, conforme corresponda. Ambos podem ser coletados em câmaras de estocagem;
ii. Caso não haja especificação do corte a ser amostrado na coleta oficial, deve-se proceder à coleta de carcaça de frango resfriada ou um dos cortes indicados na Portaria MAPA nº 557 de 2022;
iii. Realizar a aferição da temperatura do produto;
iv. Inserir a amostra em saco-lacre;
v. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida;
vi. Lacrar o saco;
vii. Preencher a RAL;
viii. Colocar o saco lacrado em caixa térmica previamente preenchida com material refrigerante; e
ix. Encaminhar ao laboratório.
Salienta-se que as amostras congeladas já lacradas devem ser mantidas congeladas junto ao meio refrigerante, antes de serem acondicionadas para envio ao laboratório. Similarmente, as carcaças ou cortes resfriados devem ser refrigerados junto ao meio refrigerante e, em seguida, acondicionados em uma caixa isotérmica adequada.
¶ 4.2.1.1.3 Coleta de amostras para análise microbiológica do Programa de Controle de Salmonella spp.
Com objetivo de garantir a segurança alimentar do consumidor, o MAPA estabeleceu o PNCP, o qual visa identificar a prevalência dos patógenos em produtos de origem animal produzidos pelos estabelecimentos brasileiros registrados junto ao SIF.
Em aves, o PNCP é composto pelo Programa de Controle e Monitoramento de Salmonella spp. em frangos, galinhas e perus de corte e reprodução. Este programa é instituído nos termos da Instrução Normativa MAPA nº 20 de 2016 e tem por finalidade a implantação do controle e o monitoramento de Salmonella spp. nos estabelecimentos de abate de frangos, galinhas, perus de corte e reprodução, registrados no SIF.
a. Número de amostras e quantidade mínima
Para amostragem de frangos deve ser coletada a amostra de prova composta por uma carcaça inteira resfriada a ser selecionada após o gotejamento e previamente à embalagem.
Para amostragem de perus, deve ser coletada a amostra de prova com quantidade mínima de 200 g de partes de pele e músculo da região pericloacal, do pescoço e das asas refrigerados.
O SIF deve realizar a verificação do controle de Salmonella spp. em carcaças de frangos e perus nos estabelecimentos de abate por meio de ciclos de amostragem oficiais conforme o disposto no Anexo III da Instrução Normativa MAPA nº 20 de 2016. De acordo com a classificação do estabelecimento, baseada pela quantidade de aves abatidas, é determinado o número de ciclos de coleta a serem realizados por ano, bem como a frequência das coletas.
Cada ciclo de amostragem é composto pelo número (n) de amostras a serem coletadas e o número máximo de amostras positivas aceitáveis (c). Para a interpretação dos resultados, é utilizado o plano de duas classes, no qual deve constar presença ou ausência de Salmonella spp. Os estabelecimentos devem manter o índice de contaminação por Salmonella abaixo ao número máximo de amostras positivas aceitáveis (c) constantes do Anexo III da Instrução Normativa MAPA nº 20 de 2016, de forma que o ciclo será considerado violado quando o número de amostras positivas for maior que o número aceitável (c).
Destaca-se que o ciclo somente é finalizado depois de recebido o último resultado, ainda que tenha sido ultrapassado o limite máximo de positivos aceitável durante a sua execução. É sobremodo importante assinalar que o ciclo não será interrompido caso não seja finalizado no mesmo ano em que tenha iniciado.
b. Materiais necessários
Para realizar as coletas de carcaças de frango são necessários os seguintes materiais:
- Luvas estéreis, ou, na indisponibilidade, luvas descartáveis sanitizadas com álcool 70%;
- Embalagens estéreis;
- Termômetro calibrado;
- Caixa isotérmica e material refrigerante;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Tesoura, cola e fita adesiva;
- Saco-lacre.
- Para a coleta de carcaças de peru, além dos materiais já mencionados são ainda necessários:
- Gancho de inox sanitizado com álcool 70%;
- Faca sanitizada com álcool 70% ou bisturi;
- Balança; e
- Mesa ou bancada higienizada e sanitizada com álcool 70%, preferencialmente com ganchos para pendurar a ave para coleta.
c. Procedimentos de coleta e acondicionamento
c.1. Frangos
i. Lavar as mãos com água e sabão e sanitizá-las com álcool 70% ou produto equivalente;
ii. Calçar as luvas estéreis. Na indisponibilidade destas, utilizar luvas sanitizadas com álcool 70%;
ii. Selecionar a amostra de forma aleatória imediatamente após a etapa de gotejamento e antes da embalagem primária. A amostra de frango deve ser composta por uma carcaça inteira;
iii. Aferir a temperatura da carcaça com o auxílio de um termômetro devidamente higienizado, pois esta temperatura será registrada, posteriormente, na RAL;
v. Acondicionar a amostra em uma embalagem estéril, concretizando-se a embalagem primária;
vi. Inserir a amostra em saco-lacre;
vii. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
viii. Lacrar o saco.
c.2 Perus
i. Lavar as mãos com água e sabão e sanitizá-las com álcool 70% ou produto equivalente;
ii. Calçar as luvas estéreis. Na indisponibilidade destas, utilizar luvas sanitizadas com álcool 70%;
iii. Selecionar a amostra de forma aleatória imediatamente após a etapa de gotejamento e antes da embalagem primária;
iv. Aferir a temperatura da carcaça com o auxílio de um termômetro devidamente higienizado, pois esta temperatura será registrada, posteriormente, na RAL;
v. Pendurar a carcaça de peru na mesa ou bancada higienizada e sanitizada;
vi. Utilizar gancho e faca para coleta mínima de 200 g de partes de pele e músculo da região pericloacal, do pescoço e das asas;
vii. Acondicionar a amostra em uma embalagem estéril, concretizando-se a embalagem primária;
viii. Inserir a amostra em saco-lacre;
ix. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
x. Lacrar o saco.
No caso de carcaças de frango e de peru não submetidas ao processo de pré-resfriamento por imersão, a coleta deve ser realizada após o resfriamento e antes da embalagem primária.
Após a coleta, a amostra deve ser mantida preferencialmente sob refrigeração e enviada o mais breve possível ao LFDA indicado na grade oficial de sorteio disponibilizado pelo DIPOA.
Lembre-se a temperatura de refrigeração para essa amostra deve ser entre 0º e 8º C (zero grau centígrado e oito graus centígrados, sendo aceitável uma variação de um grau centígrado a mais ou a menos). Caso a logística de envio da amostra não permita que esta chegue resfriada ao laboratório, excepcionalmente a amostra deve ser enviada congelada.
Posto isto, após o congelamento ou resfriamento da amostra juntamente com o meio refrigerante, ambos devem ser acondicionados em uma caixa isotérmica.
d. Procedimentos adicionais de segurança para a guarda e entrega da amostra para envio ao LFDA.
i. Após a coleta, a amostra deve ser imediatamente acondicionada no saco estéril, sendo lacrada em saco lacre após o preenchimento da RAL (impressão da cinta) no menor intervalo de tempo possível, permanecendo durante este período sob a supervisão dos servidores;
ii. Quando o envio da amostra aos LFDAs não ocorrer logo após a coleta, alguns cuidados devem ser adotados a fim de reforçar a segurança na guarda das amostras oficiais:
- As paredes e portas das gaiolas de resfriamento ou congelamento devem ser confeccionadas de tela ou grade com aberturas pequenas ou estreitas, que não permitam acesso às amostras através das mesmas, com uso de cadeados nas gaiolas, dos quais o estabelecimento não tenha cópias das chaves, bem como aposição de lacres nas portas ou dobradiças das gaiolas, de forma que seja assegurado que os lacres sejam rompidos se as portas ou dobradiças forem abertas;

Figura 14: Exemplo de cadeado com lacre plástico numerado na porta da gaiola em câmara de estocagem.
- No caso de guarda de amostras na sede do SIF, que o equipamento (geladeira ou freezer) seja dotado de cadeado ou chaves, sem que o estabelecimento tenha cópias das mesmas. Alguns SIFs adotaram um modelo de cadeado que pode, a princípio, travar a maioria destes equipamentos e o desbloqueio é feito por senha numérica;

Figura 15: Exemplo de trava de segurança com senha numérica.
- Para o fechamento das caixas de isopor ou isotérmicas, deverão ser afixados nas duas laterais, juntamente com a tampa, os lacres numerados fornecidos pelo MAPA;

Figura 16
- Os números desses lacres de caixa, previamente reservados, deverão ser informados no campo de observações da solicitação de amostra;
- Após a vedação da caixa de transporte, apor assinatura e carimbo na própria caixa sob a fita adesiva, que deve ser passada na junção da tampa, de forma que sejam destruídos se a fita adesiva for removida;

Figura 17
- A fita adesiva deverá ser aposta de forma a cobrir toda a extensão do lacre com a finalidade de proteger eventuais danos pela manipulação durante o transporte (vide foto abaixo);

Figura 18
- Realizar registros fotográficos da amostra coletada e da caixa após ser lacrada. Registros estes que poderão ser usados em casos de dúvidas no momento da recepção das amostras nos LFDAs; e
- A caixa com a amostra somente deve ser entregue ao representante da empresa no momento de ser levada à transportadora, devendo ser organizado protocolo de entrega da amostra para o estabelecimento, para que seja feito o transporte até o LFDA, identificando, no mínimo, a pessoa que fez a retirada da amostra, data e hora.
¶ 4.2.1.2 Amostragem em estabelecimentos de abate de suínos
¶ 4.2.1.2.1 Coleta de amostras para pesquisa de Enterobacteriaceae e Salmonella spp. por meio de esfregadura de superfície
O procedimento de esfregadura de superfícies com o uso de esponja é aplicado a produtos cuja contaminação é predominantemente superficial. A esfregadura pode ser empregada sempre que se deseja determinar a prevalência de determinado patógeno na cadeia produtiva, em programas de vigilância, ou sempre que seja necessária a verificação oficial quanto ao cumprimento de critérios microbiológicos definidos para atendimento ao disposto na Instrução Normativa MAPA nº 60 de 2018, para pesquisa de Enterobacteriaceae e Salmonella spp.
Convém salientar que a esfregadura de superfícies de carcaças para análise de Enterobacteriaceae deve ser realizada pelo próprio estabelecimento, cabendo ao SIF a averiguação dos gráficos de controle e das ações tomadas pelo estabelecimento frente aos desvios. Outro aspecto que deve ser fiscalizado pelo SIF é a técnica utilizada para esta coleta.
Para subsidiar o SIF em sua coleta para pesquisa de Salmonella spp., apresentamos a técnica correta para a coleta de amostra por esfregadura de superfícies com o uso de esponja, visando a pesquisa de microrganismos em carcaças suínas.
a. Materiais necessários
- Esponja de coleta previamente umidificada ou equivalente;
- Gabarito reaproveitável estéril ou 4 (quatro) gabaritos descartáveis estéreis, quadrados, com dimensões de 10cm de lado (a área interna do gabarito deve ser de 100cm²);
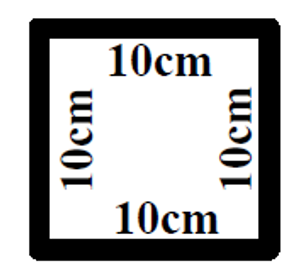
Figura 19: Gabarito de 100cm².
- Plataforma para realização da coleta;
- Álcool 70% ou solução antisséptica de eficácia equivalente para a higienização das mãos;
- Luvas estéreis;
- Máscara;
- Sacos-lacre;
- Caixas isotérmicas; e
- Material refrigerante.
b. Procedimentos de coleta e acondicionamento
i. A coleta deve ser realizada após a lavagem final da carcaça, antes da entrada no resfriamento e antes de qualquer intervenção de mitigação de risco biológico;
ii. A amostra deve ser composta por 1 (uma) esponja, após a esfregadura dos pontos determinados na meia carcaça, que são pernil, lombo, barriga e região axilar, perfazendo 400 cm²;
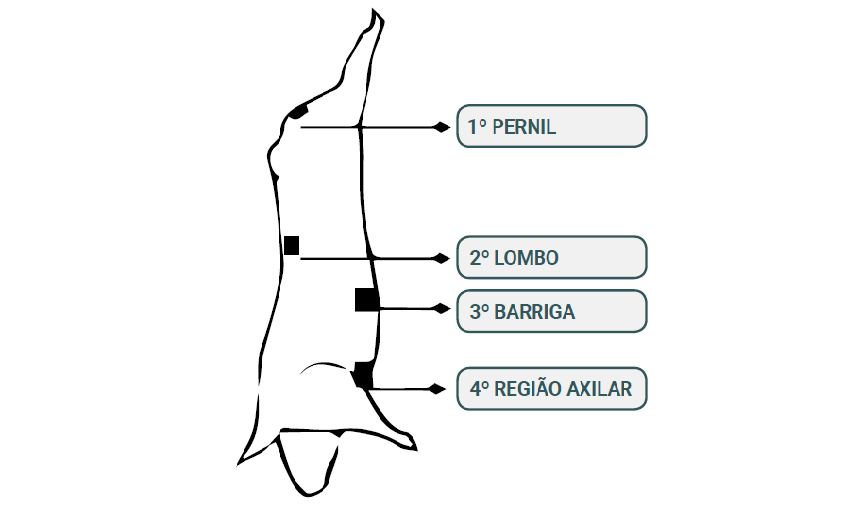
Figura 20: Pontos de coleta em carcaça suína
iii. O local para a coleta de amostras deve ter ambiente com iluminação superior a 540 lux e estar isolado da produção;
iv. A plataforma deve ser localizada de modo a permitir a coleta de amostra, sem ter contato com a carcaça;
v. O responsável pela coleta deve contar com a ajuda de um auxiliar, que manipulará a carcaça, movimentará a plataforma móvel e fornecerá o material de trabalho durante o procedimento. Tanto o responsável pela coleta, quanto o seu auxiliar devem sanitizar as mãos previamente à coleta;
vi. O auxiliar deve abrir a embalagem do gabarito, bem como a bolsa contendo a esponja, tocando apenas na parte externa de ambos e deve expor a esponja para o responsável pela coleta;
vii. Preconiza-se que coleta inicie pelo pernil, com alocação do gabarito e realização de 10 (dez) movimentos de varredura no sentido vertical e 10 (dez) movimentos no sentido horizontal, exercendo pressão moderada sobre a superfície da carcaça. Pode ser necessário rolar o gabarito de um lado a outro durante a esfregadura. O mesmo procedimento deve ser repetido no ponto de coleta do lombo, utilizando o mesmo lado da esponja;
viii. Deve ser realizado o mesmo procedimento na barriga e depois na região axilar com o outro lado da esponja;
ix. O auxiliar deve abrir a bolsa para alocar a esponja, após os esfregaços. A esponja deve ser colocada no interior da bolsa, desprendendo-a do cabo plástico, sem que o responsável pela coleta e o auxiliar toquem na esponja e no interior da bolsa. Deve ser retirado o ar e devem ser dadas três voltas na borda superior da bolsa antes de seu fechamento;
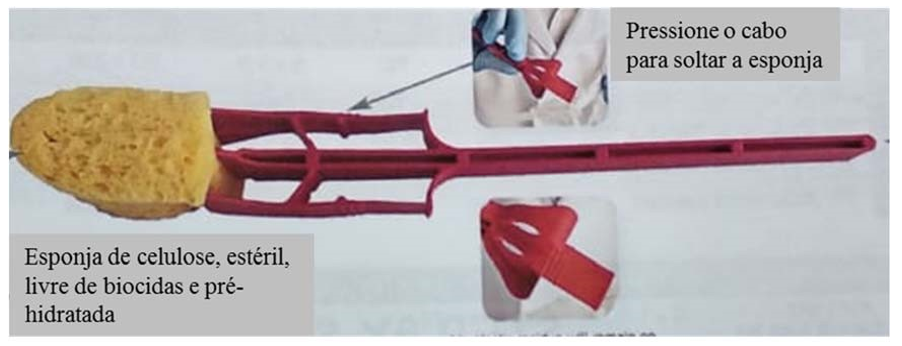
Figura 21a: Esponja de celulose pré-hidratada para coleta de amostra de esfregadura de superfícies em carcaça suína.

Figura 21b: Esponja de celulose pré-hidratada para coleta de amostra de esfregadura de superfícies em carcaça suína.
x. Posteriormente, deverão ser preenchidos os campos obrigatórios da RAL, com impressão e destaque da cinta identificadora preenchida, assinada e carimbada sendo envolta em plástico apropriado;
xi. A cinta identificadora deve ser acondicionada junto com a bolsa contendo a esponja dentro do saco-lacre;
xii. O saco lacrado deve ser inserido dentro de uma caixa isotérmica e acondicionado junto aos meios refrigerantes em quantidade suficiente para conservar a amostra sob temperatura de 1 a 8°C (a amostra não pode congelar!); e
xiii. A primeira caixa deve ser tampada e lacrada com fita adesiva e inserida na segunda caixa isotérmica, que também deve ser tampada e lacrada com fita adesiva.
¶ 4.2.1.3 - Amostragem em estabelecimentos de abate de bovinos
A Instrução Normativa MAPA nº 60 de 2018, estabelece o controle microbiológico em carcaça e carne de bovinos em abatedouros frigoríficos, com objetivo de avaliar a higiene do processo e reduzir a prevalência de agentes patogênicos. Tal controle abrange a coleta de amostras para análise de Enterobacteriaceae e Salmonella spp. em carcaça de bovinos e de Escherichia coli produtora de Shiga toxina (E. coli STEC) em carne bovina. Também está contemplada a adoção de medidas com o objetivo de restabelecer a conformidade em relação a estes microrganismos, a gestão de risco pelo DIPOA com base nos resultados microbiológicos e a revisão periódica e sistemática das ações de controle com vistas à redução de patógenos.
¶ 4.2.1.3.1 Coleta de amostras para pesquisa de E. coli produtora de Shiga toxina (STEC) e Salmonella spp.
A coleta de amostra para pesquisa de E. coli STEC e Salmonella spp. seguirá o método designado como N60, que consiste na coleta asséptica de sessenta pequenos pedaços dos retalhos da desossa de bovinos. Nos abatedouros frigoríficos que não realizam desossa, deverá ser coletada carne de cabeça, diafragma ou esôfago. Neste caso, não se utiliza o método N60, esses produtos só precisam ser cortados em pedaços menores para caberem na bolsa coletora, porém em ambos os casos o peso da amostra deverá ser de no mínimo 325 g e no máximo 357 g. Caso não seja recepcionada a quantidade mínima de 325 g, a amostra será rejeitada.
Os sorogrupos de STEC a serem pesquisados na carne bovina serão O157:H7, O26, O45, O103, O111, O121 e 0145 (big six), por serem considerados de alto risco para a saúde pública. As mesmas amostras também são aproveitadas para realizar análises para pesquisa de Salmonella spp.
Ressalta-se que poderá haver requisitos específicos para a coleta de amostras em estabelecimentos exportadores, não contemplados neste manual. Nesses casos, os responsáveis pelas coletas deverão consultar as orientações do DIPOA sobre requisitos específicos de exportação.
a. Materiais necessários
- Faca bem afiada, chaira e luva anticorte;
- Gancho;
- Luvas estéreis;
- 2 (dois) sacos plásticos estéreis tipo “whirl-Pak®;
- Gabarito com as dimensões do pedaço de carne com 2,5 cm de largura, 8 cm de comprimento e 5 mm de espessura;
- Saco-lacre;
- 2 (duas) caixas isotérmicas e material refrigerante;
- Balança; e
- Fita adesiva, cola e tesoura.
b. Número de amostras e quantidade mínima
O número de amostras a serem coletadas para a análise de STEC e Salmonella spp. dependerá da classificação do estabelecimento, que é baseada no volume médio diário de abate dos últimos três meses. Cada amostra deve ser composta por 60 porções de um dos produtos cárneos. A amostra composta pelas 60 porções deve apresentar peso mínimo de 325 gramas e peso máximo de 357 gramas. Quando coletadas carne de cabeça, diafragma ou esôfago, os pedaços apenas deverão caber dentro da bolsa coletora, obedecendo a quantidade determinada.
c. Procedimentos de coleta e acondicionamento
i. Selecionar aleatoriamente um lote de produção;
ii. Sanitizar o material de coleta;
iii. Sanitizar as mãos, colocar a luva anticorte e, em seguida, calçar a luva estéril;
iv. Selecionar um retalho do produto cárneo determinado e colocá-lo sobre a mesa com auxílio do gancho;
v. Retirar uma porção do retalho o mais fino possível e com maior área de superfície exposta à contaminação. Evitar o excesso de gordura na amostra, pois ela pode interferir na análise laboratorial;
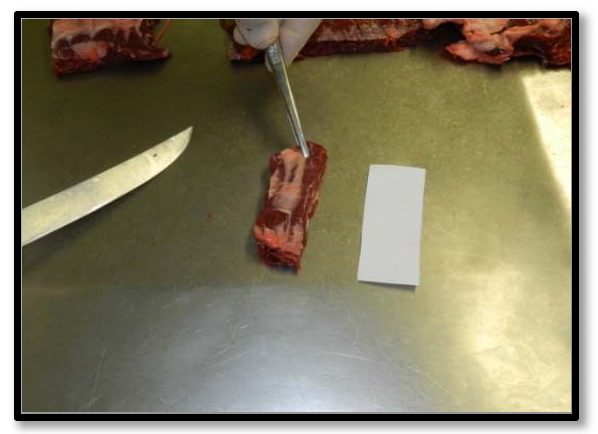
Figura 22: Fatia fina de retalho bovino para o método N60.
vi. Cada porção deve ser coletada de um retalho diferente, distribuída aleatoriamente em um lote;
vii. A amostra, composta por 60 porções, deve ser acondicionada no mesmo saco plástico estéril;
viii. Ao finalizar a coleta da amostra, deve ser aferida a temperatura do produto cárneo em que está dentro das caixas ou sacos que foram amostrados;
Atenção: Não deve ser aferida a temperatura na amostra já finalizada. A temperatura mais alta encontrada deve ser registrada na RAL.
ix. Inserir as amostras no saco-lacre;
x. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
xi. Lacrar o saco-lacre.
Quando o lote amostrado for composto por 5 (cinco) ou menos embalagens (sacarias ou caixas), o número de fragmentos a ser coletado em cada embalagem segue o disposto no quadro abaixo:
Tabela 1. Número de fragmentos dos retalhos da desossa a serem coletados por embalagem para executar o método N60.
|
Número de embalagens do lote selecionado para amostragem |
Número de fragmentos a serem coletados em cada embalagem |
|---|---|
|
5 |
12 |
|
4 |
15 |
|
3 |
20 |
|
2 |
30 |
|
1 |
60 |
A amostra deve ser acondicionada em uma caixa isotérmica adequada e devidamente lacrada com fita adesiva. Quando houver utilização de gelo seco, este deve estar embalado em material apropriado, evitando o contato direto com a embalagem da amostra e completando os espaços entre a amostra e a caixa com gelo. Coloque essa caixa dentro da outra caixa isotérmica maior. Coloque a RAL devidamente preenchida, assinada e carimbada dentro de um envelope e fixe-o na lateral da caixa de transporte.
¶ 4.2.1.3.2 Pesquisa de microrganismos em carcaças bovinas por meio de esfregadura de superfícies com o uso de esponjas
O procedimento de esfregadura de superfícies com o uso de esponjas é aplicado a produtos cuja contaminação é predominantemente superficial, como é o caso de carcaças de suínos e bovinos.
A esfregadura pode ser empregada sempre que se deseja determinar a prevalência de determinado patógeno na cadeia produtiva, em programas de vigilância ou sempre que seja necessário a verificação oficial quanto ao cumprimento de critérios microbiológicos definidos para atendimento ao disposto na Instrução Normativa MAPA nº 60 de 2018.
A coleta de amostras será realizada por esfregadura na superfície da carcaça bovina com uso de esponja estéril, hidratada com volume conhecido de diluente, livre de biocidas.
É fundamental que a amostragem obtida seja representativa dos lotes. No momento da coleta você deve assegurar que todas as carcaças terão a mesma chance de serem amostradas. Sorteios podem ser aplicados para atingir esse objetivo.
a. Materiais necessários
- Esponja de coleta previamente umidificada ou equivalente (bolsa com sistema de fechamento contendo a esponja);
- Há esponjas que já são previamente umidificadas. Trata-se de esponja de celulose, estéril e pré-hidratada com água peptonada tamponada, podendo ou não estar presa a um cabo plástico para facilitar a coleta da amostra
- Esse material não requer hidratação nem antes e nem após o uso.
- Em geral, esponjas pré-hidratadas devem ser mantidas sob refrigeração, em temperatura entre 0 e 10°C.
- Consulte as orientações do fabricante descritas no rótulo do material.
- Antes de utilizá-lo, verifique o prazo de validade.
- As esponjas secas necessitam ser umidificadas previamente ao uso. Nesse caso é necessário embebê-las com solução estéril de água peptonada tamponada à 1% previamente ao uso. Basta colocar 10ml da solução dentro do saco contendo a esponja, que deve absorver todo líquido. Tome cuidado para não contaminar a parte interna do saco;
- Plataforma para realização da coleta;
- Álcool 70% ou solução antisséptica de eficácia equivalente para a higienização das mãos;
- Gabarito reaproveitável estéril ou 4 gabaritos descartáveis estéreis, quadrados com dimensões de 10cm de lado (a área interna do gabarito deve ser de 100cm²);
- Luvas estéreis;
- Máscara;
- Sacos e lacres ou sacos lacre; e
- 2 caixas de isopor sendo uma para conter o saco de amostra e a substância refrigerante e outra para acondicionar a primeira caixa.
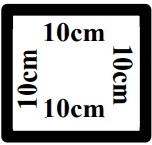
Gabarito 100cm2.
b. Número de amostras e quantidade mínima
A amostra é composta de 1 (uma) esponja.
c. Procedimentos de coleta
- Definir local adequado para coleta das amostras. O ambiente tem que ter iluminação superior a 540 lux e estar isolado da produção;
A plataforma deve estar localizada, adequadamente, junto à carcaça de forma a permitir a coleta da amostra sem que a plataforma toque a carcaça.
Atenção: Há a necessidade de uma pessoa para auxiliar na manipulação da carcaça e da plataforma quando necessário e também para fornecer e recolher o material de trabalho durante o procedimento, a fim de evitar contaminação cruzada da amostra.
- Lavar e sanitizar as mãos;
- Com cuidado, colocar as luvas estéreis;
- As luvas estéreis podem ser substituídas por luvas de procedimento caso as esponjas já estejam previamente hidratadas e presas a cabo plástico, devendo o operador tomar precauções para não tocar a esponja nem a parte interna do saco plástico que a contém;
- Abrir o saco contendo a esponja tomando cuidado para não tocar na superfície interna;
- Retirar a esponja de dentro do saco, tomando precaução para não contaminar a parte interna do saco e nem a esponja;
- Apoiar o gabarito estéril sobre a superfície da carcaça nos pontos definidos para coleta: vazio, peito alto, pescoço e alcatra;
- Iniciar a coleta pelo vazio (porção com menor possibilidade de contaminação), seguido pelo peito alto, pescoço, e por último a alcatra (porção com maior possibilidade de contaminação);
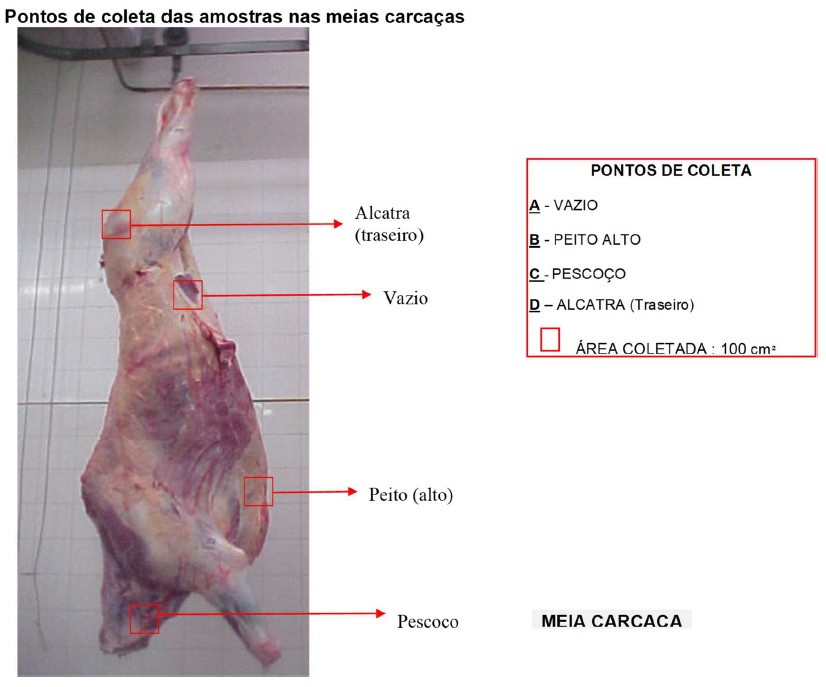
Figura 23: Pontos de Coleta esfregadura de superfícies em carcaça bovina com o uso de esponja.

Figura 24: Pontos de Coleta esfregadura de superfícies em carcaça bovina com o uso de esponja.
- Localizado o gabarito no primeiro ponto de coleta (vazio), esfregar com firmeza somente um lado da esponja sobre a área de amostragem de 100 cm² (10cmx10cm) emoldurada pelo gabarito;
Atenção: O esfregaço deve ser realizado com 10 (dez) movimentos no sentido vertical e 10 (dez) vezes no sentido horizontal. Como algumas superfícies amostradas não são planas e visando assegurar que os 100cm² sejam incluídos, pode ser necessário “rolar o gabarito” de um lado a outro durante a esfregação.
- Repetir o procedimento no segundo ponto de coleta (peito alto) utilizando o mesmo lado da esponja. Utilizar o outro lado da esponja para os demais pontos de coleta (pescoço e alcatra), repetindo o procedimento;
- Terminados os esfregaços, colocar a esponja na bolsa de coleta, retirar o excesso de ar e fechar a bolsa, dobrando a sua borda superior antes do fechamento;
- Preencher o documento oficial de requisição de análise conforme indicado no item 4.1;
- Inserir a bolsa de coleta dentro do saco ou saco lacre;
- Inserir a cinta de identificação da amostra e lacrar o saco conforme disposto no item 4.1, tomando especial cuidado para a proteção da cinta a fim de garantir que as informações da fita permaneçam legíveis;
- Inserir o saco lacrado ou saco lacre contendo as amostras dentro de uma caixa de isopor e acondicionar os meios refrigerantes já resfriados;
- Tampar e lacrar a primeira caixa com fita adesiva e inseri-la na segunda caixa de isopor que deverá ser tampada e também lacrada com fita adesiva; e
- Preparar a caixa para envio ao laboratório conforme orientado no item 4.1.
¶ 4.2.1.3.3 Coleta de amostras para teste de diagnóstico das Encefalopatias Espongiformes Transmissíveis (EET)
As Encefalopatias Espongiformes Transmissíveis (EET) são doenças neurodegenerativas que afetam o sistema nervoso central tanto de animais como de seres humanos. As EET são de difícil diagnóstico e não são passíveis de tratamento específico. Sendo assim, após a instalação do quadro clínico, elas são invariavelmente fatais. O agente etiológico das EET é denominado de príon (PrPsc), que é uma proteína infecciosa de conformação anormal originada da alteração de uma proteína normal do hospedeiro.
O acometimento dos seres humanos pelas EET pode ocorrer de diferentes formas como a clássica (espontânea, sem causa definida), a iatrogênica (produtos biológicos ou instrumental cirúrgico de indivíduos infectados), a familiar (predisposição genética) e a alimentar (ingestão de alimentos contaminados com o agente da Encefalopatia Espongiforme Bovina - EEB). A EEB, comumente conhecida como “Doença da Vaca Louca”, é uma enfermidade degenerativa fatal e transmissível do sistema nervoso central de bovinos, com longo período de incubação (média de quatro a cinco anos).
As vias de transmissão da EEB diferem de acordo com as formas da doença, na forma clássica a infecção ocorre pela ingestão de alimentos contaminados com o príon infeccioso enquanto na forma atípica ocorre pela mutação espontânea de uma proteína normal, portanto, não relacionada à ingestão de alimento contaminado. As características da forma atípica em bovinos ainda são incompreendidas e, em sua grande maioria, foram diagnosticadas em animais assintomáticos durante a vigilância rotineira, em animais mortos ou em abates de emergência. Diante da escassa informação sobre o quadro clínico das formas atípicas, é imprescindível realizar o diagnóstico laboratorial, para diferenciação de outras enfermidades. O Programa Nacional de Prevenção e Vigilância da Encefalopatia Espongiforme Bovina (PNEEB) foi instituído pela Instrução Normativa MAPA n° 44, de 17 de setembro de 2013, e é composto por subprogramas de vigilância e controle, dentre os quais destacam-se os subprogramas que possuem interface com o DIPOA, como o subprograma de controle em estabelecimentos de abate de ruminantes, subprograma de controle em estabelecimentos processadores de resíduos de origem animal e subprograma de vigilância das EET.
Como partícipes destes subprogramas, os estabelecimentos de abate de ruminantes deverão observar os seguintes procedimentos relacionados ao acondicionamento e envio de amostras de Tronco Encefálico (TE) para diagnóstico das EETs:
¶ 4.2.1.3.3.1 Animais Alvo e Condições para a Coleta de Amostra do Tronco Encefálico
É de fundamental importância para a vigilância epidemiológica da EEB, a INSPEÇÃO “ANTE MORTEM” realizada pelo Médico Veterinário do SIF, não devendo esta responsabilidade ser delegada a nenhuma outra categoria de servidor.
Os bovinos recepcionados nos estabelecimentos de abate que se enquadrem nas condições abaixo deverão ser submetidos à coleta de amostra do tronco encefálico para diagnóstico da EEB:
|
Animais “alvo” |
Condições |
|---|---|
| Bovinos de qualquer idade |
Presença de alterações comportamentais ou neurológicas compatíveis com EEB*: incapacidade de ficar em pé (decúbito) decorrente de causa neurológica; depressão; hipersensibilidade ao toque, luz ou som; movimentos excessivos e assimétricos das orelhas ou dos olhos; vocalização excessiva; tremores; excitabilidade; marcha anormal (como ataxia dos membros pélvicos); dificuldade em evitar obstáculos; cabeça baixa; ranger de dentes; alterações posturais e locomotoras significativas (ex.: posição de cão sentado); e resposta de pânico ou alerta excessivo. |
* Não se deve coletar amostras de animais mortos, em decúbito ou submetidos ao abate de emergência quando a causa não estiver associada com alterações comportamentais ou neurológicas compatíveis com a EEB.
A idade do animal deve ser estimada utilizando os seguintes procedimentos: cronologia dentária, marca de ferro candente da vacinação de fêmeas contra brucelose, cadastro na Base Nacional de Dados (BDN) do SISBOV. A idade deve ser específica, em pontos de corte de meio em meio ano (ex.: 3 anos; 3,5 anos; 4 anos; 4,5 anos ....).
¶ 4.2.1.3.3.2 Procedimentos de Coleta de Amostras do Tronco Encefálico para o Subprograma de Vigilância da Encefalopatia Espongiforme Bovina (EEB)
Uma amostra adequada do tronco encefálico é imprescindível para a correta realização dos testes (triagem ou confirmatório) e interpretação dos resultados, pois a proteína priônica alterada pode estar restrita a certos pontos do tronco encefálico, reduzindo sua presença à medida que se distancia da região do óbex. Portanto, a coleta da amostra deve ser criteriosa a fim de que se obtenha material suficiente e adequado para os testes. A porção anatômica mais indicada para o diagnóstico da EEB é a região da medula oblonga indicada no óbex. A presença da região do óbex (estrutura em formato de “V” na superfície dorsal do tronco encefálico – Figuras 25a e 25b) é fundamental para o diagnóstico! O material deve ser coletado o mais rápido possível após a morte do animal.
Figura 25a: Encéfalo de bovino com destaque da região do óbex; Figura 25b: Superfície dorsal do tronco encefálico de bovino com a estrutura em "V" do óbex, região de eleição para o diagnóstico de EEB. Fonte: Prof. Dr. Eurípedes Batista. Laboratório de Patologia Veterinária da Universidade Federal de Mato Grosso do Sul, 2015.
¶ 4.2.1.3.3.2.1 Material Necessário para a Coleta de Amostra do Tronco Encefálico
- Mesa ou bancada;
- Facas;
- Par de luvas;
- Pinça de dissecação anatômica e colher modificada para a coleta de tronco encefálico (colher longa e estreita com bordas cortantes). Figuras 26 e 27;
Figura 26: Colher modificada para a coleta de tronco encefálico; Figura 27: Pinça de dissecação anatômica, tesoura e colher modificada para a coleta de tronco encefálico.
- Sacos plásticos transparentes íntegros e limpos com fechamento em zíper ou frascos de boca larga com tampa rosqueada e fechamento hermético, em polipropileno translúcido, com dimensões mínimas sugeridas de 10cm de altura e 10cm de diâmetro;
- Material refrigerante;
- Caixa para envio da amostra ao laboratório;
- Envelopes ou sacos para proteção do Formulário de Colheita e Remessa de Amostras para Diagnóstico da Encefalopatia Espongiforme Bovina – EEB - Vigilância em Estabelecimento de Abate;
- Fita adesiva; e
- Tesoura.
¶ 4.2.1.3.3.2.2 Procedimentos de Coleta de Amostra do Tronco Encefálico
a. O médico veterinário do Serviço Oficial responsável pela coleta de amostra do tronco encefálico deverá estar com adequada titulação de anticorpos para a raiva (maior ou igual a 0,5 UI), utilizar os equipamentos de proteção individual (EPI) adequados (Exemplo: luvas de borracha e visor/óculos) assim como o material necessário para a coleta;
b. Fotografar o animal e as arcadas dentárias. O registro fotográfico é fundamental para a complementação da estimativa da idade do animal (Figuras 28 a, b, c e d);
Figura 28a, 28b, 28c e 28d: Arcadas Dentárias de Bovinos.
c. Remover a cabeça do animal na altura da articulação atlanto-occipital. Durante a remoção, a cabeça deve permanecer estendida o suficiente para manter o tronco encefálico na posição mais posterior durante o processo de remoção;
d. Identificar o forame magno e os côndilos occipitais (Figura 29);
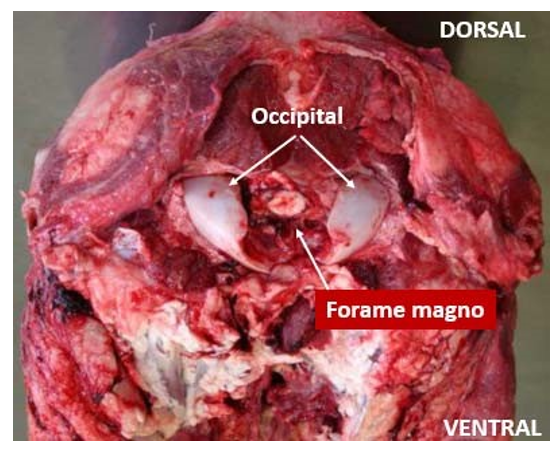
Figura 29: Vista caudal do crânio de bovino com destaque para o forame magno e os côndilos occiptais. Fonte: adaptado de TSEFAP – National Guidelines for Field Operations 2020/21.
e. Apoiar a cabeça removida em superfície plana e estável com a parte dorsal voltada para baixo;
f. Retirar o excesso de músculo e gordura próximos aos côndilos occipitais para facilitar o acesso ao forame magno, caso necessário;
g. Separar, com o dedo indicador, a dura-máter e qualquer tecido conjuntivo conectado ao tronco encefálico (Figura 30). Isso permite uma melhor visualização para a posterior retirada do tronco encefálico íntegro;
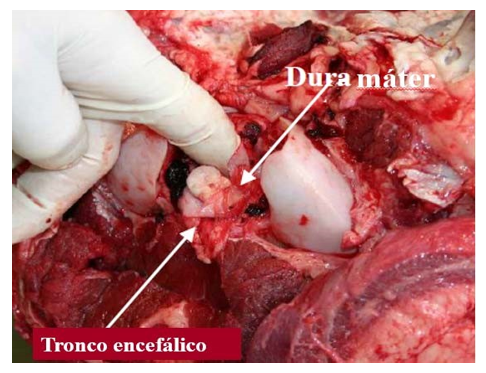
Figura 30: Vista caudal do crânio bovino mostrando a separação da dura-máter para posterior retirada do tronco encefálico. Fonte: adaptado de TSEFAP – National Guidelines for Field Operations 2020/21.
h. Inserir a colher modificada entre a dura-máter e a superfície dorsal do tronco encefálico até que a junção entre o cabo e a lâmina da colher esteja nivelada aos côndilos occipitais. A colher deve ser inserida firmemente em posição invertida para facilitar a remoção do tronco encefálico (Figura 31). Se necessário, tracionar suavemente o tronco encefálico com uma pinça de dissecação anatômica;
Figura 31
i. Empurrar firmemente a colher no sentido ventral e contra a crista esfenoidal occipital, girando-a da esquerda para a direita para romper qualquer tecido aderido ao redor do tronco encefálico, separando-o do cerebelo (Figura 32a e 32b); e
Figura 32a e 32b: Vista lateral do crânio bovino mostrando a colher modificada inserida no sentido ventral e contra a crista esfenoidal occipital com (a) e sem (b) o encéfalo. Fonte: adaptado de TSEFAP – National Guidelines for Field Operations 2020/21.
j. Remover o tronco encefálico, puxando a colher caudalmente ao longo da superfície ventral (Figura 33). O tronco encefálico deve ser constituído por parte da medula espinhal contendo o óbex, estrutura em formato de “V” na superfície dorsal do tronco encefálico.
Figura 33: Vista caudal do crânio bovino mostrando a remoção do tronco encefálico.
¶ 4.2.1.3.3.2.3 Acondicionamento da Amostra do Tronco Encefálico
O acondicionamento correto das amostras é feito em embalagem tríplice (Figura 34), ou seja, embalagem primária, secundária e terciária:
a.Embalagem primária: embalagem que ficará em contato direto com a amostra, preferencialmente saco plástico resistente e transparente com fechamento hermético (tipo zíper) ou, na impossibilidade do saco, frasco plástico resistente com fechamento hermético;
b. Embalagem secundária: embalagem que envolve a embalagem primária, de preferência um frasco plástico resistente de fechamento hermético, com o objetivo de evitar extravasamento de líquidos. Caso a embalagem primária seja um frasco plástico, poderá ser utilizada como embalagem secundária o saco plástico com fechamento hermético (tipo zíper). A embalagem secundária deve ser acondicionada dentro de caixa isotérmica com gelo reciclável, em quantidade suficiente para manter a temperatura das amostras resfriadas (2 a 8°C) ou congeladas (-20°C); e
c. Embalagem terciária: constitui-se da caixa de papelão para proteção da caixa isotérmica.
Observação: a caixa isotérmica não é considerada embalagem, pois permite troca de gases, mas é indispensável para manutenção da temperatura das amostras. Portanto, as amostras devem ser inseridas em caixa isotérmica (normalmente isopor) para conservação da temperatura até a chegada ao laboratório e deverá está contida dentro da embalagem terciária.

Figura 34: Exemplo de Embalagem Tríplice: saco plástico com fechamento hermético (1 - Embalagem Primária), frasco plástico resistente de boca larga e com fechamento hermético (2 - Embalagem Secundária), caixa isotérmica (isopor), que não é considerada embalagem porque permite troca de gases e caixa de papelão (3 - Embalagem Terciária).
¶ 4.2.1.3.3.2.4 Procedimentos de Acondicionamento das Amostras de Tronco Encefálico
a. Acondicionar a amostra na embalagem primária (saco plástico com fechamento hermético tipo zíper - Figura 35) ou frasco de boca larga com tampa e fechamento hermético (Figura 36), preferencialmente em polipropileno translúcido com dimensões mínimas sugeridas de 10cm de altura e 10cm de diâmetro;

Figura 35: Saco plástico com fechamento hermético tipo zíper.

Figura 36: Frasco de boca larga com tampa e fechamento hermético.
b. Identificar individualmente cada amostra, afixando na embalagem primária a etiqueta preenchida, conforme modelo padrão apresentado no ANEXO I. A etiqueta deve ser protegida com fita adesiva transparente, de forma que, se houver extravasamento de conteúdo, a etiqueta não se torne ilegível:
i. Utilizar apenas uma (1) embalagem primária por animal assim como 1 (um) Formulário de Colheita e Remessa de Amostras para Diagnóstico da Encefalopatia Espongiforme Bovina (EEB) - Vigilância em Estabelecimento de Abate para cada amostra, conforme modelo divulgado pelo Departamento de Saúde Animal, constante no ANEXO II; e
ii. Não misturar tecidos de diferentes animais na mesma embalagem primária, mesmo com suspeita de doença idêntica.
c. Resfriar (2 a 8°C) ou congelar (-20°C) a amostra. As amostras deverão ser congeladas quando o período para chegada ao laboratório for maior que 24 horas;
d. Inserir a embalagem primária na embalagem secundária;
i. Nesta embalagem poderão ser acondicionadas várias amostras, desde que estejam devidamente identificadas e acondicionadas em embalagem primária, conforme especificado no item a. acima; e
ii. Otimizar ao máximo a quantidade de amostras por embalagem secundária a cada envio, respeitando-se a orientação de encaminhar o mais rápido possível as amostras ao laboratório para análise.
e. Inserir a embalagem secundária contendo as amostras em caixa isotérmica previamente preenchida com material refrigerante (preferencialmente gelo reciclável);
i. Colocar a embalagem secundária na posição vertical dentro da caixa isotérmica e imobilizá-la com o material refrigerante (gelo reciclável) ou suporte de imobilização;
ii. Utilizar quantidade suficiente de gelo reciclável para manutenção da temperatura de conservação da amostra; e
iii. Utilizar, preferencialmente, apenas uma (1) caixa isotérmica para remessa de amostras, com volume máximo de 15 litros.
f. Preencher atentamente o Formulário de Colheita e Remessa de Amostras para Diagnóstico da Encefalopatia Espongiforme Bovina – EEB - Vigilância em Estabelecimento de Abate, conforme modelo divulgado pelo Departamento de Saúde Animal (ANEXO II). Anexar as fotografias do animal e das arcadas dentárias;
g. Afixar, na tampa da caixa isotérmica, um envelope com o Memorando de envio de amostras ao LFDA-PE (ANEXO III) e o Formulário de Colheita e Remessa de Amostras para Diagnóstico da Encefalopatia Espongiforme Bovina – EEB - Vigilância em Estabelecimento de Abate (ANEXO II);
h. Inserir a caixa isotérmica na caixa de papelão (embalagem terciária);
i. Preparar a caixa de papelão para envio ao LFDA-PE, fazendo constar de forma correta e completa o nome, o endereço, o CEP e o telefone (com código de área) do remetente e do destinatário, assim como um número de telefone em caso de emergência (modelo no ANEXO V). O nome do destinatário deverá ser afixado na tampa da caixa e o do remetente na lateral;
j. Afixar, na parte externa da caixa de papelão, as seguintes etiquetas:
i. Determinação de devolução imediata após 3ª tentativa de entrega:
| “DEVOLUÇÃO IMEDIATA APÓS A 3ª TENTATIVA DE ENTREGA” |
ii. Etiqueta de manuseio (Anexar em pelo menos dois lados opostos da caixa de papelão):

iii. Etiqueta de manutenção de temperatura, informando o estado do material biológico transportado (RESFRIADO OU CONGELADO), a temperatura ou faixa de variação (em Graus Celsius) e o prazo máximo para entrega:
| “CONSERVAR RESFRIADO (2 A 8°C) OU CONGELADO (-20°C). NÃO EXPOR A AMBIENTES ÚMIDOS. PRAZO MÁXIMO DE ENTREGA: URGENTE.” |
iv. Etiqueta de informação:
| “SUBSTÂNCIA BIOLÓGICA EMBALADA EM CONFORMIDADE COM A INSTRUÇÃO DE EMBALAGEM PI 650 – IATA” |
v. Etiqueta de risco:

vi. Etiqueta de categoria:

k. Atentar para os modelos de documentos de envio de amostras (ANEXOS III a IV).
¶ 4.2.1.4 Coleta de Conteúdo Cecal de Suínos e Bovinos de Corte para atendimento ao Programa de Vigilância e Monitoramento da Resistência aos Antimicrobianos (RAM) no âmbito da Agropecuária.
O Programa de Vigilância e Monitoramento da Resistência aos Antimicrobianos no Âmbito da Agropecuária foi implementado em atendimento ao Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos, no Âmbito da Agropecuária, o PAN-BR AGRO. O Programa de Vigilância e Monitoramento da Resistência aos Antimicrobianos tem por objetivo avaliar os riscos, tendências e padrões na ocorrência e disseminação da resistência aos antimicrobianos por meio de alimentos de origem animal produzidos no Brasil, bem como prover dados essenciais para análises de risco relevantes à saúde animal e humana. Além disso, as informações geradas pelo Programa irão embasar a tomada de decisões, o estabelecimento de políticas públicas e a alocação de recursos apropriados nas ações de prevenção e controle da RAM na cadeia de produção de alimentos.
O Programa de Vigilância e Monitoramento da Resistência aos Antimicrobianos prevê o monitoramento passivo e ativo dos sistemas produtivos de suinocultura e bovinocultura de corte, sendo que parte do monitoramento ativo envolve a coleta de amostras de conteúdo cecal de suínos e bovinos para isolamento de Escherichia coli e posterior análise da resistência aos antimicrobianos.
Sendo assim, seguem abaixo os materiais necessários e os procedimentos a serem executados pelos servidores competentes do SIF durante a coleta de conteúdo cecal de suínos e bovinos:
a. Materiais necessários
- Faca amolada e esterilizada ou lâmina de bisturi estéril;
- Frasco estéril de polipropileno ou polietileno com tampa; e
- Saco-lacre ou saco e lacre plásticos.
b. Procedimentos de coleta, acondicionamento e envio das amostras
i. A coleta da amostra deverá ser realizada na sala de abate, preferencialmente no Departamento de Inspeção Final (DIF). Caso não seja possível realizar a coleta no DIF, a mesma deverá ser realizada em um local identificado, adequado e suficientemente segregado a fim de impedir a contaminação cruzada. Além disso, o local deverá possuir iluminação suficiente, assim como equipamentos e utensílios que permitam uma higienização e desinfecção fácil e apropriada, além da contenção de eventual extravasamento de conteúdo cecal;
ii. A carcaça da qual será coletada a amostra de conteúdo cecal deverá ser selecionada aleatoriamente. Além disso, deverá ser assegurada a rastreabilidade da carcaça que originou a amostra de conteúdo cecal coletada;
iii. Após selecionar a carcaça da qual será coletada a amostra de conteúdo cecal, as vísceras brancas (intestinos) deverão ser desviadas para o DIF ou para local adequado a fim de proceder à coleta. Para isso, deverão ser realizados os seguintes procedimentos:
- Localizar o ceco e isolar uma parte dele. Realizar uma dupla amarradura do ceco, utilizando material limpo de primeiro uso, como, por exemplo, fio barbante;
- Realizar um corte no ceco entre as duas amarraduras, utilizando uma faca amolada e esterilizada a fim de minimizar o extravasamento de conteúdo cecal e evitar contaminação cruzada;
- Coletar em frasco plástico estéril 30 a 50 mL de conteúdo cecal, realizando uma pequena incisão no ceco com uma lâmina de bisturi estéril ou uma faca amolada e esterilizada. Não preencher totalmente o frasco e certificar-se de fechá-lo bem. Limpar a parte externa do frasco, caso tenha extravasado conteúdo cecal e, em seguida, fechá-lo hermeticamente e colocá-lo em saco-lacre, o qual deverá ser adequadamente fechado a fim de garantir o travamento de todas as presilhas. Na indisponibilidade deste, utilizar saco e lacre plásticos; Preencher a RAL da seguinte forma:
. Campo 1: não assinalar nenhum campo;
. Campos 2, 3, 4, 11, 12, 13, 16, 18, 19, 23, 24, 27 e 28: preencher conforme as informações solicitadas;
. Campo 5: preencher com a sigla RAM;
. Campos 06 a 10, 15, 20, 21, 29: preencher com a sigla NA;
. Campo 14: preencher com a data do abate;
. Campo 17: preencher com a quantidade de animais do lote de abate;
. Campo 22: preencher as informações referentes ao ano, horário de início do turno, turno, linha e volume de abate do dia. No ciclo, colocar o número 01. Na amostra, colocar sequencialmente o número, conforme o total de amostras previstas para o SIF;
. Campo 25: preencher com a informação "Resistência aos Antimicrobianos - RA01";
. Campo 26: preencher com as seguintes informações:
- Amostra: conteúdo cecal de suíno ou bovino;
- Exposição a agentes antimicrobianos (Conforme GTA ou Boletim Sanitário, mesmo com carência cumprida): informar o(s) antimicrobiano(s) utilizado(s); e
- Idade/Sexo/Raça do animal: se possível.
- Preencher, assinar e carimbar a cinta de identificação da amostra. Destacar e inserir a cinta já protegida dentro do saco-lacre, de forma que seja possível a leitura das informações que constam na cinta;
- Acondicionar o saco-lacre contendo a amostra em caixa isotérmica ou outro material isolante adequado, íntegro, em condições higiênicas, de paredes suficientemente espessas que confiram adequada proteção física, química e microbiológica, preferencialmente de primeiro uso e que garantam a integridade, inviolabilidade e conservação da amostra;
- A amostra deverá ser encaminhada resfriada. Para isso, deverá ser utilizado material refrigerante em quantidade adequada e proporcional ao volume da amostra, garantindo a manutenção da temperatura entre 2 e 8°C até a chegada ao laboratório. Recomenda-se o uso de folha de papelão ou isopor entre o material refrigerante e a amostra, evitando o contato direto e, consequentemente, o seu congelamento. Os espaços vazios deverão ser preenchidos a fim de evitar danos à amostra;
- Fechar a caixa contendo a amostra com a utilização de fita adesiva;
- Inserir a RAL em um envelope ou saco plástico e fixá-la na face lateral externa da caixa de envio da amostra. Recomenda-se afixar na superfície externa da caixa uma etiqueta, informando o tipo de amostra (conteúdo cecal de suíno ou bovino), a conservação (resfriada) além do dia e horário da coleta; e
- A amostra deverá ser enviada exclusivamente à Unidade de Diagnóstico Animal do Laboratório Federal de Defesa Agropecuária de São Paulo (LFDA-SP) o mais brevemente possível após sua coleta, preferencialmente em até 24 horas, de forma a proporcionar seu recebimento em condições adequadas e tempo hábil para análise. O prazo máximo para recebimento das amostras de conteúdo cecal pelo laboratório é de até 72 horas após a coleta.
¶ 4.2.2 Requisitos específicos de coleta, acondicionamento e remessa de amostras realizadas em estabelecimentos sob SIF com inspeção periódica
¶ 4.2.2.1 Amostragem de leite e produtos lácteos
¶ 4.2.2.1.1 Coleta de amostras para análise de Contagem Padrão em Placas (CPP) em leite cru
O objetivo da análise oficial de CPP em leite cru é proceder a verificação oficial do atendimento ao limite de Contagem bacteriana ou CPP no leite antes do seu processamento no estabelecimento beneficiador, em atendimento à Instrução Normativa MAPA nº 76, de 26 de novembro de 2018, e Instrução Normativa MAPA nº 77, de 26 de novembro de 2018. As Instruções Normativas referidas visam a melhoria da qualidade do leite, desde a ordenha e estocagem na propriedade rural, perpassando pelo transporte do leite ao estabelecimento e sua estocagem até o beneficiamento.
As amostras para CPP são coletadas exclusivamente em unidades de beneficiamento de leite e derivados, não sendo coletadas em postos de refrigeração.
a. Materiais necessários
- Saco-lacre;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Fita adesiva, cola e tesoura;
- Caixas de material isotérmico para transporte de amostras;
- Luvas estéreis ou, na indisponibilidade, luvas de procedimento sanitizadas com álcool 70%;
- Álcool 70%;
- Agitador (manual ou automático);
- Termômetro;
- Caneca ou outro utensílio que possa ser utilizado para coletar o leite; e
- Frascos de 50 mL de capacidade, incolores, translúcidos, constituídos de tampa e corpo, estéreis e com comprimido de azidiol em seu interior. Cada frasco plástico coletor deve estar acondicionado individualmente em invólucro plástico transparente para ser removido no momento do uso, devendo ser observado o prazo de validade do frasco. Destaca-se que esses frascos são fornecidos pelos laboratórios RBQL que enviam frascos adicionais ao estabelecimento para uso pelo SIF.
b. Número de amostras e quantidade mínima
Deve ser coletado uma amostra de prova. O volume mínimo é de 30mL e máximo de 40mL para cada silo que tenha leite cru refrigerado estocado.
Para os estabelecimentos que recebam leite em latões, a amostra deve ser somente coletada no tanque da recepção.
Estabelecimentos que não possuem silo ou balão de estocagem, coletar uma amostra do conjunto dos compartimentos do caminhão ou do tanque pulmão.
Em situações em que o leite cru refrigerado estiver misturado com leite fluido a granel de uso industrial, a coleta deve ser realizada quando houver a chegada do próximo caminhão de leite de produtores.
Atenção: Não deve ser coletada amostra de contraprova para análise de CPP, tendo em vista que não há contraprova para análise microbiológica.
c. Procedimentos de coleta e acondicionamento
i. Ligar o motor do agitador para homogeneizar o leite do silo ou proceder agitação manual;
ii. Higienizar a torneira do silo com álcool 70%;
iii. Calçar luvas estéreis. Na ausência destas higienizar as mãos com água a sabão e, posteriormente, realizar a sanitização das mãos com álcool 70% ou produto equivalente, garantindo que se encontrem completamente secas previamente ao início do procedimento;
iv. Descartar os primeiros litros de leite do silo antes de proceder à coleta na torneira do silo;
v. Utilizar caneca ou amostrador de leite, higienizado com álcool 70%, no caso de ausência de torneira (ou no caso de coleta em caminhão);
vi. Coletar o volume mínimo de 50 mL de leite;
vii. Transferir imediatamente de 30 a 40 mL do leite cru amostrado para o frasco plástico coletor, até a linha indicativa deste volume presente no corpo do frasco;
viii. Agitar o frasco imediatamente após a coleta, lentamente, repetindo esse procedimento após 15 minutos, até que haja a completa dissolução do conservante. Quando houver coleta de mais de um silo, os frascos devem ser individualmente identificados;
ix. Inserir a amostra no saco-lacre;
x. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida;
xi. Lacrar o saco; e
xii. Refrigerar a amostra imediatamente.
A aferição da temperatura do leite, coletado diretamente nos caminhões ou nos silos que não disponham de equipamento de controle de temperatura, deve ser feita em recipiente em separado, imediatamente antes ou após a colheita da amostra. A temperatura do leite cru refrigerado no ato de sua recepção pelo estabelecimento não deve ser superior a 7 °C (sete graus Celsius), admitindo-se, excepcionalmente, o recebimento até 9 °C (nove graus Celsius).
A amostra lacrada deve ser conservada refrigerada. Devem ser utilizados caixas isotérmicas e materiais refrigerantes em quantidade proporcional ao volume da amostra para envio aos laboratórios da RBQL. A amostra oficial pode ser encaminhada juntamente com as amostras de produtores da empresa. Porém, deve-se atentar ao excesso de materiais refrigerantes colocados na caixa, os quais podem provocar congelamento e rejeição da amostra. O prazo máximo para recebimento da amostra no laboratório é de 7 (sete) dias a partir da coleta.
Atenção: A temperatura de recebimento da amostra pelo laboratório da RBQL é de até 10ºC e o prazo entre a coleta e a análise pelo laboratório deve seguir as orientações da CGAL/SDA definidas especificamente para a RBQL.
¶ 4.2.2.1.2 Coleta de amostras para análises físico-químicas, Caseínomacropeptídeo (CMP) e pesquisa de fraudes em leite cru
Nas amostras de leite cru ou leite a fluido a granel de uso industrial coletadas para atendimento ao PACPOA, são realizadas análises físico-químicas, assim como podem também ser realizadas análises para pesquisa de indícios de fraude com objetivo de avaliar a qualidade e segurança do leite e produtos lácteos.
Como critério de pesquisa de fraudes em amostras de leite, são verificadas a adição de soro de leite, açúcares, sais, conservantes, dentre outras substâncias proibidas, por meio da pesquisa ou quantificação de amido, álcool etílico, formol, índice de caseínomacropeptídeo (CMP), índice crioscópico, neutralizantes da acidez e sacarose.
O CMP é um fragmento da k-caseína, liberado pela ação da enzima quimosina durante a coagulação enzimática do leite no processo de produção de queijos. A detecção de CMP pode ser considerada uma indicação de adição de soro de queijo no leite. Complementarmente, são realizadas análises para identificação de substâncias adulterantes adicionadas ao leite como amido, sacarose, formaldeído e substâncias redutoras voláteis.
a. Materiais necessários
- Sacos-lacre;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Caixas de material isotérmico;
- Material refrigerante;
- Fita adesiva, cola e tesoura;
- Agitador (manual ou automático);
- Concha, caneca ou outro utensílio que possa ser utilizado para coletar o leite; e
- Frascos de boca larga com tampa tipo lacre, sem nenhuma inscrição. Preferencialmente o frasco deve ter capacidade mínima de 900mL. Na ausência destes, podem ser utilizados tantos frascos quanto forem necessários para atingir o volume necessário de amostra.
b. Número de amostras e quantidade mínima
i. Para análises de CMP e pesquisa de fraudes (adição de amido, sacarose, formaldeído e substâncias redutoras voláteis, como álcool etílico): coletar amostras em triplicata (prova, contraprova SIF/Laboratório e contraprova empresa). Cada amostra deverá ter volume mínimo de 900 mL e deverá ser congelada após a coleta; e
ii. Para análises físico-químicas (acidez, densidade e composição centesimal): coletar amostra única (prova). A amostra deverá ter volume mínimo de 900 mL e deverá ser mantida sob refrigeração.
Atenção: Não deve ser coletada amostra de contraprova para análise físico-química de leite cru, tendo em vista o curto prazo de validade deste produto o que impede a realização de análise pericial de contraprova.”
c. Procedimentos de coleta e acondicionamento
No manuseio e acondicionamento das amostras, deve-se buscar a preservação de baixas temperaturas. Para isso, prepare antecipadamente o material a ser utilizado, de forma a minimizar a exposição da amostra à temperatura ambiente. Para a realização da coleta devem ser adotados os seguintes procedimentos:
c.1 Para análise de CMP e pesquisas de fraudes:
i. Agitar o leite vigorosamente por três minutos. Pode ser realizada a agitação manual (dentro do caminhão) ou com agitador automático, quando o leite estiver em silo ou balão de estocagem dotado de sistema de pás. A correta homogeneização da amostra é fundamental para garantir a sua representatividade;
ii. Com o auxílio de uma caneca, coletar amostras em triplicata (prova, contraprova SIF/Laboratório e contraprova empresa). Cada amostra deverá ter no mínimo 900 ml de leite;
iii. Acondicionar o leite em 3 frascos, sem preencher toda a capacidade, pois é necessário deixar um espaço para expansão do leite nos frascos para que não haja extravasamento em função do congelamento do leite. Se não for possível a utilização de frasco de 900ml, as amostras deverão ser distribuídas em tantos frascos quantos forem necessários até completar o volume mínimo de 900ml para cada amostra;
iv. Inserir cada amostra em um saco-lacre;
v. Inserir em cada saco-lacre a cinta de identificação de amostra correspondente (prova, contraprova SIF/Laboratório e contraprova empresa);
vi. Lacrar o saco; e
vii. Congelar as amostras em até 12 horas após a coleta.
Atenção: As amostras deverão ser mantidas refrigeradas até que seu congelamento seja realizado. Para que todo o conteúdo da amostra seja congelado, sugerimos utilizar freezer ou câmara de congelamento por no mínimo 24 horas, sendo recomendado o congelamento por 48 horas a fim de que as amostras se mantenham congeladas até o recebimento pelo laboratório. O tempo para congelamento pode variar conforme tipo de equipamento utilizado.
c.2 Para análises físico-químicas:
i. Agitar o leite vigorosamente por 15 minutos, no caso de agitação manual (dentro do caminhão), ou ligar o motor do agitador quando o leite estiver em silo ou balão de estocagem dotado de sistema de pás. A correta homogeneização da amostra é fundamental para garantir a sua representatividade;
ii. Com o auxílio de uma caneca, coletar 1 amostra (prova). A amostra deverá ter no mínimo 900 ml de leite;
iii. Acondicionar o leite no frasco. Se não for possível a utilização de frasco de 900ml, a amostra deverá ser distribuída em tantos frascos quantos forem necessários até completar o volume mínimo de 900ml;
iv. Inserir a amostra em saco-lacre;
v. Inserir no saco-lacre a cinta de identificação de amostra (prova); e
vi. Lacrar o saco.
Atenção:
- As amostras para análises físico-químicas deverão ser mantidas sob refrigeração desde a coleta até o recebimento no laboratório. Ressalta-se a importância do planejamento da logística e transporte, tendo em vista que essas análises devem ser iniciadas em até 48 horas a partir da hora da coleta da amostra.
- A amostra destinada às análises físico-químicas deve ser coletada à parte, separadamente das amostras para análise de CMP e pesquisa de fraudes. O mesmo se aplica às SOAs, sendo uma RAL para análises físico-químicas e uma RAL distinta para análise de CMP e pesquisa de fraudes.
- Vale registrar que, em situações que as amostras coletadas em triplicata sejam enviadas ao LFDA, deve-se enviar também as amostras de contraprova do SIF. Contrariamente, quando as amostras forem enviadas para laboratório credenciado, deve-se manter a amostra de contraprova do SIF sob a guarda da fiscalização.
¶ 4.2.2.1.3 Coleta de amostras para análises físico-químicas, Caseínomacropeptídeo (CMP) e pesquisa de fraudes em leite pasteurizado/UHT
Nas amostras de leite pasteurizado e leite UHT coletadas para atendimento PACPOA são realizadas análises físico-químicas, bem como podem ser realizadas as pesquisas de indícios de fraude com objetivo de avaliar a qualidade e segurança do leite e produtos lácteos.
a. Materiais necessários
- Sacos-lacre;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Termômetro;
- Caixas de material isotérmico e material refrigerante; e
- Fita adesiva, cola e tesoura.
b. Número de amostras e quantidade mínima Leite pasteurizado
Leite pasteurizado
Para análises de CMP e de substâncias adulterantes do leite como amido, sacarose, formaldeído e substâncias redutoras voláteis (como o álcool etílico), as amostras de leite pasteurizado devem ser coletadas em triplicata. Deve-se observar que essas amostras devem ser congeladas após a coleta.
Para análises físico-químicas, a amostra coletada de leite pasteurizado é única (prova) e deve ser mantida sob refrigeração.
Leite UHT
Para a análise de CMP e pesquisa de fraudes em amostras de leite UHT, preconiza-se a coleta de amostras em triplicata. Ressalta-se que amostras para análise de CMP devem ser congeladas em até 48 horas a partir da data de sua fabricação.
Atenção: Para as análises físico-químicas também devem ser coletadas amostras em triplicata (prova, contraprova SIF/LFDA, contraprova empresa), as quais podem ser conservadas em temperatura ambiente.
No que concerne à quantidade, as amostras de leite pasteurizado e UHT devem ter volume mínimo de 1 (um) litro. As amostras devem ser coletadas nas embalagens originais, logo após o envase, na esteira ou caixas, ou na câmara de estocagem, preferencialmente no mesmo dia do envase, de forma que cheguem ao laboratório dentro do prazo de validade, em condições de serem analisadas.
No caso de triplicata, as amostras devem pertencer ao mesmo lote.
c. Procedimentos de coleta e acondicionamento
i. Selecionar amostras aleatoriamente após o processo de envase;
ii. Coletar amostras do produto em sua embalagem original (amostra única ou triplicata, conforme produto e tipo de análise);
iii. Inserir a amostra em saco-lacre;
iv. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida;
v. Lacrar o saco; e
vi. No caso de amostras para análises de CMP e pesquisa de fraudes, as amostras devem ser congeladas, respeitando-se os seguintes prazos:
- Leite pasteurizado: as amostras devem ser congeladas em até 12 horas após a coleta; e
- Leite UHT: as amostras para análise de CMP devem ser congeladas em até 48 horas a partir da data de fabricação.
Atenção: As amostras deverão ser mantidas refrigeradas até que seu congelamento seja realizado. Para que todo o conteúdo da amostra seja congelado, sugerimos utilizar freezer ou câmara de congelamento por no mínimo 24 horas. O tempo para congelamento pode variar conforme tipo de equipamento utilizado.
Ao acondicionar as embalagens de leite pasteurizado, em função de sua fragilidade, se deve evitar o contato das embalagens com as partes rígidas dos lacres. Este contato, aliado ao peso dos blocos refrigerantes e a movimentação durante o transporte, pode levar a perfuração das embalagens e perda das amostras.
Outro aspecto a destacar, é a impossibilidade de envio conjunto de amostras refrigeradas e congeladas ao laboratório. As amostras devem ser acondicionadas separadamente conforme a faixa de temperatura de conservação recomendada. Considerando a perecibilidade das amostras refrigeradas e prazo de validade exíguo, estas devem ser enviadas rapidamente para o laboratório.
Por outro lado, as amostras congeladas necessitam de um prazo para o congelamento. Esses aspectos devem ser considerados para a escolha do dia da realização das coletas, em função da logística de transporte de amostras.
Por fim, cabe ressaltar que as amostras de leite fluido (pasteurizado e UHT) destinadas ao ensaio de Índice de CMP e à pesquisa de fraudes devem compor uma amostra à parte, separada da amostra destinada às demais análises físico-químicas. Essa amostra deve estar acompanhada de RAL própria, coletada em triplicata e conservada congelada, conforme descrito acima.
¶ 4.2.2.1.4 Coleta de amostras para análises microbiológicas em leite pasteurizado e leite UHT
Nas amostras de leite pasteurizado e leite UHT coletadas para atendimento PACPOA também são realizadas análises microbiológicas com objetivo de avaliar a qualidade e segurança do leite e produtos lácteos.
a. Materiais necessários
- Sacos-lacre;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Termômetro;
- Caixas de material isotérmico e material refrigerante; e
- Fita adesiva, cola e tesoura.
b. Número de amostras e quantidade mínima
i. Leite pasteurizado
Para análise microbiológica a amostra coletada de leite pasteurizado é única (prova) e deve ser mantida sob refrigeração. A amostra de leite pasteurizado deve ter volume mínimo de 1 (um) litro e deve ser coletada na embalagem original, logo após o envase ou na câmara de estocagem, preferencialmente no mesmo dia do envase, de forma que chegue ao laboratório dentro do prazo de validade.
ii. Leite UHT
Para análise microbiológica a amostra coletada de leite UHT é única (prova) e deve ter volume mínimo de 2 (dois) litros. As amostras devem pertencer ao mesmo lote e serem coletadas nas embalagens originais, logo após o envase, na esteira ou caixas, ou na câmara de estocagem, preferencialmente no mesmo dia do envase. As amostras de leite UHT podem ser conservadas em temperatura ambiente.
c. Procedimentos de coleta e acondicionamento
i. Selecionar amostras aleatoriamente após o processo de envase;
ii. Coletar amostras do produto em sua embalagem original;
iii. Inserir a amostra em saco-lacre;
iv. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
v. Lacrar o saco.
¶ 4.2.2.1.5 Coleta de amostra de gordura anidra de leite (butter oil)
As atividades de coleta do produto lácteo gordura anidra de leite, também chamado de butter oil, são realizadas para atendimento ao PACPOA em estabelecimento com inspeção periódica de leite e derivados.
Entende-se por gordura anidra de leite, o produto gorduroso obtido a partir de creme ou manteiga pela eliminação quase total de água e sólidos não gordurosos, mediante processos tecnologicamente adequados.
a. Materiais necessários
- Frascos esterilizados ou bolsas estéreis;
- Termômetro;
- Coletor (concha coletora);
- Álcool 70%;
- Pano descartável;
- Sacos-lacre;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra; e
- Fita adesiva, tesoura e cola.
b. Número de amostras e quantidade mínima
Para análise físico-química, as amostras devem ser coletadas em triplicata. A quantidade de produto a ser coletada é de, no mínimo, 500g para cada amostra. A depender do tamanho dos frascos disponíveis, utilize quantos forem necessários para obter o volume mínimo requerido.
Para análise microbiológica, deve ser coletado somente a amostra de prova. A quantidade de produto é de, no mínimo, 200g.
Usualmente é inviável a coleta do produto em sua embalagem original, devendo-se então realizar o fracionamento da amostra. Para fracionamento, o SIF deve verificar a existência de instalações, utensílios e embalagens em boas condições higiênicas e condizentes com o procedimento.
c. Procedimentos de coleta e acondicionamento
i. Escolher o tambor a ser amostrado;
ii. Higienizar o tambor externamente com álcool 70%;
iii. Aquecer o tambor a uma temperatura de 40ºC, para total diluição da gordura;
iv. Higienizar as mãos com água e sabão e, posteriormente, realizar a sanitização das mãos com álcool 70%;
v. Sanitizar os utensílios. Deve-se atentar que a concha não deve ser higienizada com álcool 70% nos casos de coleta para análises físico-químicas, visto que a presença de álcool é uma das análises realizadas no produto. Para amostras microbiológicas, caso a empresa não tenha fornecido coletor estéril ou previamente sanitizado, é possível higienizá-los com álcool 70%, atentando-se a deixar o álcool evaporar, para evitar resíduos no produto;
vi. Retirar o lacre do tambor com auxílio de um alicate;
vii. Abrir a tampa do tambor com o uso de uma chave apropriada, fornecida pela empresa;
viii. Após a abertura do tambor, verificar a temperatura do produto;
ix. Utilizar concha coletora sanitizada de acordo com o tipo de amostra, para transferir porções do produto para o frasco (ou bolsa estéril), até completar o volume de 200g (análise microbiológica) ou 500g (análise físico-química);
x. Imediatamente após a coleta, fechar cuidadosamente a embalagem ou frasco;
xi. Inserir a amostra em saco-lacre;
xii. Inserir no saco-lacre a cinta de identificação da amostra; e
xiii. Lacrar o saco.
Devido às características do produto e do envase, não há necessidade de refrigeração para conservação das amostras. Porém, devem ser seguidos as recomendações do rótulo para conservação do produto coletado.
¶ 4.2.2.2 Amostragem de produtos das abelhas e derivados
O mel é um produto de origem animal resultante da ação de enzimas salivares das abelhas sobre o néctar colhido das flores. Outros produtos provenientes da atividade das abelhas são a geleia real, cera, pólen apícola, própolis e extrato de própolis.
A coleta de produtos das abelhas objetiva a obtenção de dados para verificar o índice de conformidade de produtos de origem animal e preconiza, dentre outras, a coleta de produtos das abelhas nas unidades de beneficiamento para análises de parâmetros físico-químicos e microbiológicos. São passíveis de coleta os seguintes produtos:
- Geleia real;
- Cera de abelhas;
- Mel e mel de melato;
- Pólen apícola; e
- Própolis e extrato de própolis.
Desses produtos, apenas está preconizada análise microbiológica para geleia real. Os produtos mel, mel de melato, cera de abelhas, pólen apícola, própolis e extrato de própolis são coletados visando a análise físico-química.
Em sua maioria, as amostras de mel e produtos das abelhas são coletadas em suas embalagens originais. Há situações em que se faz necessário o fracionamento das amostras, e serão destacados os pontos sobre particularidades particularidades relacionadas às coletas destes produtos, notadamente no que diz respeito ao número de amostras e quantidade mínima, bem como à forma de conservação para o envio ao laboratório.
Número de amostras e quantidade mínima:
a. Mel ou mel de melato e cera de abelhas
Deve ser coletada a amostra em triplicata. A quantidade de produto a ser coletada por amostra é de 250g, preferentemente em sua embalagem original.
b. Pólen apícola e própolis
Para ambos os produtos, a quantidade de amostra será de 50g em embalagem original. Assim como nos demais casos, a amostra será coletada em triplicata.
c. Extrato de própolis
Deve ser coletada a amostra em triplicata para realização de análises físico-químicas. A quantidade de produto a ser coletada por amostra é de 150mL em embalagem original, devendo ser coletados tantos frascos quanto necessários, até completar a quantidade mínima. Os frascos que compõem cada amostra devem ser do mesmo lote.
d. Geleia real
Para geleia real deve ser coletada a amostra de prova. A quantidade de produto a ser coletada por amostra é de 50g em embalagem original, visando a realização de análises microbiológicas.
¶ 4.2.2.2.1 Coleta de amostras de produtos de abelhas em embalagens originais
a. Materiais necessários
- Saco plástico transparente;
- Saco-lacre;
- Caixas isotérmicas e material refrigerante;
- Papel alumínio;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Fita adesiva e tesoura.
b. Procedimentos de coleta e acondicionamento
i. O lote a ser amostrado deve ser selecionado aleatoriamente;
ii. As embalagens originais devem ser coletadas em quantidade suficiente para compor as três amostras da triplicada, sempre do mesmo lote, no caso de análises físico-químicas. Para a coleta de geleia real, basta a obtenção de uma unidade de produto que comporá a amostra de prova. Ressalta-se que, caso as embalagens contenham quantidades inferiores ao mínimo amostral, devem ser coletadas quantas embalagens forem necessárias para atingir o peso mínimo da amostra;
iii. As embalagens que compõem cada amostra deverão ser inseridas em sacos-lacre juntamente com o rótulo do produto a cinta de de identificação da amostra, previamente protegida;
iv. Posteriormente, o saco deve ser lacrado e a amostra acondicionada para o envio ao laboratório:
- As amostras de mel, mel de melato, cera de abelhas, pólen apícola e o extrato de própolis devem ser conservadas em temperatura ambiente. Para acondicionamento das amostras na caixa de transporte, deve-se utilizar “calços” de papelão ou isopor, para evitar que a amostra fique solta e que sofra danos; e
- A amostra de geleia real deve ser congelada previamente ao envio ao laboratório.
Para o envio, a amostra deve ser acondicionada em uma caixa isotérmica com material refrigerante em quantidade suficiente para a manutenção de sua temperatura até o recebimento no laboratório. O material refrigerante não deve ficar em contato direto com as embalagens primárias, podendo a amostra (previamente embalada e lacrada) ser envolta em papel alumínio ou plástico.
Em seguida, a caixa isotérmica ser vedada com fita adesiva, e então colocada dentro de outra caixa isotérmica maior, que também deve ser vedada com fita adesiva.
¶ 4.2.2.2.2 Fracionamento de mel, cera de abelhas e própolis bruto
Em situações em que se fizer necessária a coleta de mel em tonéis ou outras embalagens de grandes dimensões que inviabilizem seu envio ao laboratório, assim como para a coleta de amostras de cera de abelhas e de própolis bruto, será necessário adotar os procedimentos de fracionamento de amostras.
É importante ressaltar que todo o procedimento de obtenção da amostra seja realizado em condições que permitam manter as características originais do produto e garantir que todos os utensílios a serem utilizados para o fracionamento estejam limpos e secos previamente à coleta, incluindo aqueles necessários à abertura da embalagem.
a. Materiais necessários
- Mesa ou bancada;
- Embalagens limpas e íntegras;
- Álcool 70%;
- Facas, conchas, colheres ou outros utensílios limpos adequados à homogeneização, fracionamento e coleta das amostras;
- Sacos-lacre;
- Envoltório plástico para a proteção da cinta de identificação da amostra;
- Balança;
- Caixa para o transporte das amostras;
- Envelopes ou sacos para a proteção da RAL e da cinta de identificação da amostra; e
- Cola e fita adesiva.
b. Procedimentos de coleta e acondicionamento
i. O lote e a embalagem devem ser selecionados aleatoriamente;
ii. A embalagem deve ser limpa e sanitizada previamente à sua abertura, utilizando-se álcool 70%;
iii. O responsável pela coleta deverá higienizar as mãos e proceder a abertura da embalagem;
iv. O mel deve ser homogeneizado com auxílio de uma colher ou concha e em seguida deve ser transferidas porções para uma embalagem íntegra e limpa até que se atinja a quantidade mínima de amostra (250g). Esta constituirá a embalagem primária da amostra;
v. O fracionamento de cera de abelhas e de própolis bruto se dá mediante o corte do produto em pedaços de tamanho correspondente ao peso mínimo da amostra (250g para a cera de abelha e 50g para o própolis bruto). A porção obtida deve ser inserida em sacos plásticos limpos, de primeiro uso, que serão posteriormente fechados, constituindo a embalagem primária da amostra;
vi. A embalagem primária deve ser cuidadosamente fechada e posteriormente inserida no saco-lacre juntamente com a cinta de identificação da amostra, previamente protegida; e
vii. Posteriormente, o saco deve ser lacrado acondicionada em caixa de transporte para o envio ao laboratório, em temperatura ambiente. Para melhor acondicionamento da amostra, buscando evitar que fique solta e sofra danos durante o transporte, recomenda-se a utilização de “calços”.
¶ 4.2.2.3 Amostragem de ovos e derivados
¶ 4.2.2.3.1 Coleta de amostras de ovo em natureza
O PACPOA contempla a realização de análises microbiológicas para ovos em natureza, que abrangem ovos de galinha, de codorna, de pata e de perua.
a. Materiais necessários
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Saco-lacre;
- Fita adesiva, cola e tesoura;
- Calços para proteção do transporte de ovos (se aplicável); e
- Caixas de transporte.
b. Número de amostras e quantidade mínima
A amostra deve ser composta de, no mínimo, 12 (doze) unidades de ovos.
Na escolha da amostra, não devem ser coletados ovos trincados, com fendas e quebra na casca. Para tanto, a embalagem escolhida deve ser aberta e a condição da casca dos ovos deve ser avaliada previamente à coleta.
c. Procedimentos de coleta e acondicionamento
i. Escolher aleatoriamente uma caixeta ou bandeja com 12 (doze) ovos;
ii. Inserir a bandeja em saco-lacre, juntamente com a cinta de identificação da amostra, previamente protegida. Convém frisar que a cinta identificadora ser posicionada ao redor da bandeja, de modo a não ocultar as informações do rótulo; e
iii. Lacrar o saco.
Os ovos são produtos frágeis, que podem se quebrar durante o transporte. A utilização da embalagem original pode prevenir parcialmente a quebra, já que o tipo de embalagem utilizado confere uma boa proteção ao produto. Ainda assim, se a embalagem de transporte da amostra ao laboratório tiver grandes dimensões, permitindo o deslocamento da embalagem primária no seu interior, pode haver quebra da casca e perda da amostra. Desta forma, ao acondicionar a amostra no interior da caixa transportadora, esta deve ser protegida contra possíveis impactos durante o transporte, utilizando-se um sistema “calços”.
¶ 4.2.2.3.2 Coleta de amostras de ovo líquido e ovo integral pasteurizado para análises microbiológicas e físico-químicas
A amostra deve ser coletada preferentemente em embalagem original. No entanto, há situações em que se faz necessária a obtenção de amostras em baldes ou outras embalagens de grandes dimensões, cujo envio ao laboratório se mostra inviável. Nestas situações será necessário adotar os procedimentos de fracionamento de amostras. É importante ressaltar que todo o procedimento de obtenção da amostra seja realizado em condições que permitam manter as características originais dos produtos.
Nos casos de amostragem para a realização de análises microbiológicas, cuidados especiais devem ser adotados de forma a proteger a amostra contra qualquer tipo de contaminação durante a sua manipulação. É imprescindível que todos os utensílios a serem utilizados para o fracionamento estejam estéreis ou sanitizados previamente à coleta, incluindo aqueles necessários à abertura da embalagem.
A escolha do lote a ser amostrado e da(s) embalagem(ns) deve ser aleatória.
¶ 4.2.2.3.2.1 Coleta de amostra para análise microbiológica
a. Materiais necessários
- Saco-lacre;
- Caixas de transporte de material isolante e material refrigerante;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Facas, conchas, colheres ou outros utensílios limpos ou estéreis para fracionamento ou homogeneização de amostras, se necessário;
- Fita adesiva, cola e tesoura;
- Luvas estéreis ou, na indisponibilidade, luvas de procedimento sanitizadas com álcool 70% (se for necessário o fracionamento do produto);
- Embalagens limpas, íntegras, de primeiro uso ou embalagens estéreis; e
- Álcool 70%.
b. Número de amostras e quantidade mínima
A amostra destinada à análise microbiológica de ovos líquidos deve ser composta de, no mínimo, 200 mL.
c. Procedimentos de coleta e acondicionamento
i. Higienizar e sanitizar com álcool 70% a mesa ou bancada a ser utilizada para o fracionamento do produto;
ii. Colocar o produto sobre a mesa ou bancada e limpar a embalagem primária externamente com álcool 70%;
iii. Calçar as luvas ou, na ausência delas, higienizar as mãos com água e sabão e, posteriormente, realizar a sanitização das mãos com álcool 70% ou produto equivalente, garantindo que as mãos estejam completamente secas previamente ao início do procedimento;
iv. Abrir a embalagem com os instrumentos (tesoura ou faca) esterilizados, sanitizados ou flambados, com cuidado para não contaminar o produto através de contato com superfícies ou qualquer objeto não estéril;
v. Com o auxílio de uma colher, concha ou outro utensílio adequado e devidamente esterilizado ou sanitizado transferir para uma embalagem limpa, íntegra e de primeiro uso ou estéril, porções de diversos pontos do produto até totalizar 200 mL;
vi. Fechar cuidadosamente a embalagem que recebeu a amostra, imediatamente após a coleta;
vii. Inserir a amostra no saco-lacre, juntamente com a cinta de identificação da amostra previamente protegida; e
viii. Lacrar o saco.
O produto amostrado deverá ser encaminhado ao laboratório em temperatura compatível à temperatura de conservação indicada na rotulagem, devendo a amostra ser acondicionada em caixa isotérmica, juntamente com o meio refrigerante, para envio ao laboratório.
¶ 4.2.2.3.2.2 Coleta de amostra para análises físico-químicas
a. Materiais necessários
- Saco-lacre;
- Caixas de transporte de material isolante e material refrigerante;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Conchas, colheres ou outros utensílios limpos para fracionamento ou homogeneização de amostras;
- Fita adesiva, cola e tesoura; e
- Embalagens limpas e íntegras (sacos plásticos, frascos com tampa).
b. Número de amostras e quantidade mínima
As amostras devem ser coletadas em triplicata e cada unidade amostral deverá possuir a quantidade mínima de 500 mL. É imprescindível que as três amostras pertençam ao mesmo lote.
c. Procedimentos de coleta e acondicionamento
Uma vez que a coleta de amostras em embalagens originais consiste em procedimentos já abordados neste Manual, serão descritos a seguir os procedimentos de fracionamento de amostras:
i. Após escolha aleatória, a embalagem a ser amostrada deve ser higienizada externamente com álcool 70%, assim como os utensílios a serem utilizados para a abertura da embalagem e para a obtenção das porções do produto, além das mãos do responsável pela coleta;
ii. Com o uso de conchas, colheres ou outros utensílios adequados, o produto deve ser homogeneizado e, posteriormente, devem ser transferidas porções do mesmo para uma embalagem íntegra e limpa até que se obtenha a quantidade mínima da amostra de 500mL;
iii. A embalagem com amostra deve ser cuidadosamente fechada, retirando-se o excesso de ar, se necessário; e
iv. Posteriormente a embalagem com a amostra deve ser inserida em saco-lacre, juntamente com a cinta identificadora da amostra, previamente protegida e o saco deverá ser lacrado. Para o acondicionamento e identificação da caixa de transporte devem ser adotados os mesmos cuidados já apresentados para as amostras destinadas às análises microbiológicas de ovo líquido, com acondicionamento da amostra em caixa isotérmica, junto ao meio refrigerante. Ressalta-se que a amostra de prova, contraprova e contraprova da empresa devem ser acondicionadas em sacos-lacre diferentes, lacrados individualmente.
¶ 4.2.2.3.3 Coleta de ovo desidratado
¶ 4.2.2.3.3.1 Coleta de amostra para análise microbiológica
a. Materiais necessários
- Fita adesiva, cola e tesoura;
- Saco-lacre;
- Caixas de transporte;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Conchas, colheres ou outros utensílios limpos ou estéreis para fracionamento ou homogeneização de amostras, se necessário;
- Fita adesiva, cola e tesoura;
- Luvas estéreis ou, na indisponibilidade, luvas de procedimento sanitizadas (se for necessário fazer fracionamento do produto);
- Embalagens limpas, íntegras e de primeiro uso ou estéreis; e
- Álcool 70%.
b. Número de amostras e quantidade mínima
A amostra destinada à análise microbiológica de ovos desidratados deve ser composta de, no mínimo, 200 g. A amostra deve ser escolhida aleatoriamente e ser enviada ao laboratório preferentemente em sua embalagem original
Caso a embalagem original do produto consista num recipiente de grande volume, é possível realizar o fracionamento da amostra, conforme descrito a seguir.
c. Procedimentos de coleta e acondicionamento
i. Higienizar e sanitizar com álcool 70% a mesa ou bancada a ser utilizada para o fracionamento do produto;
ii. Colocar o produto sobre a mesa ou bancada e limpar a embalagem primária externamente com álcool 70%;
iii. Calçar as luvas ou, na ausência delas, higienizar as mãos com água e sabão e posteriormente realizar a sanitização das mãos com álcool 70% ou produto equivalente, garantindo que as mãos se encontrem completamente secas previamente ao início do procedimento;
iv. Abrir a embalagem com os instrumentos (tesoura ou faca) esterilizados, sanitizados ou flambados, com cuidado para não contaminar o produto por meio de contato com superfícies ou qualquer objeto não estéril;
v. Com o auxílio de uma colher, faca, concha ou outros utensílios adequados e devidamente esterilizados, sanitizados ou flambados, transferir para embalagem limpa, íntegra e de primeiro uso, ou estéril, porções de diversos pontos do produto até totalizar 200 g;
vi. Fechar cuidadosamente a embalagem que recebeu a amostra imediatamente após a coleta, retirando o excesso de ar, se necessário;
vii. Inserir a amostra no saco-lacre, juntamente com a cinta de identificação da amostra previamente protegida; e
viii. Lacrar o saco.
O produto ovo desidratado é conservado em temperatura ambiente, portanto não há necessidade de utilização de caixa isotérmica para o seu transporte ao laboratório.
¶ 4.2.2.3.3.2 Coleta de amostra para análises físico-químicas
a. Materiais necessários
- Saco-lacre;
- Caixas de transporte;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Conchas, colheres ou outros utensílios limpos para fracionamento ou homogeneização de amostras, se necessário;
- Fita adesiva, cola e tesoura; e
- Embalagens limpas, íntegras.
b. Número de amostras e quantidade mínima
Devem ser coletadas amostras em triplicata em quantidade mínima de 500 g para cada unidade amostral. As 3 (três) amostras devem pertencer o mesmo lote.
c. Procedimentos de coleta e acondicionamento
As amostras devem ser encaminhadas ao laboratório preferentemente em suas embalagens originais.
Caso o produto seja acondicionado em embalagens com grandes volumes, que impossibilitem sua remessa na embalagem original, pode ser realizado o fracionamento, conforme procedimentos a seguir:
i. Após escolha aleatória, a embalagem a ser amostrada deve ser higienizada externamente com álcool 70%, assim como os utensílios a serem utilizados para a abertura da embalagem e para a obtenção das porções do produto, além das mãos do responsável pela coleta;
ii. Com o uso de conchas, colheres ou outros utensílios adequados, o produto deve ser homogeneizado e, posteriormente, devem ser transferidas porções do mesmo para uma embalagem íntegra e limpa até que se obtenha a quantidade mínima da amostra de 500 g;
iii. A embalagem com amostra deve ser cuidadosamente fechada, retirando-se o excesso de ar, se necessário; e
iv. Posteriormente a embalagem com a amostra deve ser inserida em saco-lacre, juntamente com a cinta identificadora da amostra, previamente protegida e o saco deverá ser lacrado. As amostras podem ser encaminhadas ao laboratório em temperatura ambiente.
¶ 4.2.2.3.3 Coleta de ovo em conserva ou semiconserva
Os ovos de codorna, de pata e de galinha podem ser elaborados em forma de conserva ou semiconserva. As conservas podem ser acondicionadas em vidros ou baldes e conservadas à temperatura ambiente, enquanto as semiconservas geralmente são acondicionadas em sacos plásticos ou baldes e devem ser mantidas sob refrigeração.
a. Materiais necessários
- Saco-lacre;
- Caixas de transporte, devendo ser isotérmica para a coleta de amostras de ovos em semiconserva;
- Material refrigerante, se necessário;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra; e
- Fita adesiva, cola e tesoura.
b. Número de amostras e quantidade mínima
A amostra deve ser composta de, no mínimo, 200 g de produto e deve ser enviada ao laboratório em sua embalagem original, após escolha aleatória do lote e da embalagem.
Se uma embalagem não for suficiente para atender a quantidade mínima de 200 g, devem ser colhidas quantas embalagens forem necessárias. Cumpre observar que para o cálculo da quantidade de amostra deve ser considerado o peso drenado, ou seja, sem considerar o líquido de imersão.
c. Procedimentos de coleta e acondicionamento
i. Selecionar amostras em embalagem original aleatoriamente;
ii. Coletar amostras do produto atendendo a quantidade mínima de 200 g;
iii. Inserir a amostra em saco-lacre;
iv. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
v. Lacrar o saco.
Destaca-se que se houver mais de uma unidade compondo a amostra, todas devem ser acondicionadas na mesma embalagem para lacração. Porém, antes de inserir na embalagem a ser lacrada, cada unidade deve ser envolvida por plástico bolha ou outro material a fim de evitar o impacto entre as embalagens e uma possível perda da amostra devido à rompimento da embalagem.
No caso das semiconservas, por se tratar de produto que requer refrigeração, a amostra deve ser acondicionada em caixa isotérmica
¶ 4.2.2.4 Amostragem de pescado e produtos da pesca e aquicultura
Entende-se por pescado os crustáceos, os moluscos, os peixes, os anfíbios, os répteis, os equinodermos e outros animais aquáticos direcionados à alimentação humana.
Devido a sua diversidade, as espécies de pescado apresentam diferentes características físico-químicas e microbiológicas, impactando nas análises a serem requeridas e nos procedimentos de coleta.
¶ 4.2.2.4.1 Coletas de amostra para análises de deteriora e adulteração química
As coletas para as análises físico-químicas, que incluem as coletas com suspeita de deteriora e adulteração química, podem ser realizadas em qualquer etapa do processamento do pescado, desde a recepção com o produto fresco, resfriado ou congelado, até o produto pronto a ser comercializado, desde que se tenha a identificação do lote que está sendo coletado.
a. Materiais necessários
- Mesa ou bancada;
- Faca;
- Tesoura e cola;
- Balança;
- Luvas de procedimento;
- Sacos plásticos transparentes, íntegros, limpos e de primeiro uso;
- Sacos-lacre;
- Termômetro calibrado;
- Caixa isotérmica;
- Materiais refrigerantes;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra; e
- EPIs (máscara, luvas de malha de aço etc.)
b. Número de amostras e quantidade mínima
As amostras devem ser coletadas em triplicata. Preferencialmente, deve-se coletar as amostras em suas embalagens originais, com peso de, no mínimo, 500g e pertencentes ao mesmo lote. É importante lembrar que as embalagens devem estar íntegras e lacradas.
Quando se tratar de espécies de pescado de pequeno porte ou que possuam peso inferior a 500g, deve-se coletar uma quantidade de indivíduos suficientes para compor uma unidade amostral de, no mínimo, 500g de peso. Para espécies de pescado de grande porte ou que possuam peso superior a 500g, deve fracionar o indivíduo removendo a cabeça, pedúnculo caudal e vísceras até obter um peso mínimo de 500g na unidade amostral.
É importante lembrar que as análises físico-químicas para avaliação de deteriora e adulteração química são realizadas nos tecidos musculares, por isso há necessidade de remoção de partes do pescado que possuam pouco ou nada de tecido muscular, como barbatanas, pedúnculo caudal e cabeça.
Atenção: Nos casos em que for solicitado o ensaio de fósforo total, a quantidade de amostra deve ser acrescida em 100 g. Portanto, a quantidade mínima de amostra deve ser de 600g.
Atenção: Quando se tratar de peixe salgado e salgado seco espalmados não deve ser realizado fracionamento das peças a serem amostradas, devendo ser coletada e enviada a peça inteira em cada uma das amostras de triplicata, para que sejam analisadas para umidade de acordo com o método cross section descrito no CODEX STAN 167 - 1989.
c. Procedimentos de coleta e acondicionamento
Preferencialmente o pescado deve ser coletado em sua embalagem original. Nos casos em que se fizer necessária a coleta de vários indivíduos ou o fracionamento de pescado de grande porte, devem ser adotados os procedimentos a seguir:
i. Limpar e higienizar a mesa ou bancada;
ii. Calçar as luvas;
iii. Aferir a temperatura de um dos produtos a ser coletado, sendo que esta temperatura deve ser registrada, posteriormente, na RAL;
iv. Retirar o pescado da caixa onde estiver acondicionado e:
- Pescado de pequeno porte: coletar, com a menor contaminação possível, o número de peças suficientes para atingir o peso mínimo da amostra. Inserir essas peças em embalagem plástica de primeiro uso, transparente e fechar a embalagem; e
- Pescado de grande porte: retirar a cabeça, as barbatanas e o pedúnculo caudal e seccionar o pescado, se necessário, de forma a obter pedaços com peso mínimo de 500g. Inserir o pedaço em saco plástico transparente, de primeiro uso.
v. Acondicionar a embalagem plástica com as amostras em saco-lacre;
vi. Inserir no saco-lacre a cinta de identificação da amostra, devidamente protegida; e
vii. Lacrar o saco.
Esses procedimentos devem ser repetidos para cada unidade amostral da triplicata.
Após a coleta, as amostras devem ser congeladas junto ao meio refrigerante, previamente ao envio ao laboratório. Em seguida, as amostras lacradas devem ser acondicionadas em uma caixa isotérmica, utilizando-se meio refrigerante em quantidade suficiente para a preservação da temperatura da amostra até a chegada ao laboratório.
¶ 4.2.2.4.2 Coleta de amostra para análise de desglaciamento
a. Materiais necessários
- Mesa ou bancada;
- Balança;
- Luvas de procedimento;
- Sacos plásticos transparentes, íntegros, limpos e de primeiro uso;
- Sacos-lacre;
- Termômetro calibrado;
- Caixa isotérmica;
- Materiais refrigerantes;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra; e
- Tesoura, cola e fita adesiva.
b. Número de amostras e quantidade mínima
As amostras devem ser coletadas em triplicata. Cada uma das três amostras deve ser composta por 6 (seis) unidades de produtos congelados. A amostra de prova, composta por 6 (seis) unidades de produto, deve ser encaminhada ao LFDA para análise, e as demais devem ser utilizadas como contraprova. Uma amostra de contraprova (com 6 unidades) deve ser entregue ao detentor ou ao responsável pelo produto e a outra amostra de contraprova (com 6 unidades) deve ser enviada juntamente com a amostra de prova, sendo, portanto, mantida em poder do laboratório conforme § 1° do art. 470 do Decreto nº 9.013 de 2017.
Preconiza-se que a amostra seja coletada em embalagem original, sendo que o peso máximo da embalagem com produto é de 2 kg por unidade amostral. As amostras coletadas devem ser do mesmo lote e possuir o mesmo peso a ser verificado na embalagem.
Vale destacar que a coleta de amostras para análise de desglaciamento não se aplica aos produtos à granel.
c. Procedimentos de coleta e acondicionamento
i. Selecionar as amostras ao acaso;
ii. Coletar três amostras obedecendo a quantidade de 6 (seis) unidades de produto em cada amostra. As amostras devem ser coletadas congeladas em sua embalagem primária original;
iii. Aferir a temperatura de um dos produtos a ser coletado, sendo que esta temperatura deve ser registrada, posteriormente, na RAL;
iv. Em seguida, as seis unidades que compõem cada uma das amostras devem ser acondicionadas em um mesmo saco-lacre;
v. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
vi. Lacrar o saco.
Após a coleta, as amostras de pescado devem ser mantidas congeladas junto ao meio refrigerante, previamente ao envio ao laboratório. Em seguida, as amostras lacradas devem ser acondicionadas em uma caixa isotérmica com meio refrigerante em quantidade suficiente para a preservação da temperatura da amostra até a chegada ao laboratório
¶ 4.2.2.4.3 Coleta de amostra para análise de histamina
Para análises que tem por objetivo a avaliação da formação de histamina, o pescado a ser amostrado deve pertencer às seguintes famílias: Carangidae, Gempylidae, Istiophoridae, Scombresocidae, Engraulidae, Clupeidae, Coryphaenidae e Pomatomidae.
a. Materiais necessários
- Mesa ou bancada;
- Balança;
- Luvas de procedimento;
- Sacos plásticos transparentes, íntegros, limpos e de primeiro uso;
- Sacos-lacre;
- Termômetro calibrado;
- Caixa isotérmica;
- Material refrigerante;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Tesoura, cola e fita adesiva;
- Caneta com marcação indelével; e
- EPIs, como máscara e luvas de malha de aço.
Convém ressaltar que, antes de iniciar a coleta, os sacos plásticos que receberão as amostras devem ser organizados em 3 (três) conjuntos de 9 (nove) unidades, numerados de 1 a 9, totalizando 27 (vinte e sete) sacos.
b. Número de amostras e quantidade mínima
i. Peixes com peso superior a 3 (três) kg
As amostras devem ser coletadas em triplicata. Devem ser selecionadas 9 (nove) unidades de peixes de um mesmo lote. A obtenção da amostra se dá com a retirada da cabeça do pescado e posterior realização de cortes de modo a obter 3 (três) pedaços de cada um dos peixes selecionados (Figura 37). A amostra, constituída de pedaços do peixe, deve ter peso mínimo de 500g cada. O procedimento deve ser repetido de forma a obter 9 (nove) unidades de amostra em triplicata, o que totaliza 27 (vinte e sete) unidades.

Figura 37: Amostragem de peixes com peso superior a 3 kg
ii. Peixes com peso inferior a 3 (três) kg
Em situações em que os peixes tenham peso inferior a 3 (três) kg, como sardinhas, cavalinhas, entre outros, devem ser selecionados quantos peixes forem necessários para formar 500g por unidade de amostra. Se o produto selecionado para amostragem estiver congelado, é necessário promover a separação dos peixes previamente à coleta. Com as peças já soltas, devem ser coletadas quantas peças forem necessárias para obter uma porção de 500 g (peso mínimo).
iii. Produtos enlatados ou em embalagens flexíveis
Para a coleta de amostras de produtos enlatados ou em embalagens flexíveis esterilizáveis também devem ser coletadas 3 (três) amostras de nove (9) unidades cada, totalizando 27 (vinte e sete) unidades. Estes conjuntos correspondem às amostras da triplicata. Cada uma das 9 (nove) unidades que compõem a amostra, devem possuir peso mínimo de 500g. Caso os produtos nas embalagens contenham menos de 500g, devem ser coletadas quantas embalagens forem necessárias para atingir o peso mínimo.
É recomendável a utilização de recursos que permitam manter essas embalagens unidas, tais como o acondicionamento do conjunto de embalagens em sacos plásticos ou a união destas com fita adesiva, para posterior inserção no saco-lacre.
Assim como nas demais coletas, as unidades devem ser numeradas de 1 a 9 e devem pertencer ao mesmo lote.

Figura 38: Conjuntos de embalagens constituindo a amostra
c. Procedimentos de coleta e acondicionamento
i. Selecionar as amostras ao acaso;
ii. Coletar 3 (três) amostras (triplicata) de 9 (nove) unidades, tendo cada unidade o peso mínimo requerido;
iii. Aferir a temperatura de um dos produtos a ser coletado, sendo que esta temperatura deve ser registrada, posteriormente, na RAL;
iv. Em seguida, as nove unidades que compõem cada uma das amostras devem ser acondicionadas em sacos plásticos de primeiro uso, previamente identificados de 1 a 9;
v. Inserir as nove unidades que compõem cada amostra, devidamente identificadas com seus respectivos números, no saco-lacre;
vi. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
vii. Lacrar o saco.
Em produtos resfriados e rotulados, a temperatura de conservação da amostra deve corresponder à temperatura indicada no rótulo.
¶ 4.2.2.4.4 Coleta de amostra para pesquisa de DNA
a. Número de amostras e quantidade mínima
As amostras devem ser coletadas em triplicata. Deve-se obter 18 (dezoito) fragmentos musculares de pescado, nos quais devem ser divididos em 3 (três) amostras, sendo 6 (seis) fragmentos para a amostra de prova, 6 (seis) fragmentos para a contraprova LFDA/SIF e 6 (seis) fragmentos para a contraprova da empresa.
As amostras devem ser obtidas de pescado congelado, embalado para comercialização, ou pescado resfriado pronto para ser embalado. Caso o produto esteja congelado, deve ser realizado o descongelamento prévio.
b. Materiais necessários
- Mesa ou bancada devidamente higienizada;
- Faca;
- Termômetro calibrado;
- Recipiente para o descongelamento da amostra, se necessário;
- Tesoura, cola e fita adesiva;
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra;
- Luvas de procedimento;
- Lâmina de bisturi nº 22 ou 24;
- Recipientes vedáveis de primeiro uso (eppendorf ou tubos falcon);
- Sacos plásticos transparentes, íntegros, limpos e de primeiro uso;
- Sacos-lacre;
- Álcool 70% a 95%;
- Caixa isotérmica; e
- Materiais refrigerantes.
c. Procedimentos de coleta e acondicionamento
i. Organizar todo o material sobre a bancada para que seja minimizada a contaminação;
ii. Realizar a aferição da temperatura do produto;
iii. Selecionar o pescado que constituirá a amostra. Caso o produto esteja congelado, promova o descongelamento prévio, protegido em embalagem, acomodando-o em um recipiente com água para promover o descongelamento até o ponto que se torne possível realizar o corte com lâmina de bisturi;
iv. Remover o pescado da embalagem (posta, ou filé, ou qualquer que seja a apresentação do pescado);
v. Calçar luvas e retirar a lâmina de bisturi estéril de seu invólucro;
vi. Realizar dezoito (18) pequenos cortes em diferentes áreas da porção muscular de uma única peça de peixe, obtendo 18 fragmentos de aproximadamente 0,5 cm³ (meio centímetro cúbico) cada. Lembre-se que os fragmentos devem estar sem escamas, sem pele, sem resíduos de vísceras;
vii. Acondicionar os fragmentos em recipientes vedáveis de primeiro uso, estéreis (eppendorf ou tubos falcon). Quando utilizado o eppendorf de 2 mL, é recomendável a colocação de apenas dois fragmentos em cada recipiente, a fim de permitir a correta fixação no álcool;
viii. Completar o recipiente com álcool 70% a 95% para fixação do tecido muscular.
Certifique-se de que os fragmentos permaneceram completamente imersos no álcool e tampe bem os recipientes, verificando se não há vazamentos;
ix. Inserir a amostra no saco-lacre;
x. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
xi. Lacrar o saco.
Atenção: Antes de realizar uma nova coleta, preconiza-se a troca das luvas e lâminas de bisturi.
Para pesquisa de fraudes por meio das análises de DNA do pescado, a amostra deve ser mantida em temperatura ambiente. Para acondicionamento das amostras em caixa isotérmica, deve-se utilizar “calços” de papelão ou isopor, para evitar que a amostra fique solta, uma vez que a amostra não acompanha material refrigerante.
¶ 4.2.2.4.5 Coleta de amostra para análises microbiológicas
a. Número de amostras e quantidade mínima
Deve ser coletada apenas a amostra de prova. Quando houver necessidade de coleta de amostras representativas (n≥5), todas as amostras devem pertencer ao mesmo lote de produção.
A quantidade mínima de amostra deve ser de 200g de produtos resfriados ou congelados.
Para produtos cuja apresentação seja inferior ao peso mínimo, devem ser coletadas tantas unidades necessárias para se obter o peso mínimo de 200g. Neste caso, as unidades devem ser do mesmo lote, data de fabricação e linha de produção.
Moluscos bivalves
No caso de amostras de moluscos bivalves, o peso mínimo de amostra a ser coletado é de 200 g da parte comestível do bivalve. Portanto, ao obter a amostra, deve ser descontado o peso das conchas. Como o peso varia muito a depender da espécie, recomenda-se que se obtenha o peso médio do bivalve desconchado de forma a estimar o número de unidades a serem coletadas.
É sempre recomendável a coleta de produtos em embalagens originais, porém, havendo necessidade de fracionamento de amostras para análises microbiológicas, devem ser adotados os procedimentos de fracionamento já descritos.
Para a coleta de amostras de moluscos bivalves em natureza, que usualmente se apresentam em embalagens a granel ou em redes, devem ser seguidas as instruções apresentadas a seguir:
b. Materiais necessários
- Mesa ou bancada higienizada;
- Embalagens limpas, íntegras e de primeiro uso;
- Sacos-lacre;
- Álcool 70%;
- Luvas estéreis ou, na indisponibilidade, luvas de procedimento sanitizadas com álcool 70%;
- Tesoura ou faca;
- Fita adesiva e cola;
- Balança;
- Caixa para transporte e material refrigerante;
- Termômetro calibrado; e
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra.
c. Procedimentos de coleta e acondicionamento
i. Selecionar a amostra de forma aleatória;
ii. Se o produto estiver acondicionado em embalagens de grande volume, sanitizar a superfície externa da embalagem, com álcool 70%, previamente a sua abertura;
iii. Lavar as mãos com água e sabão e calçar as luvas. Na indisponibilidade destas, sanitizar as mãos com álcool 70% ou produto equivalente;
iv. Coletar a quantidade unidades necessária para atingir o peso mínimo da amostra;
v. Acondicionar as unidades em saco plástico, concretizando-se a embalagem primária e, posteriormente, no saco-lacre;
vi. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
vii. Lacrar o saco.
Para a coleta de moluscos bivalves comercializados em caixas, as unidades que constituem a amostra devem ser retiradas das caixas prontas para venda. As unidades de moluscos bivalves coletadas podem ser acondicionadas diretamente no saco-lacre, considerando a forma peculiar de comercialização deste tipo de produto (em redes ou outras embalagens não convencionais).
Embora este seja um procedimento usual e aceito pelos laboratórios, recomenda-se que o bivalve seja acondicionado primeiramente em um saco plástico transparente. Esse procedimento evita extravasamento de líquido, tendo em vista que o saco-lacre não tem a função de vedação da amostra.
Em produtos resfriados e rotulados, a temperatura de conservação da amostra deve corresponder à temperatura indicada no rótulo.
¶ 4.2.2.5 Coleta de amostras para pesquisa de Listeria monocytogenes em produtos prontos para consumo
Devido às características de sobrevivência do patógeno, a coleta para análise de Listeria monocytogenes é direcionada aos produtos de origem animal prontos para o consumo, que apresentem pH > 4.4 (superior a quatro ponto quatro), atividade de Água > 0.92 (superior a zero ponto noventa e dois) ou concentração de cloreto de sódio < 10 % (inferior a dez por cento).
Produtos cárneos que atendem as características para coleta são o presunto cozido, presunto defumado, apresuntado, mortadela, fiambre, lanche, salsicha, salsichão, lombo cozido, lombo defumado, paleta cozida e a paleta defumada.
Quanto aos produtos lácteos são todos os tipos de queijos, com exceção dos queijos de baixa umidade.
Para produtos de pescado podem ser coletados: filé de salmão defumado e peixe defumado, ambos resfriados ou congelados, bastonetes de surimi congelados, produtos à base de surimi congelados, camarão cozido congelado e molusco bivalve cozido congelado.
Atenção: Para a pesquisa de Listeria monocytogenes não devem ser coletados:
- Produtos que são submetidos ao processamento térmico em sua embalagem primária impermeável final conhecidos como “cook-in” e que não sejam manipulados após esta etapa;
- Produtos submetidos ao processo de pasteurização pós-processamento térmico (cozimento) em sua embalagem primária impermeável final e que não sejam manipulados após esta etapa. Salsichas em conserva também não devem ser consideradas para esta análise;
- Produtos cozidos que foram submetidos ao processamento térmico na embalagem primária impermeável final e que não sejam manipulados após esta etapa; e
- “Jerked Beef", Charque, Miúdo Salgado Dessecado e Miúdo Salgado Curado Dessecado porque não se aplicarem sua amostragem oficial para o Programa Nacional de Controle de Patógenos (PNCP) Listeria monocytogenes, por não serem produtos prontos para consumo elegíveis para coleta tendo como base a Instrução Normativa MAPA nº 9, de 8 de abril de 2009.
a. Número de amostras e quantidade mínima
Deve ser coletada somente a amostra de prova, indicativa (n=1). A quantidade mínima de amostra varia de acordo com o produto coletado, sendo importante consultar a tabela de quantidade mínima constante no “MANUAL 3 POA – Procedimentos Específicos para o Recebimento de Amostras na Área de Físico-Química e Microbiologia de Produtos de Origem Animal”
b. Materiais necessários
- Mesa ou bancada higienizada;
- Embalagens limpas, íntegras e de primeiro uso;
- Sacos-lacre;
- Álcool 70%;
- Luvas estéreis ou, na indisponibilidade, luvas de procedimento sanitizadas com álcool 70%;
- Tesoura, cola e fita adesiva;
- Balança;
- Caixa para transporte e material refrigerante;
- Termômetro calibrado; e
- Envelopes e sacos para a proteção da RAL e da cinta de identificação da amostra.
c. Procedimentos de coleta e acondicionamento
i. Selecionar a amostra de forma aleatória;
ii. Se o produto estiver acondicionado em embalagens de grande volume, sanitizar a superfície externa da embalagem, com álcool 70%, previamente a sua abertura;
iii. Lavar as mãos com água e sabão e calçar as luvas. Na indisponibilidade destas, sanitizar as mãos com álcool 70% ou produto equivalente;
iv. Coletar a quantidade unidades necessária para atingir o peso mínimo da amostra;
v. Acondicionar amostra no saco-lacre;
vi. Inserir no saco-lacre a cinta de identificação da amostra devidamente protegida; e
vii. Lacrar o saco.
Para produtos cárneos e lácteos devem ser coletados, preferencialmente, os produtos fatiados ou fracionados pelo próprio estabelecimento fabricante. Entre os queijos, inclui-se também o queijo ralado. É sempre indicada a coleta do produto em sua embalagem primária original. No entanto, há situações em que se faz necessário o fracionamento da amostra. Por se tratar de amostra para análise microbiológica, é imprescindível adotar todos os cuidados para evitar a contaminação da amostra, que incluem sanitização de superfícies e utensílios, uso de luvas, e embalagens estéreis, sanitizadas, entre outros.
Em produtos resfriados e rotulados, a conservação da temperatura deve estar de acordo com a indicação no rótulo. No caso de produtos fracionados, sempre que possível, deve ser encaminhada uma cópia do rótulo junto à amostra. É importante ressaltar que, na ausência do rótulo, os laboratórios oficiais podem rejeitar as amostras de produtos resfriados que apresentem temperatura, no ato do recebimento, fora do intervalo de 2 a 8º C. Já para produtos congelados, as amostras desacompanhadas de rotulagem devem estar sólidas, sem sinais de descongelamento em nenhuma parte.
Em relação ao preenchimento da documentação de RAL, deve-se ressaltar que, embora a Norma Interna DIPOA nº 01, de 09 de agosto de 2013, estabeleça a realização de análise de mesófilos, na RAL deve ser colocado apenas o código M20, referente à análise microbiológica de Listeria monocytogenes.
¶ 4.2.2.6 Instruções para coleta e remessa de água de abastecimento
Com a publicação da Portaria GM/MS nº 888, de 4 de maio de 2021, que trata da potabilidade da água, o DIPOA não realizará coletas de amostras oficiais de água de abastecimento dentro do PACPOA.
Contudo, conforme orientações constantes no Ofício-Circular nº 15/2022/CGI/DIPOA, de 2 de maio de 2022, (SEI 21429913) o serviço oficial poderá em situações excepcionais coletar amostras para verificar a qualidade da água em estabelecimentos sob SIF, a fim de subsidiar a fiscalização.
Além disso, caberá ao SIF realizar a verificação oficial in loco do plano de amostragem do estabelecimento que se baseia na avaliação da identificação dos pontos de coleta de consumo da água nas áreas de produção industrial de produtos comestíveis, e na mensuração direta dos parâmetros de cloro residual livre e pH.
Nos casos em que houver coleta de amostra para análise microbiológica, os resultados de cloro residual livre e pH devem ser informados na RAL.
Logo, as orientações abaixo devem ser consideradas para as situações de excepcionalidade das coletas oficiais de água, conforme Ofício-Circular nº 15/2022/CGI/DIPOA (SEI 21429913) .
Tabela 2. Condições para acondicionamento, conservação e tempo entre coleta e análise dos parâmetros físico-químicos básicos de potabilidade em amostra de água.
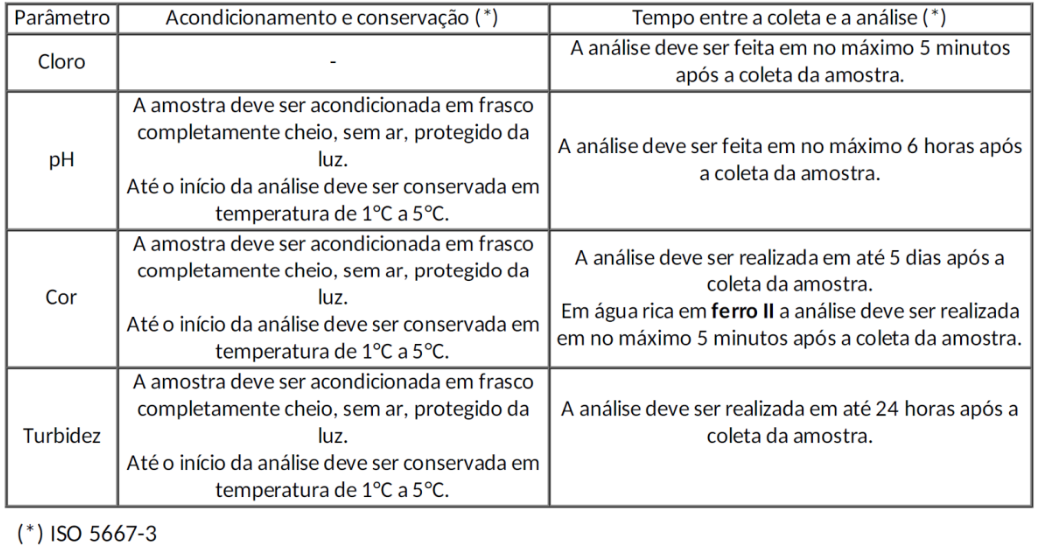
Orientações quanto à aplicação do Ofício-Circular nº 15/2022/CGI/DIPOA, de 2 de maio de 2022, (SEI 21429913):
a. Os estabelecimentos que recebem água potável da rede pública (Sistema de Abastecimento de Água - SAA) não necessitam de aprovação de um plano de amostragem junto a autoridade de saúde pública, tendo em vista não serem os responsáveis pelo sistema. Não obstante, os estabelecimentos podem apresentar um único plano de amostragem para aprovação junto a saúde pública desde que atenda a Portaria GM/MS nº 888, de 2021, e o Ofício-Circular nº 15/2022 (contemplação dos pontos de coleta de consumo da água nas áreas de produção industrial de produtos comestíveis);
b. As análises do responsável pelo SAA (rede pública) são destinadas para atender o plano de amostragem aprovado junto a autoridade de saúde pública e, assim como as análises realizadas pela própria autoridade de saúde pública em ação de vigilância da qualidade de água, são parte das garantias do insumo fornecido ao estabelecimento. As análises dos quadros I, II e III do Ofício-Circular nº 15/2022 prestam a afiançar a garantia, pelo estabelecimento, da manutenção da qualidade da água, independente da forma de abastecimento ou de captação, no pontos de consumo nas áreas de produção industrial de produtos comestíveis; e
c. A submissão e a eventual aprovação do plano de amostragem junto a autoridade de saúde pública não cabem à fiscalização do MAPA. Não obstante, independentemente de haver ou não a exigência de aprovação do plano de amostragem perante a autoridade de saúde pública conforme os casos previstos na Portaria GM/MS nº 888, de 2021, o estabelecimento deve possuir o plano de amostragem em seu programa de autocontrole para execução do disposto nos quadros I, II e III do Ofício-Circular nº 15/2022, em pontos de consumo das áreas de produção industrial de produtos comestíveis. Este plano de amostragem fica submetido a fiscalização do MAPA.
¶ 4.2.2.6.1 Análises microbiológicas
a. Materiais necessários
- Bolsa de coleta ou frascos estéreis com tiossulfato de sódio (fornecido pelos laboratórios);
- Luvas estéreis;
- Álcool 70%; e
- Lacres ou sacos lacres.
b. Quantidade mínima
Os frascos de coleta devem ter capacidade de no mínimo 300ml sendo necessário que estejam preenchidos com até 2/3 de seu volume.
c. Procedimentos de coleta
i. Higienizar a torneira com álcool 70%;
ii. Calçar as luvas ou, na ausência destas, higienizar as mãos com água a sabão e posteriormente realizar a sanitização das mãos com álcool 70% ou produto equivalente, garantindo que as mãos se encontram completamente secas previamente ao início do procedimento;
iii. Abrir a torneira, deixando a água escoar por cerca de 3 minutos. Ajustar a abertura da torneira em fluxo baixo de água;
iv. Destacar a parte superior da bolsa de coleta e com auxílio das fitas laterais, abrir a bolsa. No caso de frasco de coleta abrir a tampa tomando cuidado com as bordas do frasco;
v. Coletar a amostra evitando tocar as paredes ou boca do frasco nas bordas da torneira;
vi. No caso de bolsa de coleta, dobrar quatro vezes a parte superior e dobrar as pontas do saco no sentido contrário ao que foi inicialmente dobrado, fixando-as.
No caso de frasco, fechar com cuidado;
vii. Inserir as bolsas ou frascos no saco ou saco lacre e a cinta de identificação da amostra, devidamente protegida, se necessário;
viii. Lacrar o saco lacre ou o saco de amostras;
ix. Acondicionar a amostra; e
x. Depositar o documento oficial de requisição de análise em um envelope, lacrar e prendê-lo com fita adesiva na tampa da caixa.
¶ 4.2.2.6.2 Análises físico-químicas
a. Materiais necessários
- Frascos de primeiro uso;
- Frascos de cor âmbar (Figura 39), de acordo com as análises que serão solicitadas. Observar o disposto na Tabela 2; e
- Lacres ou sacos lacres.

Figura 39: Frasco de Vidro âmbar 500 e 1000 ml.
b. Quantidade mínima
Os frascos de coleta devem ter capacidade de no mínimo 1.000ml.
c. Procedimentos de coleta
i. Abrir a torneira, deixando a água escoar por cerca de 3 minutos. Ajustar a abertura da torneira em fluxo baixo de água;
ii. Abrir os frascos de coleta;
iii. Inserir os frascos no saco ou saco lacre e a cinta de identificação da amostra, devidamente protegida, se necessário;
iv. Lacrar o saco lacre ou o saco de amostras;
v. Acondicionar a amostra; e
vi. Depositar o documento oficial de requisição de análise em um envelope, lacrar e prendê-lo com fita adesiva na tampa da caixa.
¶ 5. Base legal e documentos de referência
¶ 5.1 BASE LEGAL
Os atos legais e normativos atualizados do Ministério da Agricultura e Pecuária (MAPA) podem ser acessados através do link:
Legislação em inspeção de produtos de origem animal — Ministério da Agricultura e Pecuária
Os atos legais e normativos atualizados da ANVISA/MS podem ser acessados através dos links:
ANVISA/MS: http://antigo.anvisa.gov.br/legislacao#/
¶ 5.2 DOCUMENTOS DE REFERÊNCIA
| IDENTIFICAÇÃO DO DOCUMENTO | EMISSOR | DATA DA PUBLICAÇÃO | ASSUNTO |
| Ofício nº 88/2019/CRISC/CGPE/DIPOA/SDA, de 03 de outubro de 2019 (21000.071125/2019-11) | DIPOA/SDA/MAPA | 03/10/2019 | Quadro resumo das carreiras que possuem competência, com atribuição legal, para a coleta de amostras de produtos de origem animal para atendimento aos programas de controle oficial. |
| Ofício-Circular nº 15/2022/CGI/DIPOA/SDA/MAPA (21000.030734/2022-15) | CGI/DIPOA/SDA/MAPA | 02/05/2022 | Água de abastecimento. Produto de Origem Animal. Verificação oficial. |
| Ofício-Circular nº 4/2022/CGPE/DIPOA/SDA/MAPA (21000.079981/2021-21) | CGPE/DIPOA/SDA/MAPA | 12/05/2022 | Aves. Análises laboratoriais. |
| OFÍCIO-CIRCULAR Nº 19/2023/DIPOA/SDA/MAPA (21000.040492/2023-41) | DIPOA/SDA/MAPA | 23/05/2023 | Fiscalização. Amostras Oficiais. Controle da guarda. |
- Raw Beef Product Sampling – USDA FSIS 2/27/2019, disponível em: https://www.fsis.usda.gov/wps/wcm/connect/50c9fb74-c0db-48cd-a682b399ed6b70c0/29_IM_Raw_Beef_Prod_Sampling.pdf?MOD=AJPERES FSIS DIRECTIVE 10,010.1 Rev. 4, 8/20/15.
Mais informações podem ser obtidas no Portal Agro:
https://www.gov.br/agricultura/pt-br/assuntos/inspecao/produtos-animal/analises-laboratoriais
https://www.gov.br/agricultura/pt-br/assuntos/inspecao/produtos-animal/controle-de-patogenos
A consulta e a obtenção das diretrizes atualizadas do Ministério da Agricultura e Pecuária (MAPA) podem ser realizadas através dos links:
https://www.gov.br/agricultura/pt-br/assuntos/defesa-agropecuaria
https://sigsif.agricultura.gov.br/primeira_pagina/extranet/SIGSIF.html
http://sistemasweb.agricultura.gov.br/pages/PGA-SIGSIF.html
Os links externos aqui inseridos encontravam-se disponíveis na data de publicação do presente instrumento.
¶ 6. Disposições Gerais
As sugestões para aprimoramento ou possíveis correções deste documento devem ser direcionadas ao Departamento responsável, para alinhamento das melhores práticas de mercado, legislação vigente e/ou regulamentações, que não tenham sido contempladas na versão vigente.
¶ 7. Histórico de revisão
| Versão | Conteúdo alterado | Data | Motivo |
|---|---|---|---|
| 6.0 | Inclusão dos tópicos: Folha de rosto, Folha resumo, Disposições gerais e Histórico de revisão. | 05/11/2021 | Transcrição do manual para o modelo de manualização validado pela SDA no Projeto de elaboração do modelo de manualização da SDA. (processo de homologação: 21000.095618/2022-33) |
| Item 5 | 18/02/2022 | Atualização | |
| Item 8 | 24/02/2022 | Inclusão dos anexos VI, VII, VIII e IX | |
| Item 5 | 25/02/2022 | Atualização das referências | |
| Item 5 | 06/05/2022 | Atualização das referências: ofício-circular nº 15/2022/CGI/DIPOA/SDA/MAPA (21000.030734/2022-15) | |
| 7.0 | Itens 4.1.3.1; 4.1.4.3; e 4.2.4.2 | 12/05/2022 | Atualizações sobre as possibilidades de contraprova (decreto nº 10.468 de 2020), sobre água de abastecimento (publicação do ofício-circular nº 15/2022/CGI) e análises de RUP (publicação da portaria MAPA nº 557 de 2022). Processo 21000.042784/2022-37. |
| Item 4.2.1.1.3, letra c | 10/08/2022 | Incluída frase adicional de atenção após o item xvi, da letra c (21000.075633/2022-65) | |
| Item 4.2.1.1.3, letra c | 15/08/2022 | Alterada a frase adicional de atenção após o item xvi, da letra c, conforme reencaminhado pelo processo 21000.075633/2022-65 (prazo de 7 dias corrigido para 96 horas). | |
| Item 4.2.2.1.2. | 18/08/2022 | Incluída frase adicional de atenção após a letra “b” (21052.014418/2022-82). | |
| Item 4.2.7. | 04/11/2022 | Atualização sobre os procedimentos de vigilância e mitigação do risco da Encefalopatia Espongiforme Bovina - EEB nos estabelecimentos de abate e revisão de configuração (21000.095618/2022-33, SEI 24288427) | |
| Item 4.2.4.2 | 28/11/2022 | Inclusão de esclarecimento sobre a aplicabilidade dos parâmetros de RUP para peito sem pele e sem osso (21000.106166/2022-22). | |
| 8.0 | diversos | 26/01/2023 | Revisão geral de conteúdo (21000.003108/2023-29). |
| Item 4.2.2.1.1 | 19/04/2023 | Reinclusão de frase de “atenção” ao final do item (21000.075633/2022-65, SEI 27414923). | |
| item 4.2.2.6 | 26/04/2023 | Inclusão de orientações quanto à aplicação do Ofício-Circular nº 15/2022/CGI/DIPOA, de 2 de maio de 2022 (21012.001309/2023-52). | |
| item 4.2.2.5 | 28/04/2023 | Não se aplica a coleta de jerked beef para o PNCP de L. monocytogenes (21000.023044/2023-82). | |
| Item 4.2.1.3.2 | 21/07/2023 | Inclusão de novo item e renumeração sequencial (21000.003108/2023-29, SEI 29532478). | |
| item 4.2.2.5 | 15/08/2023 | Não se aplica a coleta de Jerked Beef, Charque, Miúdo Salgado Dessecado e Miúdo Salgado Curado Dessecado para o PNCP de L. monocytogenes (21000.023044/2023-82, SEI 29964191). | |
| item 4.2.1.4 | 11/03/2024 | Revisão de todo o conteúdo deste item (21000.095618/2022-33) | |
| itens 4.1.1, 4.1.5 e 4.2.1.1.3 (texto marcado em verde) | 16/04/2024 | 21000.021361/2024-45 - Ofício 8 | |
| item 4.2.2.1.1 | 05/07/2024 | 21000.021361/2024-45 - Ofício 11 | |
| item 8 - anexos XI e XII | 07/02/2025 | 21000.021361/2024-45 - Ofício 5 (40504708) | |
| Itens diversos | 23/01/2026 | 21000.021361/2024-45 - Ofício 7 (49915578) | |
| Item 4.2.1.3.1 , c, ix e 4.2.2.1.3, b e c - (texto marcado na cor amarela temporariamente) | 19/02/2026 | 21000.021361/2024-45 -Ofício 8 (50516709) |
¶ 8. Anexos